特洛細胞在動脈粥樣硬化小鼠頸動脈血管損傷修復中的變化
景德龍,姜秋燕,肖園園,許瑩,田虎 濟南市濟鋼醫院,濟南500;臨沂金鑼醫院;山東第一醫科大學第一附屬醫院(山東省千佛山醫院)
自21世紀以來,隨著全民生活水平的不斷提高,高油脂、高鹽飲食日益成為人民生活的常態,由此引發的心血管疾病發病率也不斷升高[1]。動脈粥樣硬化是一個由多種免疫細胞、炎癥細胞共同參與的不可逆轉的病理生理學過程,最終導致目標血管狹窄閉塞,引起相應組織、器官缺血壞死[2]。特洛細胞是20世紀初期發現的間質干細胞來源的新型細胞,具有形成三維網狀支架結構的功能,在多種組織器官中發揮支撐作用;還具有為組織內實質細胞傳遞細胞間信號物質的作用,參與調節實質細胞的增殖、修復和凋亡過程[3,4]。已有研究在小鼠主動脈和頸動脈中發現特洛細胞的存在,并證實在多個特洛細胞之間可以形成三維網狀結構,在維持血管壁正常結構方面發揮關鍵作用[5]。在臨床外科實際工作中,我們發現動脈粥樣硬化的患者術后血管壁恢復時間更長。而特洛細胞作為動脈血管壁內維持三維結構的重要細胞群,在動脈粥樣硬化過程中是否出現形態結構的改變,是否參與粥樣硬化的病理過程均尚未可知。為了深入了解特洛細胞在動脈粥樣硬化血管銳性損傷修復過程中的變化,我們于2019年1月~2020年3月進行了如下研究。
1 材料與方法
1.1 材料 動物:雄性Apo E基因敲除(Apo E-/-)小鼠30只,6周齡,無特殊病原體級,體質量(39±6)g;正常SPF級小鼠30只,6周齡,體質量(40±9)g;實驗動物均購于北京維通利華實驗動物有限公司,每5只小鼠放于一個飼養箱內飼養,室溫23 ℃、相對濕度55%,保證小鼠飲食飲水自由。主要試劑:二甲苯購于國藥集團化學試劑有限公司;檸檬酸抗原修復液(pH 6.0,G1202)、BSA試劑(G5001)、CD117(1∶500稀釋,GB11073)、血小板衍生生長因子受體(PDGFR,1∶200稀釋,GB11261)、山羊抗兔二抗(1∶200稀釋,G23303)均購于武漢賽維爾生物科技有限公司,CD34抗體(1∶3 000稀釋,AB81289)購于美國Abcam公司。主要儀器:病理切片機(RM2016)購于上海徠卡儀器有限公司,動物便攜式超聲顯像(CCS2022)購于北京Palmary電子儀器有限公司,熒光顯微鏡(XSP-C204)購于中國CIC公司。
1.2 動物分組及動脈粥樣硬化建模 選擇Apo E-/-小鼠30只作為觀察組,采用高脂飲食的方法建立動脈粥樣硬化小鼠模型[6]。高脂飲食10周后,應用動物便攜式超聲顯像儀對小鼠頸動脈形成的粥樣斑塊進行測量,并確定動脈血管的狹窄程度,以小鼠頸動脈血管壁內粥樣硬化斑塊占據血管管徑至少35%作為建模成功的標準。選擇正常SPF級小鼠30只作為對照組,正常飲食喂養10周。
1.3 頸動脈損傷及修復處理 兩組均保留3只小鼠作為術前對照,其余小鼠給予吸入性異氟烷進行全身麻醉前的誘導麻醉,待小鼠安靜后,應用1%硫噴托納注射液0.1 mL(0.9%生理鹽水稀釋,維持麻醉時間約20 min)進行腹腔內注射麻醉。麻醉成功后將小鼠置于無菌解剖臺上,固定四肢及頭部,常規消毒小鼠頸部,鋪無菌巾。縱行切開小鼠頸部皮膚及皮下胸腺,裸露頸動脈血管,使用無損傷血管夾夾住動脈血管的兩端,銳性切開部分頸動脈血管壁。在40倍電子顯微鏡下用10-0絲線將損傷血管縫合,確保縫合血管的血流通暢性,然后逐層縫合切口。術后切口處應用碘伏消毒,并涂抹托芬那酸膏和紅霉素軟膏。將小鼠放于溫毯(約42 ℃)上進行麻醉復蘇,術后均正常飲食,其他飼養條件不變。
1.4 頸動脈獲取與處理 觀察組和對照組術后存活數分別為24、26只,不明原因死亡分別為3、1只。術后8 h、48 h、21 d,觀察組分別取7、8、9只,對照組分別取8、9、9只,參照1.3的方法進行麻醉。在小鼠氣管旁鈍性分離粘連組織,找到有縫合線結的頸動脈,在距離線結0.1 cm處上、下各放置血管夾,剪取血管夾之間的頸動脈血管,隨即將標本放入通用標本固定液中保存。兩組術前對照小鼠參照1.3的方法麻醉后取頸動脈標本。將小鼠頸部術口簡單縫合,在麻醉狀態下放入裝有CO2的密閉瓶中處死。標本在固定液中保存6 h后取出,采用梯度乙醇脫水的方法對標本進行脫水處理,二甲苯和氯仿除去標本中的脫水劑。選取軟石蠟對標本進行浸蠟和包埋,病理切片機將石臘塊切成10 μm厚度的單張切片。
1.5 特洛細胞形態及數量觀察 采用雙標記免疫熒光染色法[7]。將兩組頸動脈石蠟切片進行洗滌,置于盛滿EDTA抗原修復緩沖液(pH 9.0)的修復盒中,于微波爐內進行抗原修復。使用組化筆在組織周圍畫圈(防止抗體流走),在圈內滴加自發熒光淬滅劑A液;常溫孵育、滴加自發熒光淬滅劑B液,甩干后在圈內滴加10%正常兔血清均勻覆蓋組織。室溫封閉30 min,加入CD34、CD117、PDGFR一抗進行染色,最后經DAPI復染細胞核(表現為藍色)。封片后熒光顯色顯微鏡下觀察細胞形態并進行拍照。CD34、CD117、PDGFR染色情況:對照組術后8 h標本CD34、CD117、PDGFR抗體熒光顯色分別為紅色、綠色、綠色,術后48 h、21 d均分別為綠色、紅色、綠色;觀察組術后8 h分別為綠色、紅色、綠色,術后48 h分別為紅色、紅色、綠色,術后21 d分別為紅色、綠色、綠色。同時選取面積大小為10 μm2的血管圖像,對CD34陽性染色(CD34+)的特洛細胞進行計數,每個圖像重復兩次,取平均值。

2 結果
2.1 兩組小鼠損傷后不同時間點頸動脈血管中特洛細胞形態變化比較 觀察組和對照組術前綠色熒光的CD34+和PDGFR+特洛細胞均集中位于血管壁的外膜層中。術后8 h,觀察組CD34+特洛細胞(綠色熒光)聚集在血管壁外膜損傷處,對照組血管壁外膜損傷處的CD34+特洛細胞(紅色熒光)數量明顯多于觀察組,CD117+和PDGFR+特洛細胞也有相同表現,但細胞形態改變不明顯。術后48 h,觀察組CD117+特洛細胞(紅色熒光)數量明顯減少,細胞體扁平,由圓形或橢圓形變為細長的梭形,端足細長如絲;對照組CD34+(綠色熒光)和CD117+(紅色熒光)特洛細胞形態較術后8 h無明顯差別,端足形態無明顯改變。術后21 d,觀察組CD117+(綠色熒光)特洛細胞形態恢復至術前和術后8 h的形態,但特洛細胞數量較術后8 h明顯減少;對照組CD34+(綠色熒光)、CD117+(紅色熒光)和PDGFR+(綠色熒光)特洛細胞形態較術前無明顯差別,數量無明顯改變。
2.2 兩組小鼠損傷后不同時間點頸動脈血管中特洛細胞數量比較 隨著時間的推移,兩組術后特洛細胞數量均呈現先升高后降低趨勢。兩組術前特洛細胞數量比較無明顯差異(P>0.05)。觀察組術后8 h特洛細胞數量高于術前,術后48 h和術后21 d特洛細胞數量均低于術前(P均<0.05);對照組術后8、48 h特洛細胞數量均高于術前(P均<0.05),術后21 d與術前比較無明顯差異(P>0.05)。觀察組術后8 h、48 h、21 d特洛細胞數量均低于對照組(P均<0.05)。見表1。
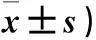
表1 兩組小鼠損傷后不同時間點頸動脈血管中特洛細胞數量比較(個,
3 討論
自特洛細胞被發現至今已有50余年的歷史,目前研究重點多聚焦在這種特殊細胞的形態結構以及組織分布上[8, 9],關于特洛細胞在病理生理學方面的研究較少。雖然近幾年來特洛細胞在皮膚免疫性硬化癥、子宮肌瘤和肺纖維化的病理研究中有些進展,但是并沒有從分子生物學的角度完全解釋特洛細胞在疾病發生、發展過程中的各種改變[10, 11]。特洛細胞存在于動脈血管壁內,在動脈血管壁的外膜層和中膜層形成三維立體框架結構,支撐和維持血管的正常形態功能[12, 13]。目前,國內外關于特洛細胞免疫生物學指標的研究集中在CD34、CD117、PDGFR、VEGFR、CD28、CD31、Vimentin、Nanog和Sca-1等免疫標記抗體上,應用免疫熒光技術將標本中的組織染色后可以將組織中的特洛細胞和成纖維細胞、上皮細胞和巨噬細胞等常見細胞分離開來,再根據標記后細胞表現出的特殊形態結構將特洛細胞區分出來[14, 15]。雖然在不同的組織器官中,特洛細胞陽性表達的免疫生物學指標有所不同,但在小鼠動脈血管壁中特洛細胞陽性表達的免疫指標為CD34、CD117和PDGFR,這也是本研究應用CD34/CD117和CD34/PDGFR雙標記免疫熒光染色法的理論基礎。
動脈粥樣硬化是發生于動脈血管壁的常見病理改變,粥樣硬化斑塊從動脈血管的損傷內膜開始,逐漸不可逆地向動脈外膜層進展。動脈粥樣硬化過程中從內皮細胞開始發生細胞水樣變性、脂肪樣變性及泡沫樣變性等病理學改變,變性的細胞逐漸增多并深達血管壁肌層,導致血管壁正常結構的退變及消失,彈性減弱甚至失去彈性[3,16,17]。在動脈粥樣硬化疾病發生發展過程中,存在著大量正常細胞的變性壞死和炎性細胞浸潤,而特洛細胞作為一種維持正常血管壁形態結構的功能性細胞,在動脈粥樣硬化的病理發展過程中出現了細胞體脂肪樣變性和水樣變性,失去了細胞間廣泛的連接。此時的血管如果受到損傷,在修復過程中受到脂質體侵蝕的細胞會因失去正常功能而影響血管壁修復[6]。
本研究結果顯示,兩組術前頸動脈血管中的特洛細胞數量無統計學差異,說明動脈粥樣硬化并不會影響頸動脈血管中的特洛細胞數量。頸動脈血管損傷后修復過程中,對照組特洛細胞數量在術后8 h明顯升高后又緩慢降低至損傷前水平,而觀察組特洛細胞數量雖然也在術后8 h出現了升高趨勢,但隨著時間推移其數量明顯降低,且觀察組術后8 h、48 h和21 d特洛細胞數量均明顯低于對照組。這說明在動脈粥樣硬化小鼠頸動脈血管損傷修復的過程中,其特洛細胞數量明顯少于正常小鼠。因此,特洛細胞參與了動脈粥樣硬化小鼠的頸動脈血管損傷修復。本研究結果顯示,觀察組血管損傷修復過程中伴隨著特洛細胞和端足形態改變,在損傷修復初期特洛細胞的細胞體由圓形或橢圓形變為細長的梭形,端足變得更加細長或消失,直到損傷修復后期(術后21 d)其細胞形態恢復至術前狀態;但在正常動脈血管中,未發現上述特洛細胞形態的改變。分析原因,這可能與動脈粥樣硬化過程中高血脂對血管壁的影響有關;在脂質體的影響下,特洛細胞的數量可能無法恢復到正常水平,從而延長了血管損傷后修復的時間。
綜上所述,動脈粥樣硬化并不會影響小鼠頸動脈血管中的特洛細胞數量,但動脈粥樣硬化小鼠在頸動脈血管損傷修復過程中存在特洛細胞數量降低及形態異常。本研究僅從宏觀角度闡述了特洛細胞在血管損傷修復過程中的數量變化規律,應用免疫生物學原理觀察特洛細胞在血管修復不同階段的形態改變,但只有應有透射電鏡技術才能觀察到特洛細胞內各種細胞器的種類改變及其在疾病不同階段的超微結構改變[18, 19],這也是本研究的不足之處。在接下來的研究中,我們將從小鼠動脈粥樣硬化血管的活體標本中分離特洛細胞,進行原代細胞培養,以達到從微觀角度分析研究特洛細胞的目的。

