超聲引導下前路和后路穿刺行肩關節囊液壓擴張治療原發性凍結肩的療效對比
劉 堯 朱棟曉 王 米 張學廣 熊苗苗 林麗燕 鄒 軍 方 明
原發性凍結肩(PFS)是肩關節最常見的疾病之一,好發于50歲左右人群,表現為關節疼痛和進行性活動受限[1]。國內外對PFS最佳的治療方式尚未達成共識,近年來的研究已證實關節腔內注射消炎鎮痛復合液能夠有效緩解肩關節囊及周圍組織無菌性炎癥,同時囊內液體壓力可以迅速擴張關節囊,改善肩關節活動功能,現已在臨床廣泛使用[2,3]。肩關節囊穿刺注射主要有前后兩種入路,前路較后路骨性標志更為明確,因而傳統解剖定位穿刺注射法以前路為主,然而不同文獻報道前路穿刺的準確率差異較大[4,5]。近年來,隨著超聲技術的普及,超聲引導后路穿刺因其解剖結構相對簡單、穿刺準確度高以及可動態觀察藥物注入情況等優點得到廣泛應用[6]。目前尚無研究報道超聲引導下經前路和后路穿刺行肩關節囊液壓擴張治療PFS的療效比較,本研究通過比較治療前后NRS、AROM、SRSS以及患者滿意度等綜合評估兩者療效。
對象與方法
1.一般資料:本研究為一項前瞻性、平行對照研究,符合赫爾辛基宣言中醫學研究原則,所有入選對象均簽署知情同意書。以2018年6月~2019年6月于筆者科室門診接受治療的PFS患者為研究對象。利用“肩痛病快速精細化診斷系統”軟件完成患者篩選,最終共納入90例。納入標準:①慢性起病,肩部呈持續性鈍痛,夜間疼痛加重;②患側肩關節主被動前屈、后伸、外展或外旋動作至少兩組活動受限范圍>30°(與健側比較);③患側肩關節超聲或MRI檢查符合PFS圖像表現。排除標準:①肩關節X線、超聲或MRI檢查提示有肩關節骨折、脫位、肩袖撕裂或鈣化性肌腱炎等;②既往有肩關節外傷或手術史;③伴隨頸椎病、冠心病、腫瘤、神經病變等其他疾病引起肩痛者;④入組前1個月內未接受過肩關節注射治療。剔除標準:①入組后未完成治療方案;②中途退出或失訪;③治療期間同時接受其他治療或在治療后隨訪期間接受其他治療者。采用數字表法將患者隨機分為A組(前路組)和P組(后路組),每組均為45例,兩組患者均接受超聲引導下肩關節囊液壓擴張治療(每周1次,連續3次),治療期間及治療后患者根據自身疼痛情況口服塞來昔布膠囊(每日最多400mg)。
2.操作方法:所有患者均由同一名疼痛科主任醫師和超聲科副主任醫師共同完成。(1)A組具體操作:患者取平臥位,患側前臂旋前手掌朝上,將超聲探頭置于肩峰下方、喙突、肱骨頭所形成的三角形中央,可見喙突、肩胛下肌、肱骨頭以及關節盂等結構,采用平面外方式沿肱骨頭由外往內進針。調整穿刺針方向,若注藥通暢則表明已穿刺到關節囊內,靜脈注射消炎鎮痛復合液(0.3ml復方倍他米松注射液、2.5ml 2%鹽酸利多卡因、2ml甲磺酸羅哌卡因,加0.9% NaCl注射液稀釋至20ml),隨后靜脈注射玻璃酸鈉注射液2ml(圖1)。注射完成后囑患者進行肩關節主動內外旋活動,誘發關節腔內液體流動后再次B超確認肩關節后方關節腔內是否有注射液,若有則判定為注射成功。(2)P組具體操作:患者取坐立位,將患側手放掌面放置于對側肩部,超聲探頭平行于肩胛岡放置,顯示岡下肌、肱骨頭和關節盂,采用平面內穿刺技術,經后方入路從后外側向前內側進入肱骨頭與盂唇之間的關節腔間隙。穿刺成功后,同法推注消炎鎮痛復合液20ml和玻璃酸鈉注射液2ml,超聲可見關節囊被藥物撐開(圖2)。

圖1 前路肩關節囊液壓擴張前、后表現A.擴張前;B.擴張后;紅色箭頭所示為喙突,藍色箭頭為擴張后關節囊

圖2 后路穿刺肩關節囊液壓擴張前、后表現A.擴張前;B.擴張后;紅色箭頭所示為穿刺針方向,藍色箭頭所示為擴張后關節囊
治療結束后,囑患者每日行肩關節功能鍛煉,如爬墻法、劃圈法、摸耳法等,療程結束后4、8和12周于筆者科室門診復診評估療效。
3.療效評定標準:疼痛數字評分法(NRS)由0~10間隔相同的11個數字組成,0代表“無痛”,10代表“最劇烈的疼痛”。主動肩關節活動范圍(AROM):患者取站立位,肩胛骨固定,使用電子量角器測量肩關節前屈、后伸、外展以及體側外旋的角度[7]。后伸內旋活動評分標準:根據肩胛下角水平(T7棘突水平)由上往下依次確定T12、L3棘突水平,后伸內旋時手背(五指并攏貼于背部后大拇指水平)可達大腿外側(股骨大轉子水平以下)為0分,臀部(股骨大轉子水平至骶骨角水平)為2分,腰骶部(骶骨角水平至髂嵴最高點水平)為4分,L3棘突水平為6分,T12棘突水平為8分,肩胛下角水平為10分[8]。睡眠質量自評量表(SRSS):共有10個項目,每個項目分1~5分,總分最低分為10分(基本無睡眠問題),最高分為50分(最嚴重)[9]。
由一名對分組情況不知情的醫生評估治療后4、8和12周的NRS、AROM和SRSS;同時記錄治療期間鎮痛藥物使用量和治療后鎮痛藥物使用率以及治療后各時間點患者的恢復滿意度評分(0~10分,0分代表“最不滿意”,10分代表“最滿意”)。
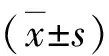
結 果
1.一般情況:A組有2例中途退出,1例在隨訪期間接受了其他治療;P組有1例未完成治療方案,1例失訪,其余85例均完成門診治療方案和全程隨訪。兩組一般資料比較,差異無統計學意義,具有可比性,詳見表1。
2.治療前后NRS:兩組治療前NRS比較,差異無統計學意義(P>0.05);與治療前比較,兩組治療后各觀察點NRS均顯著下降(P<0.05),兩組間比較差異無統計學意義(P>0.05),詳見表2。
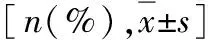
表1 一般資料比較
A組42例中有8例在首次治療后經B超檢查在肩關節后方關節腔內未觀察到注射液,其中有3例訴首次治療后無效,因此療程中改變治療方案,接受了后路穿刺(根據意向性分析原則,這3例仍納入在A組中參與統計分析)

表2 治療前后NRS比較 [M(Q1,Q3),分]
3.治療前后AROM比較:兩組治療前AROM比較,差異無統計學意義(P>0.05);與治療前比較,兩組治療后各觀察點AROM均顯著升高(P<0.05);與A組比較,P組在前屈、后伸、外展的角度以及后伸內旋評分比較,差異均無統計學意義(P>0.05),而體側外旋角度在治療后各時間點均顯著高于A組,差異有統計學意義(P<0.05),詳見表3。

AROM組別治療前治療后4周治療后8周治療后12周前屈(°)A組105.7±19.5133.2±23.8?142.5±20.3?146.3±16.5?P組110.1±20.8136.6±24.2?143.3±19.6? 150.0±15.6?后伸(°)A組20.7±6.440.8±8.7?48.3±7.1?49.2±6.6?P組21.6±7.142.3±9.1?49.6±6.5?50.3±6.3?外展(°)A組110.5±20.7142.3±23.2?151.3±17.2?152.1±13.4?P組109.1±21.3143.2±22.6?150.6±16.4?152.6±12.6?體側外旋(°)A組34.6±12.445.7±10.7?48.8±11.6?54.8±9.6?P組33.0±14.051.5±10.9?#55.1±9.4?#59.2±8.3?#后伸內旋(分)A組20.1±7.640.7±8.3?46.9±6.6?50.8±6.1?P組21.3±6.839.3±7.9?45.2±7.1?51.1±5.8?
4.治療前后SRSS比較:兩組治療前SRSS比較,差異無統計學意義(P>0.05);與治療前比較,兩組治療后各觀察點SRSS均顯著下降(P<0.05),組間比較差異無統計學意義(P>0.05),詳見表4。

組別治療前治療后4周 8周12周A組29.88±2.4514.78±1.21?17.24±1.35?18.13±1.27?P組28.90±2.6213.91±1.33?16.97±1.56?17.75±1.38?
5.鎮痛藥物使用情況比較:治療期間鎮痛藥物使用量A組為247.60±81.11mg/d,P組為250.00±77.92mg/d,差異無統計學意義(P>0.05);治療后各觀察點鎮痛藥物使用率兩組間比較,差異無統計學意義(P>0.05),詳見表5。

表5 治療后鎮痛藥物使用率[n(%)]
6.治療后恢復滿意度比較:兩組治療過程中均未出現嚴重并發癥或不良反應,治療后各觀察點恢復滿意度評分比較,差異無統計學意義(P>0.05),詳見表6。

表6 治療后恢復滿意度評分分)
討 論
研究表明,導致關節囊纖維化和肱骨頭周圍粘連主要原因是關節滑膜炎癥,關節鏡下可見關節滑膜肥大、攣縮,但是具體病因尚未明確[10]。既往觀點認為PFS是一種自限性疾病,疼痛和關節活動度可以逐步恢復,但是持續時間較長,超過半數的患者平均有7年左右的肩關節疼痛和僵硬[11]。長期疼痛和功能障礙嚴重影響患者的日常生活和工作,因此臨床上需要安全有效的治療方法來縮短病程,促進患者康復。
肩關節囊藥物注射是目前臨床上應用最為廣泛的治療手段,消除無菌性炎癥的同時可以通過液體壓力擴張關節囊,達到物理松解的目的,即刻改善肩關節AROM[12,13]。筆者科室在液壓擴張治療時配伍使用低濃度局部麻醉藥,提高了患者對治療的耐受性。本研究中還聯合應用了玻璃酸鈉注射液,以減少軟組織及軟骨間的摩擦,同時抑制痛覺感受器的興奮性,增強止痛效果。目前常用的肩關節囊穿刺有前、后兩種入路,前路較后路骨性標志更為明確,既往尸體標本研究報道前后入路準確率分別為80%和50%,因此多數研究者更推薦前路解剖定位穿刺注射法[14]。Johnson等[15]研究指出,在肩鎖關節、小結節、喙突所形成的三角形中央區呈45°斜向下穿刺,經關節鏡確認準確率可達91%,而Sethi等[16]采用關節腔造影MRI檢查發現前路穿刺成功率只有26.8%。本研究中42例患者首次治療時接受前路穿刺,有8例經B超確認肩關節腔后方未觀察到注射液,成功率為81%。考慮可能是由于在前路穿刺注藥過程中部分藥液滲漏至肩袖間隙而未被發現,導致后方關節囊內藥液容量較少。近年來,超聲引導技術使得后路穿刺準確率大大提高,筆者認為后路穿刺的優勢在于靜脈注射藥物時能夠動態觀察到藥液擴張關節囊的過程,同時可以通過調整針尖位置以避免藥液滲漏到關節囊外,本研究中后路穿刺注射的成功率為100%。
本研究發現,兩組穿刺路徑的總體療效和患者恢復滿意度比較,差異無統計學意義,操作過程中兩組均未出現嚴重并發癥。在AROM改善方面,前屈、后伸、外展角度和后伸內旋評分在治療后各時間點比較,差異無統計學意義,而經后路穿刺注射組患者體側外旋的角度在治療后12周內仍顯著高于前路穿刺組,分析原因可能是前路穿刺時為尋求藥物注入的暢通感,調整針尖位置時多次穿刺肩胛下肌和盂肱韌帶所致。同時,由于喙突的遮擋,超聲圖像難以觀察到關節盂,穿刺過深則可能損傷盂唇;而后路操作時超聲引導穿刺針從岡下肌和小圓肌之間穿過,完全可以避免損傷關節盂,較前入路造成的損傷更小。
此外,為確保藥液精準進入關節腔內,降低因藥液作用差異所造成的結果偏倚,本研究中所有操作均由擅長肌骨超聲的超聲科醫生和具有穿刺經驗的疼痛科醫生共同完成。本研究也存在一定的局限性,首先,未能夠對兩種入路所用的時間和單次穿刺成功率進行比較;其次,本研究只追蹤隨訪了治療后12周內療效情況,對于長期療效是否有差異尚不能做出明確結論。另一方面,本研究中的穿刺操作是由兩位經驗豐富的高年資醫生完成,在臨床應用推廣時,超聲引導下穿刺技術的掌握程度可能對治療效果產生較大影響。
綜上所述,超聲引導下經前路和后路穿刺注射治療PFS均可取得滿意的短中期療效,同時經后路穿刺注射成功率更高,且改善體側外旋角度的短期效果更佳,因此在具有超聲應用條件的基礎上更加推薦選擇后路穿刺法。

