行氣活血祛濕方對非酒精性脂肪性肝炎小鼠模型的影響*
鄭佳連 盧秉久
遼寧中醫大學附屬醫院感染科 (沈陽 遼寧, 110032)
非酒精性脂肪性肝病(NAFLD)是多種原因導致的以甘油三酯為主要成分的脂質在肝細胞內過量沉積為主要表現的代謝性肝病,根據病理表現分為單純性脂肪性肝病(NAFL)、非酒精性脂肪性肝炎(NASH)、肝硬化、原發性肝癌(HCC)[1-3]。其中NASH為NAFLD的關鍵病理階段,如果不予以治療,NASH有可能進展為肝硬化甚至是原發性肝癌,故NASH階段的治療尤顯重要[4]。王文彥教授為全國首批500位名老中醫,擅長運用行氣活血祛濕法治療NAFLD,臨床效果甚佳。本實驗旨在研究行氣活血祛濕方對NASH小鼠模型的療效并探討其可能的機制。
1 材料與方法
1.1 實驗動物 50只7周齡健康雄性C57Bl/6J小鼠,購自遼寧長生生物技術有限公司,飼養于遼寧中醫藥大學實驗動物中心。
1.2 實驗藥品及藥品制備 行氣活血祛濕法方:山楂、荷葉各10 g,紅曲6 g,車前子20 g,大腹皮15 g,所有中藥購自遼寧中醫藥大學附屬醫院中藥局。制備方法:將各種藥物混合浸泡1 h,第1次加入8倍量水煎煮1 h,第2次加入6倍量水煎煮1 h,合并2次煎煮液,制成濃度為含生藥1.5 g/ml和0.3 g/ml兩個濃度,于4 ℃冰箱保存備用。水飛薊賓膠囊(水林佳,天津天士力制藥股份有限公司,批號:550707002)。
1.3 主要試劑 試劑盒:ALT、AST、TG、TC比色法試劑盒購自南京建成生物工程研究所;Trizol購自Invitrogen公司;cDNA第一鏈合成試劑盒、逆轉錄試劑盒、DNA marker購自北京全式金生物技術有限公司。
1.4 實驗方法
1.4.1 模型建立 所有小鼠適應性飼養1周后,隨機分為5組:對照組、模型組、中藥低劑量組、中藥高劑量組以及水林佳組,每組10只。對照組小鼠給予膽堿充足高脂飼料(CSHF diet)喂養;其余4組給予膽堿缺乏高脂飼料(CDHF diet)喂養建立NASH模型[5],共8周。CSHF飼料以及CDHF飼料均購自江蘇美迪森公司,成分及熱量見表1。

表1 不同飼料成分及熱量情況
1.4.2 給藥方法 建立模型同時給予藥物干預,共8周。給藥劑量按實驗動物與60 kg成人體表面積比等劑量核算,以該1倍劑量(12.3 mg生藥/g體質量)作為低劑量,5倍(61.5 mg生藥/g體質量)作為高劑量,進行灌胃給藥;水林佳組給予水林佳含量按照0.065 mg/g體質量灌胃給藥;對照組及模型組均給予等量生理鹽水灌胃。
1.4.3 標本收集與方法 實驗8周末全部小鼠稱重后麻醉取材,取材前,禁食、禁水12 h,麻醉采用腹腔注射1%苯巴比妥。麻醉后打開腹腔,暴露腹主動脈,無菌注射器抽取腹主動脈血約1 ml,3 000 r/min離心30 min后分離血清,保存待檢。迅速分離肝臟,稱肝臟濕重,觀察大致形態及表面光澤,肝右葉邊緣1 cm處取小塊肝組織,一部分浸入4%甲醛溶液中,固定以備HE和Sirius red染色;另一部分組織迅速放入-80℃冰箱待檢測。
1.5 觀察指標及方法
1.5.1 一般情況 包括小鼠狀態、毛發光澤及死亡情況。
1.5.2 體質量及肝臟濕質量 造模結束后,稱量小鼠體質量,麻醉取肝臟,稱量肝臟質量,計算肝臟質量/體質量。
1.5.3 血清學指標檢測 檢測血清ALT、AST、TG、TC,按照試劑盒說明書步驟操作,采用手工比色法檢測。
1.5.4 肝臟病理學檢查 肝組織病理切片按脫水、浸蠟、包埋、切片、染色、封片等步驟制備,進行HE以及Sirius red染色,最后光鏡下觀察。
1.5.5 肝組織中TNF-α、α-SMA、IL-6、TGF-βImRNA以及蛋白表達水平 采用RT-PCR法檢測肝組織中TNF-α、α-SMA、IL-6、TGF-β1表達水平,引物序列見表2;Western Blot方法檢測肝組織中(STING)、TANK結合激酶(TBK1)、干擾素調節因子3(IRF3)的表達水平。

表2 各檢測指標的引物序列
2 結果
2.1 一般情況 模型組小鼠易激惹,皮毛油膩;對照組小鼠無明顯異常;與模型組相比,各干預組小鼠一般情況不同程度改善。實驗過程無實驗動物死亡。
2.2 各組小鼠體質量及肝臟濕質量的變化 見表3。與對照組相比,模型組小鼠肝臟濕質量顯著升高(P<0.01);與模型組相比,中藥高劑量組小鼠肝臟濕質量顯著下降(P<0.05)。

表3 各組小鼠體質量、肝臟濕重情況比較
2.3 各組小鼠肝功能、血脂的變化 見表4。

表4 各組小鼠肝功能、血脂比較
2.4 各組小鼠肝組織病理的變化 對照組小鼠肝組織HE染色高倍鏡下可見肝板結構正常,肝細胞排列規整,中央靜脈大小正常,核膜完整,核仁清晰可見;模型組小鼠肝組織可見肝細胞脂肪變,胞漿內可見彌漫分布的脂肪空泡,并可見大量的炎性細胞浸潤,證實NASH模型成立;各干預組小鼠可見肝組織形態、結構有不同程度改善,其中中藥高劑量組改善最為明顯,脂肪空泡明顯減少,肝細胞大小接近正常,形態、結構較清晰,可見非常少量的炎性細胞;低劑量組以及水林佳組仍可見到脂肪空泡,肝細胞排列欠規則,仍有炎性細胞浸潤(見插頁彩圖1A)。Sirius red染色中可見模型組肝組織中央靜脈附近有大量纖維化沉積;各干預組肝組織纖維組織沉積有不同程度改善,其中高劑量組改善最為明顯(見插頁彩圖1B)。
2.5 各組小鼠肝組織炎癥、纖維化相關因子mRNA表達的變化 與對照組相比,模型組小鼠肝臟TGF-β,TNF-α以及α-SMA mRNA表達明顯升高;與模型組相比,各干預組小鼠TGF-β,TNF-α以及α-SMA的mRNA表達有不同程度下調,其中高劑量組改善最為顯著(P<0.01),見圖2-4。與對照組相比,模型組小鼠肝臟IL-6 mRNA表達明顯上升,與模型組相比,各干預組小鼠IL-6的mRNA表達不同程度下調,其中高劑量組改善最為顯著(P<0.01),見圖5。

圖2 TGF-β mRNA表達

圖3 TNF-α mRNA表達

圖4 αSMA mRNA表達

圖5 IL-6 mRNA表達與對照組比較,*P<0.01;與模型組比較,# P<0.05,##P<0.01
2.6 各組小鼠肝組織STING-IRF3信號轉導通路的變化 STING-IRF3信號轉導通路由STING、TBK1、IRF3組成。與對照組相比,模型組小鼠肝組織中STING、TBK1、IRF3蛋白表達明顯上調(P<0.01);各干預組小鼠肝組織STING、TBK1、IRF3蛋白表達均有不同程度下調(P<0.01,P<0.05),其中中藥高劑量組改善最為顯著(P<0.01)。見表5、圖6。
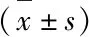
表5 各組小鼠肝臟組織STING-IRF3蛋白表達水平比較

1.對照組 2.模型組 3.中藥低劑量組 4.中藥高劑量組 5.水林佳組圖6 各組小鼠肝臟組織STING、TBK1、IRF3蛋白表達電泳圖
3 討論
王文彥老中醫認為NAFLD早期的病機為氣滯濕阻,中、晚期病機為氣滯濕阻血瘀,故立行氣活血祛濕法為核心大法。在臨床中證實行氣活血祛濕方治療NASH取得了很好的療效,方中山楂、紅曲二者色赤入血,化血中之瘀。現代飲食不節已經成為脂肪肝的最主要病因,多食精谷細糧、魚膾酒肉,加之多坐少動,精微物質攝入過多卻無以消耗,在體內化濕生痰。如若脾胃強健,則水谷即食即化氣血,無以化為痰濕,山楂、紅曲二味妙用即在此:除活血功用外,同時均具有消食化積之功效,山楂善消肉食,紅曲善消米面,間接起到祛濕化痰的目的。荷葉質輕主升,消暑利濕;車前子主降,祛濕利水。大腹皮行氣理氣兼祛濕利水。五藥合用共奏行氣活血祛濕之功效。先期研究過程中,我們利用純化高脂飼料建立小鼠NASH模型,行氣活血祛濕方能夠降低模型小鼠肝臟中炎癥反應并改善NASH病理。[6-8]
膽堿作為一類重要維生素,參與了細胞膜以及脂蛋白構成過程。缺乏膽堿會導致肝臟向外周運輸甘油三酯障礙,即模擬了非酒精性脂肪性肝病的病理過程[9,10]。先前大量研究已成功利用CDHF飼料建立NASH模型。本次實驗同樣采用該方法建立小鼠NASH模型。實驗結果與之前研究結果相同,CDHF飼料飼養8周即可建立NASH模型,且具有死亡率低的優點,值得推廣。
STING是一種內質網膜蛋白[11],先期大量關于STING的研究均與病原體感染相關[12],當機體被病原體感染后,病原體的DNA進入到宿主細胞的胞漿中。胞漿中的傳感器(cGAS酶),分解DNA合成環狀二核苷酸(cGAMP)并激活內質網膜上的STING,激活后的STING移動到細胞核周圍并招募細胞質中的TBK1及其下游因子IRF3,引起IRF3磷酸化[13,14]。進入細胞核的IRF3與目的基因啟動子結合,促進NF-κb、TNF-a、IL-6等炎癥因子的表達,引起肝臟炎癥反應[15]。2013年,Petrasek等[16]報道稱,STING-IRF3通過將內質網應激與肝細胞凋亡信號聯系起來介導酒精性脂肪肝的發生。NAFLD與酒精性脂肪性肝病的病理學過程存在相似之處,然而其在NAFLD發生發展過程中的作用研究較少。國內的研究表明[17,18],高脂飲食及游離脂肪酸能夠激活肝細胞中STING-IRF3信號通路,導致肝細胞炎癥及凋亡,同時該通路還直接或間接地影響肝細胞的糖脂代謝。該通路表達缺陷能夠改善高脂飲食引起的脂肪組織炎癥、代謝紊亂及胰島素抵抗,這表明STING-IRF3信號通路通過誘導炎癥、凋亡及促進糖脂代謝紊亂導致肝細胞損傷。先前的研究表明行氣活血祛濕方可通過抑制肝臟炎癥反應改善NASH,STING-IRF3信號轉導通路為眾多炎癥因子的上游調控通路,我們猜測行氣活血祛濕方的炎癥抑制作用是通過調控STING-IRF3信號轉導通路實現的,故進行本次研究予以證實。
實驗結果表明,各干預組小鼠肝功能以及病理、血脂、炎癥因子以及纖維化相關因子的mRNA表達、STING-IRF3信號轉導通路蛋白均得到改善,其中中藥高劑量組效果最為顯著。印證了之前研究的結論:NASH情況下,STING-IRF3信號轉導通路被激活,并導致下游TNF-α、IL-6等炎癥因子的激活進一步加重肝臟炎癥反應。
NASH在肝臟病理上的表現以炎癥和纖維化為顯著特點。前期的研究表明行氣活血祛濕方可以抑制炎癥因子的表達,本次的研究結果表明該方對IL-6、TNF-α等炎癥因子上游STING-IRF3通路同樣有調控作用。除此以外,本次研究觀察該方對纖維化相關因子TGF-β、TNF-α以及α-SMA表達的影響,并通過Sirius red染色證實對NASH肝組織中纖維化沉積的影響。結果表明該方可抑制TGF-β、TNF-α以及α-SMA的表達,并減少NASH肝臟中纖維化沉積。以中藥高劑量組療效改善最為明顯。

