谷胱甘肽和二氧化錳的氧化還原反應在生物領域上的應用
王海梅 田啟威 楊仕平
摘要:谷胱甘肽(CSH)是一種普遍存在的生物硫醇,具有清除毒素、維持氧化還原穩態和調控基因的作用,GSH的異常水平可能是多種疾病的觸發因素.過渡金屬氧化物二氧化錳(Mn0,)具有很強的氧化能力,能被GSH還原為Mn2+,可用于磁共振成像( MRI)以及腫瘤治療.GSH和Mn0,之間的氧化還原反應已成為科研工作者不斷研究和探索的方向.綜述了GSH和Mn02的氧化還原反應的最新研究進展.
關鍵詞:谷胱甘肽(GSH);二氧化錳(Mn02);氧化還原反應;腫瘤診斷;腫瘤治療
中圖分類號:0 614.33
文獻標志碼:A
文章編號:1000-5137(2020)02-0203-16
0引 言
L-y一谷氨酰基-1-半胱氨酰基一甘氨酸(谷胱甘肽,GSH)是生物系統中最廣泛的非蛋白質硫醇物種[1-3].它是一種重要的內源性抗氧化劑,在防御毒素、維持生物體內氧化還原穩態中起著至關重要的作用[4].通常情況下GSH以還原形式存在,被氧化后可轉化為谷胱甘肽二硫物(GSSG),即GSH的氧化形式.GSH或CSSC水平的異常與許多臨床疾病相關,如阿爾茨海默癥、帕金森、肝損傷、糖尿病、癲癇、動脈粥樣硬化、關節炎、衰老和多種類型的癌癥[3,5-6].因此,GSH的測定和定量檢測具有良好的生物學和臨床意義,這已成為重要的研究課題,并受到研究者們的高度關注.
二氧化錳(Mn0,)是一種重要的過渡金屬氧化物,具有很強的氧化能力,可以通過某些分子還原成Mn2+,包括GSH、二硫蘇糖醇(DTT)和抗壞血酸(AA)[7].由于錳元素是人體必需微量元素之一[8],因此基于Mn“的納米粒子(NPs)和Mn02納米材料,在檢測細胞內GSH濃度和藥物傳遞中得到廣泛應用,
本文作者主要綜述了GSH和Mn02的氧化還原反應在生物領域上的應用,包括GSH的檢測、腫瘤的診斷和治療.
1 MnO2與GSH的反應機理
細胞中大多數GSH(1~10 mmol·L-l)通常存在于細胞質中,細胞質也是GSH合成的主要位置.細胞核中的GSH維持著DNA修復和表達所需的關鍵巰基蛋白的穩定[9].GSH的氧化和還原形式影響著機體的平衡狀態[10].因此,許多研究人員通過測定GSH/GSSG的比例來估計系統的氧化還原穩態,進而評估機體的健康狀況.
MnO2中的Mn原子以八面體幾何形狀配位到6個氧原子中[11],并且與水環境隔離,抑制了與質子的交換,因此是低的橫向( T1)和縱向(T2)加權磁共振造影劑,同時Mn02具有很強的氧化能力,能被GSH還原成Mn2+.Mri2+是順磁性的,通過縮短水自旋一品格弛豫時間常數,充當優異的磁共振成像( MRI)造影劑.MnO2造影劑的存在改變了氫質子的弛豫時間,提高MRI的敏感性和分辨率.在機體中,GSH和MnO2之間的氧化還原反應如下[12-14]:
Mn02+2GSH+2H+—+ Mn2++GSSC+2H2O.
2 MnO2的結構與特點
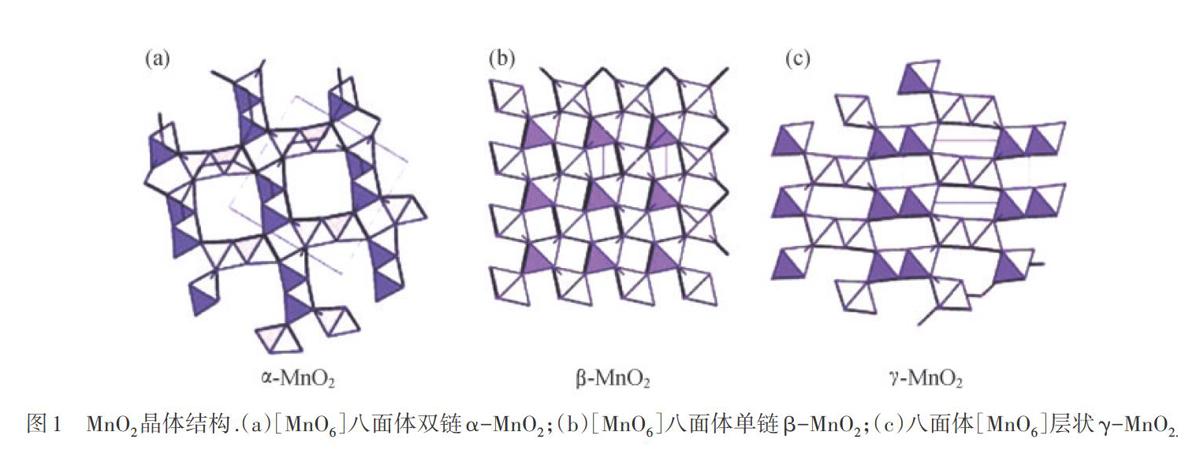
MnO2是一種重要的過渡金屬氧化物,MnO2具有多種不同的晶型,結構復雜.MnO2是由[Mn06]八面體構成的,該結構單元按照不同的連接方式可以形成不同的晶體結構[15].在基礎結構[Mn06]八面體中,6個氧原子分別處于八面體的頂點上,Mn原子居于八面體的中心.由于Mn02的[Mn06]八面體的棱的連接方式不同,可形成單鏈、雙鏈和多鏈結構,鏈之間再由八面體的共頂角相連接,因此可以形成平行于C軸方向上的、由[MnO6]八面體品格包圍而成的一種無限長的一維孔洞材料.這種一維孔洞結構被稱為隧道結構,隧道的不同形狀代表了不同的Mn02晶體,包括a-,β-和y-晶型,3種Mn02晶體結構如圖1所示.
為了更直觀地表示這種一維隧道結構,根據隧道形狀的不同給材料命名為T[mxn,],其中T表示材料為隧道結構,m和n則表示隧道橫截面的長和寬,即[Mn06]八面體的棱長的倍數.下面簡單介紹一些主要MnO2晶型,
2.1 a-MnO2
Mn02結構具有一維T[2x2]隧道,這種隧道通過共用MnO2八面體[MnO6]的角和邊形成八面體雙鏈,這種隧道結構的橫截面積較大,能夠容納較大的陽離子,如Ba2+,K+,Pb2+,Na+和NH4+等陽離子,容納的陽離子可以增強其隧道的穩定性.根據摻入隧道中的陽離子的不同,可以形成不同成分的a相的MnO2,如硬錳礦、軟錳礦、鉛硬錳礦等不同礦種[16].此外,這種中央隧道中的陽離子很容易被其他陽離子所取代.因此,a-MnO2材料具有豐富的化學性質.
2.2 p-MnO2
3-MnO2結構具有一維T[lxl]隧道,該隧道通過共用[MnO6]八面體棱形成八面體單鏈,所有八面體都是等同的,平均每個Mn-0原子間距為0.186 nm,具有四方晶系的金紅石結構.
2.3丫-Mn02
在MnO2的隧道結構中,當一維隧道結構趨向無窮大時,即形成二維層狀結構.通過八面體[Mn0。]以共用棱的方式連接形成層片,層與層之間由一些陽離子支撐.根據層間距的不同,會形成多種不同結構,如層間距為0.7 nm的層狀MnO2被稱為水鈉錳礦,層間距為1.0 nm的層狀MnO2被稱為布塞爾礦.這種層狀結構的納米材料一般有金屬離子填充,易形成離子通道.
3 Mn02的制備方法
Mn02具有豐富的晶型,不同的方法可合成出不同形貌的納米材料,如納米片、納米管、納米針、納米帶等不同形狀.Mn0,的主要制備方法有水熱法、溶膠凝膠法、熔鹽法、共沉淀法和電沉積法.3.1水熱法
MA等[17]采用典型的水熱法制備Mn02納米帶,通過將Mn202粉末分散于NaOH水溶液中,然后將溶液密封并在170℃下加熱12 h至1周.通過這種制備方法可以自組裝成束,得到較窄尺寸的分散體.低溫控制水熱法可以避免高溫條件下的劣勢,WANG等[18]通過低溫水熱法將S2022-氧化Mn“的反應來制備Mn02納米結構,此方法沒有采用催化劑或者模板,操作簡單、產物易得,為了制得粒徑可控的Mn02納米材料,ZHENG等[19]通過簡單的水熱法,在聚乙烯基吡咯烷酮(PVP)的存在下,用NaCl03氧化MnSO4,成功制備了直徑在200~500 nm范圍內,粒徑可控的Mn02納米材料.此外,通過調整材料比例也可制備長度達到幾微米的單晶Mn02納米管.該實驗制備方法也為其他一維單晶納米管材料提供了一種新的通用途徑.
3.2 凝膠溶膠法
使用水熱和氧化還原反應方法可制備的產物數量是有限的.制備納米級和金屬取代的Mn02八面體分子篩(OMS)材料需要更快、更便宜的合成路線.LIU等[20]報告了一種新型的溶膠一凝膠輔助固態方法,以合成納米棒、納米針和納米線等不同形狀的Mn02納米材料.在合成中,利用硝酸鹽陰離子的氧化性將Mn(ll)氧化為更高的氧化態(III或IV),同時使用交聯劑,如聚乙烯醇(PVA)、甘油或葡萄糖,來控制納米材料的尺寸.該合成途徑不僅縮短了制備時間,而且簡化了制備過程.產物的量僅受反應容器大小的限制,這使得該方法非常適合規模化生產.
3.3熔鹽法
SUI等[21]“通過使用無水硫酸錳(MnSO4)作為試劑,使用硝酸鹽(KNO3,NaNO3和LiNO3)作為反應介質,用熔鹽法合成了Mn02納米線和納米棒.該方法制備的Mn02納米結構在芬頓或類芬頓反應中表現出優異的催化性能.此外操作簡單、反應時間短、產率高,該合成方法可以用于實際應用中.
3.4共沉淀法
PORTEHAULT等i22i使用沉淀法,在氮氣(N2)下將KMnO4溶液加入到劇烈攪拌的硫酸錳中,來合成Mn02的水溶液.溫度控制在60~95℃之間,可制備Mn02納米線.該方法通過調節酸度和溫度來控制納米線的縱向(粒徑)和橫向(長度)生長,使其分別控制在15~40 nm和100~800 nm范圍內,該研究提供了Mn02合成反應的新見解,并突出了一維氧化物納米結構形成和尺寸調整的新方案.
3.5電沉積法
電沉積法是通過調節電流密度和電壓大小來調節MnO2在金屬或非金屬邊緣上的選擇性電沉積,通過調節含有Mn04水溶液的電流密度和電壓大小,LI等[23]制備出直徑在40~150 nm粒徑可控的Mn02納米線.隨著Mn02納米線的增長,MnO2電沉積反應的速率也隨時間而降低,這可能是由于半圓柱形納米線的半徑增加,導致了通過半圓柱形納米線的歐姆電阻增加.
4該反應用于GSH的檢測
GSH是生物系統中最豐富的內源性硫醇和重要的內源性抗氧化劑.GSH通過二硫化物GSSG和還原物GSH之間的平衡來控制機體的氧化還原穩態.因此,開發一種簡單、有效且靈敏的方法來檢測和監測生物系統中GSH的水平是至關重要.如今,已開發了一系列用于GSH測定的方法,例如電化學i24-251、毛細管電泳[26]、高效液相色譜(HPLC)[27]、MRI[28]、比色法和熒光光譜[29].在這些方法中,熒光光譜法具有明顯的優勢,在生物系統檢測中,具有靈敏度高、操作簡便、實時分析且無損傷的特點。所以,研究者們致力于設計熒光探針用于檢測GSH,例如,熒光探針在有機熒光團、上轉換納米粒子(UCNPs)、半導體量子點、貴金屬納米簇、聚多巴胺納米顆粒和碳納米材料上的應用.
4.1 負載碳納米材料發光物質
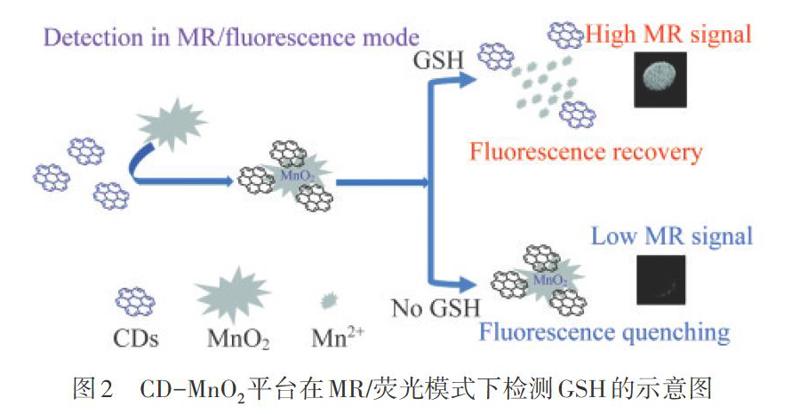
Mn02負載不同碳納米材料的熒光物質用于GSH的檢測,包括碳點(CD)、氧化石墨烯(GO)、石墨烯量子點( GQD)和氮化碳(C3N4).CAI等[3叫通過在CD膠體溶液中原位合成Mn02納米片(Mn02NSs),制備了Mn02NSs負載碳點納米復合材料(CD-Mn02),用于快速和選擇性檢測GSH. 一旦形成CD-Mn02納米復合材料,CD的熒光就可以徹底淬滅.在GSH存在下,Mn02NSs將被還原為Mn2+,釋放出CD,隨后恢復熒光.在水溶液最佳條件下,GSH的檢測限可達300 nmol·L-1.XU等[31]在CD-Mn02系統中增加了磁共振(MR)模式下的檢測方式,如圖2所示,在熒光模式下,平臺的熒光和MR信號顯示出檢測限為0.6 umol·L-1;而在MR模式下,檢測到GSH的物質的量濃度為2.8 umol·L-1.
新制備的Mn0,NSs由于其表面存在Mn空位而帶負電荷,并且在靜電相互作用下容易吸附摻雜有N元素的帶正電的CQD.HE等[32]開發了一種基于Mn0,負載石墨烯量子點(GQD-Mn02)納米傳感器,用于選擇性檢測活細胞中的GSH.GQD的熒光強度可以通過熒光共振能量轉移(FRET)被Mn02NSs淬滅,然而,GSH可以將Mn0,NSs還原成Mn2+,并釋放GQD,從而導致熒光信號恢復.Mn02NSs在傳感平臺中用作熒光納米淬滅劑和GSH識別器,檢測限為150 nmol·L-l.
WANG等[33]構建了基于能量共振轉移(RET)的傳感平臺,其使用CD和Mn02NSs作為能量供體一受體對,制備的探針進一步證明了可用于檢測哺乳動物中最豐富的GSH.為了提高供體一受體能量轉移效率,FU等[34]使用g-C3N4納米片(g-C3N4NSs)作為能量供體,Mn02NSs作為能量受體,研發了一種新穎且高效的2D/2D異質結構g-C3N4/MnO2的電化學發光一共振能量轉移(ECL-RET),如圖3所示.由于MnO2NSs在g-C3N4NSs上原位生長,形成2D/2D異質結構,大大縮短了供體一受體對(g-C3N4/MnO2)的距離,從而大大提高了RET效率,該系統在不存在GSH的情況下,ECL-RET在2D/2D( g-C3N4/MnO2)異質結構(ECL信號“關閉”)中,Mn02顯著地淬滅了g-C3N4的ECL強度;加入GSH后,GSH將Mn02還原為Mn“,從異質結構的g-C3N4/Mn02中釋放出g-C3N4,產生了ECL強度的恢復(ECL信號“開啟”).該方法設計的ECL-RET信號off-on傳感器實現了GSH的靈敏檢測,其檢測范圍為0.20~100.00 umol·L-1,在最佳條件下,檢出限為o.os umol·L-1.
4.2 負載金屬納米簇
g-C3N4/Mri02納米復合材料傳感器對GSH表現出良好的檢測效果,然而,g-C3N4/Mn02納米復合材料的合成條件苛刻,例如高溫(550℃)和強酸處理.因此,仍非常需要尋求簡單、易操作、環保和低成本的測定GSH的熒光納米材料.先前報道表明牛血清白蛋白(BSA)可以作為模板形成具有高度抗氧化性的熒光銅納米簇(Cu NCs),所獲得的Cu NCs在膠態分散體中具有光致發光和高度穩定的特性[35].基于以上基礎,WANG等[36]通過使用BSA作為模板,一步化學還原方法合成了高熒光Cu NCs.Mn02NSs有效地淬滅Cu NCs的熒光.然而,加入GSH后,Mn02可以還原成Mn2+,從而抑制Mn02NSs誘導熒光淬滅效應.開發的傳感器對GSH進行靈敏度和選擇性檢測,在最佳條件下,線性范圍為0~300 mmoI·L-l,檢測限為100 nmol·L-1.
過渡金屬配合物具有廣闊的應用前景,其具有生物靶標傳感和細胞成像的優勢,以及磷光壽命長、合成簡單、可調光物理性質和較大的斯托克斯位移等特點.基于此,DONG等[7]探究了Mn02NSs對銥(Ir,III)配合物的淬滅能力,用于GSH的檢測,如圖4所示.設計的檢測平臺對GSH表現出高度的敏感性和特異性,并且成功地用于活斑馬魚的GSH分布成像檢測,與以前報道的GSH檢測方法相比,該平臺易于操作,并為生物分析領域的其他生物分子靶標提供了新的檢測策略.
4.3負載二氧化硅(Si02)納米物質
由于Si0,中的氧原子可以通過分子間氫鍵或配位鍵與金屬Mn結合[37],基于此,SUN等[38]通過在量子點@二氧化硅(QD@Si02)上原位生長Mn02NSs進行GSH檢測和實時活細胞成像.由于FRET,Mn02NSs的生長有效地淬滅了QD@Si02的熒光發射.GSH還原Mn02分解成Mn2+,QD@Si02的發光在幾分鐘內大大恢復,納米探針對GSH的測定顯示出良好的靈敏度和選擇性,并成功應用于GSH的細胞監測和實時成像.
為了擴大GSH和Mn0,氧化還原反應的應用,MENG等[39]以雙光子(TP)介孔二氧化硅(MS)為熒光納米探針,通過靜電作用在熒光納米探針表面吸附Mn02NSs,用于水溶液和生命系統中GSH熒光成像檢測,同時該納米探針成功應用于TP熒光成像,可監測活細胞和組織細胞中GSH的變化.后將其應用于活細胞和肝組織中GSH的TP激發熒光成像,實驗結果令人滿意.
4.4負載聚合物納米發光物質
多巴胺( PDA)是調節大腦各種生物學功能的重要中樞神經系統的兒茶酚胺神經遞質.PDA的兒茶酚在氧化應激或堿性條件下易氧化成醌衍生物,并能自聚合成聚PDA納米粒子(PDA NPs).而Mn02的存在,PDA也能迅速被氧化成其醌衍生物,并自動聚合成熒光PDA NPs.但GSH存在時,Mn02被還原成Mr12+,這將抑制熒光PDA NPs的形成.因此,使用熒光PDA NPs作為熒光信號指示劑,根據熒光PDA的信號強度,可以容易地檢測出GSH的濃度.該傳感器對GSH分析顯示出良好的感測性能,在0—350 umoI·L-1的范圍內具有很寬的線性響應,而檢測限低至1.5 umol·L-1.該方法具有理想的選擇性,對GSH的影響超過其他潛在的干擾物種.
聚合物點(PDs)作為CD系列中的新興物質,具有更好的光穩定性、生物相容性、優異的光物理性質和較低的成本等特點[40].PDs在紫外線激發下通常會發出強烈的藍色熒光,然而,生物基質中常見的自發熒光和紫外線激發光對生物組織潛在的光損傷會嚴重干擾藍色熒光,限制了其在生物系統中的進一步應用.
為了克服這一問題,HAN等[41]通過使用對苯二酚和乙二胺作為前體進行自氧化和自聚合反應,可以合成具有強烈綠色熒光的PDs.將制備好的PDs用作熒光指示劑,將Mn02NSs用作GSH識別單元和熒光淬滅劑,以構建用于分析GSH的聚合物點和二氧化錳(PDs-Mn02)的納米傳感器,該納米傳感器已成功應用于人血清中GSH的檢測.
4.5 負載有機熒光染料
有些有機熒光團能表現出異常的發射行為,它們在分子溶解狀態下不發光或發較弱的熒光,但當它們處于聚集狀態時會變成高熒光發射體,這種不尋常的熒光現象被稱為聚集誘導發射( AIE).ZHANG等[11]首次報道了無標記的Mn02NSs輔助AIE-二氧化硅納米粒子(AIE-Si02NPs)探針,用于高靈敏的GSH熒光“開啟”檢測,如圖5所示.合成的陰離子四苯乙烯衍生物3(TPE3),用作AIE活性探針,可以在未涂覆的氨基官能化的Si02NPs上聚集形成AIF-Si02NPs并發出強熒光.帶負電的Mn02NSs被用作氨基官能化的Si02NPs的正電荷保護劑和GSH的識別單元.GSH的存在可以選擇性地將Mn02NSs還原成Mn2+,從而釋放出氨基官能化的Si02NPs,并暴露其正電荷.因此,TPE3可以在暴露的氨基官能化的Si02NPs上聚集以形成AIE-Si02NPs,并發出強熒光.所提出的測定法簡單、快速、成本低,且高度靈敏,GSH的檢測限為200 nmol·L-l.
YAO等[14]使用2-(N-嗎啉代)乙磺酸(MES)還原KMn04制備Mn0:NSs.在Mn02NSs的存在下,鄰苯二胺(ODPA)可以被氧化為2,3-二氨基吩嗪(OPDAox),能輸出熒光信號.然而,GSH可以將Mn02NSs還原為Mri2+,并顯著抑制OPDAox的形成,從而降低熒光信號,用于靈敏地檢測GSH.重要的是,相對于其他不同的電解質和生物分子,該方法顯示出對GSH的選擇性反應,可進一步用于檢測實際生物樣品(例如細胞提取物)中的GSH.
4.6 負載UCNPs
與常規的有機熒光材料相比,UCNPs具有獨特的化學和發光特性,主要表現在:1)它們具有高光穩定性和熱穩定性;2)與紫外線(UV)激發源相比,近紅外(NIR)激發源(通常為980 nm)具有更高的組織穿透深度,并且對生物樣品的損害較小;3)NIR激發技術具有非褪色和非自發熒光測定,從而提高了信噪比.這些優勢使UCNPs對生物標記和生物傳感特別有吸引力.基于此,DENG等[1]使用鑭系元素摻雜的UCNPs的NIR輻射轉換成可見光,為檢測GSH提供了另一種方法,如圖6所示,在這種方法中,將UCNPs表面上形成的Mn02NSs用作上轉換發光的有效淬滅劑.通過GSH和Mn02高靈敏的氧化還原反應和UCNPs的非自發熒光測定,證明了對活細胞中GSH水平的監測.這一發現對藥物靶向和基因傳遞提供了有效策略.
4.7 負載持久發光納米粒子(PLNPs)
在檢測細胞或組織的GSH時,會出現選擇性低、分析時間長、低波長激發光對組織的穿透力弱以及在外部光照下來自細胞和組織的自發熒光的干擾等問題.為了克服這些問題,LI等[42]引入了PLNPs作為發光單元,開發了一種使用Mn02修飾的PLNPs的新型納米探針.PLNPs具有獨特的光學性質,當在PLNPs表面形成Mn02NSs時,可以通過FRET有效淬滅PLNPs的持續發光.在少量GSH的存在下,Mn02NSs可以還原為Mn2+,而Mn02誘導的淬滅作用可以逆轉,從而恢復了PLNPs的持久發光.持久的發光特性可以允許在沒有外部激發的情況下進行檢測和成像,并且避免源自原位激發的背景噪聲.實驗結果顯示,該新型納米探針在活細胞和體內都具有良好的GSH檢測性能.
5用于腫瘤的診斷和治療
研究表明,在一些癌細胞中GSH的濃度至少比正常細胞高4倍.GSH作為一種優良的生物刺激因子,在構建藥物遞送納米系統、選擇性細胞內釋放和特異性釋放癌細胞方面受到了極大的關注,到目前為止,已經報道了使用一些材料作為載體的各種GSH響應控制釋放系統,包括聚合物囊泡、膠束、無機納米材料和納米凝膠等[43].但幾乎所有報道的系統都采用二硫鍵作為GSH的敏感連接體,通過2個硫醇的氧化或硫代變換反應.然而,二硫鍵的合成過程耗時且復雜,從而限制了其在生物醫學領域的應用,這促使研究者們尋找快速簡便的策略來構建GSH觸發機制,
近年來,由于Mn02具有高表面積、良好的循環穩定性和強又寬的光吸收等特性,引起了人們廣泛的關注,主要研究領域包括生物傳感器、電池、超級電容器、催化劑和氣體傳感器[44].此外,Mn02還能被GSH還原為具有良好的T1加權MRI效果的Mn2+,為腫瘤的檢測提供一種高分辨率、高組織穿透性和精準的軟組織的成像方式.在腫瘤治療方面,Mn02納米材料已用于腫瘤的光動力治療(PDT)、光熱治療( PTT)、化學動力學治療(CDT)和聲動力治療(SDT).
5.1腫瘤的診斷
分子成像是早期檢測惡性腫瘤的有力工具.將2種或多種成像技術協同組合,能夠解決腫瘤診斷中的敏感性、分辨率和組織穿透性等多種問題.例如,MRI具有較高的空間分辨率和組織穿透性,但敏感性較差.熒光信號具有較差的組織穿透性,但它具有亞細胞分辨率和單細胞敏感性的能力.ZHAO等[45]首次開發了一種新型雙活化MRI/熒光雙模式成像平臺,該策略使用熒光染料Cy5作為適體標記,在Mn0,NSs上用作納米探針,進行腫瘤成像和靶向腫瘤細胞,腫瘤細胞中過表達的GSH誘導Mn02降解產生Mn2+,并釋放Cy5標記的適體,一方面,釋放Cy5標記的適體可用于熒光成像;另一方面,產生的Mri2+用作MRI的造影劑以增加對比度信號,可用作腫瘤細胞雙響應的熒光/MRI診斷平臺.該檢測平臺為早期腫瘤的診斷提供了更可靠的檢測方案,為了提高納米粒子的分散性和生物相容性,FU等[46]通過簡單的方法合成了多功能透明質酸-Mn02納米粒子(HA-Mn02NPs).其中具有生物相容性和生物降解的HA既作為還原劑又作為分散劑.此外,還用作靶向配體特異性結合膠質瘤細胞中的CD44受體[47].由于Mn0,對腫瘤內源性H202和GSH的高反應性,HA-MnO2NPs產生的Mn“可用于腫瘤的靶向MRI檢測,原位產生的O2可同時用于緩解膠質瘤缺氧性.實驗表明,靜脈注射后,HA-Mn02NPs同樣表現出很高的成像敏感性,可在長達3d的時間內通過MRI檢測出小鼠顱內神經膠質瘤.顱內神經膠質瘤中,血管內皮生長因子(VEGF)和缺氧誘導因子-la(HIF-la)表達的下調證實了HA-Mn0,NPs對腫瘤缺氧的持續減緩作用.這些結果表明,HA-Mn0,NPs可用于靈敏性和針對性地檢測腦膠質瘤,同時減輕腫瘤缺氧.
5.2腫瘤的治療
5.2.1 PDT
傳統的腫瘤治療包括手術切除、化療和放療.但是,這些傳統的治療方式給病人帶來了極大的痛苦,且費用高昂.開發新型的腫瘤治療方式已成為研究者們的首要問題.與傳統的腫瘤治療相比,PDT是光療法的一種形式,主要是通過光敏劑在光照下產生活性氧物質來殺死癌細胞,是一種以高特異性殺死腫瘤的微創治療策略.FAN等[48]發現細胞內GSH的濃度與單線態氧(1O2)的含量有關,而1O2是光敏劑在光照下產生的.基于這一事實,他們構建了多功能光敏劑二氫卟酚e6( Ce6) -Mn02( Ce6@MnO2)納米系統.MnO2NSs吸附光敏劑Ce6,保護其免受光照射后的自我破壞,并有效地將其輸送到細胞中,該納米系統還抑制Ce6產生細胞外1O2,降低副作用.納米系統被內吞到腫瘤細胞后,MnO2NSs被細胞內GSH還原.結果,納米系統被分解,釋放Ce6并降低GSH水平,如圖7所示,此外,伴隨著Mn0,NSs的溶解,熒光恢復,提供了用于監測遞送功效的熒光信號,從而實現了對腫瘤的診斷和治療.ZHU等[49]為了降低納米粒子的細胞毒性和提高納米粒子的生物相容性,進一步用氨基封端的聚乙二醇( PEG-NH2)來修飾Ce6@MnO2納米材料,制備出多功能Ce6@MnO2-PEG NPs.利用MnO2與腫瘤微環境中的高濃度的內源性H2O2結合,生成O2來緩解腫瘤缺氧環境,從而提高了腫瘤的PDT效果,實現了在實體腫瘤微環境中增強腫瘤的特異性PDT和MRI.
5.2.2PTT
PTT是基于NIR光熱轉換試劑在激光的照射下將光能轉換成熱能,誘導腫瘤細胞的細胞膜破裂或蛋白質變性來殺死腫瘤細胞.PTT被認為是一種非侵入式微創的腫瘤治療方法.LIU等[8]報道了一種大豆磷脂(SP)修飾的超薄2D Mn02納米片(Mn02-SPs)作為一種新型MRI和光熱試劑,如圖8所示.
Mn02-SPs對內源性腫瘤微環境(TME)表現出超敏感性,可響應于低pH值和高濃度的GSH.在TME中,Mn02分解并釋放Mn2+,用于腫瘤的T1加權MRI.實驗表明,Mn02-SPs具有良好的光熱升溫效果,其光熱轉換效率為21.4%.此外,活體動物的紅外熱成像記錄表明,在NIR激光照射下,納米粒子+激光組(治療組)的小鼠腫瘤表面溫度在5 min內從37℃升高至57℃,而激光組的溫度僅增加了l℃,這實現了PTT對腫瘤的治療.Mn02-SPs這種新型功能性光熱劑具有高光熱轉換能力、腫瘤敏感性和診斷成像性能,為腫瘤的光熱治療提供了有效策略.
5.2.3 PDT和PTT的協同作用
目前,由于實體瘤缺氧、納米藥物在腫瘤積累量少以及光敏劑光穿透深度有限,嚴重限制了PDT效果.而在高溫情況下,腫瘤中高表達的熱休克蛋白限制了PTT療效.因此,將多種治療方式相結合可避免單一治療模式的限制,達到更好的腫瘤治療效果.基于此,LIU等[50]開發了一種可以自給提供02、靶向和NIR活化光敏劑的多合一納米治療劑,該試劑由蜂窩狀Mn02、疏水性NIR染料(碘化物IR780)和牛血清蛋白(BSA)構成,即Mn0,/IR780/BSA納米粒子(HMIB NPs),如圖9所示,體外和體內的熒光成像實驗表明,在靜脈給藥HMIB NPs后,由于腫瘤的通透性和滯留效應(EPR),顯示出高的腫瘤積累,一旦HMIB NPs被運送到腫瘤中,蜂窩狀Mn02與TME中的H202和H+反應產生02.生成較小的Mn02NPs和被BSA包裹的IR780將擴散到腫瘤內,連續生成02并降低細胞內GSH水平,從而緩解腫瘤缺氧.此外,小鼠腫瘤治療實驗表明,當激光功率密度從0.3 W·cm-2增加到l W·cm-2時,在光熱和光動力的協同作用下,可實現腫瘤的完全消融,開發的HMIB NPs有望實現熒光和光熱雙模成像引導的PDT/PTT的協同治療,為腫瘤的高效治療提供了有效策略.
5.2.4 CDT
CDT是一種新興的治療策略,該療法是基于鐵介導的芬頓反應將活性較低的H202轉化為高毒性的羥基自由基(.OH).CDT在癌癥治療方面具有內源性觸發、高TME選擇性和調節腫瘤缺氧等特點.迄今為止,除了鐵材料外,一些金屬離子(例如Mn2+,C02+和Cu2+)表現出類芬頓反應活性,可用于化學動力治療.然而,關于構建類芬頓活性的金屬基化學動力學試劑的研究卻很少.此外,類芬頓金屬釋放的實時成像對于監測CDT過程是至關重要的.
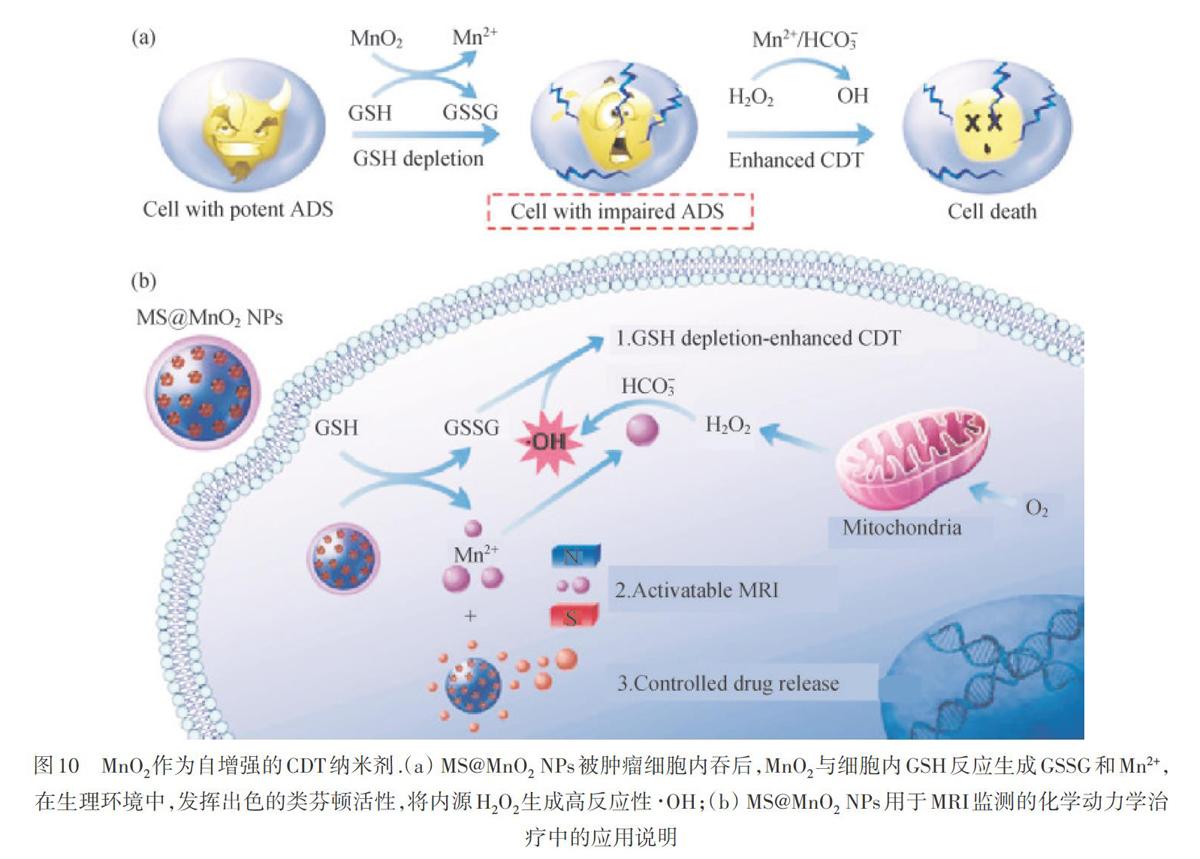
基于此,LIN等[51]開發了基于Mn02自增強的CDT納米劑,該試劑具有類芬頓活性和耗竭GSH特性,通過破壞細胞抗氧化防御系統(ADS)來增強癌癥的CDT,如圖10所示,實驗使用硫醇基團與過量的高錳酸鹽反應,在硫醇官能化的介孔二氧化硅納米粒子(MS NPs)表面原位形成Mn02,制備出MS@Mn02NPs.在生理環境介質中,癌細胞將MS@Mn02NPs內吞后,Mn02層被GSH分解為具有優異類芬頓活性的Mn2+,然后將線粒體產生的內源性H202轉化為劇毒的.OH,并通過消耗細胞內抗氧化劑GSH來防止清除.OH.由于GSH耗竭引起的ADS損傷使癌細胞對Mn2+引起的氧化應激更敏感,因此腫瘤CDT增強,同時,GSH反應性的Mn0,殼解離使其可以充當MS NPs的守門員,以控制藥物釋放.與Mn02相比,Mn2+具有更高的縱向弛豫率(rl),從而賦予了GSH激活的MRI對比作用,可用于監測Mn02與GSH的反應以及隨后的化學動力學治療過程.
5.2.5 SDT
SDT作為一種臨床上非侵入性的腫瘤治療方法,并非使用光或光敏劑來殺死腫瘤,而是利用超聲(US)在聲敏劑的作用下產生活性氧(ROS)促使癌細胞凋亡或壞死.由于聲波的組織穿透性較好,所以SDT適用于治療大型腫瘤或內嵌器官的腫瘤.因此,SDT是一種很有潛力的無創腫瘤治療方法.
GONG等is2i設計并制備了一種基于超小型的多功能聚乙二醇修飾的缺氧雙金屬氧化物納米粒子(MnWOx-PEG NPs)(W表示鎢),用于多模式成像引導的SDT.MnWOx-PEG NPs顯示出獨特的GSH消耗能力,這有利于增強SDT對癌細胞的殺傷力.由于Mn“和鎢的存在,MnWOx-PEG NPs在MR和計算機斷層掃描( CT)成像下顯示出相當大的對比度,可用于追蹤動物體內納米粒子在腫瘤上的聚集.使用MnWOx-PEG NPs作聲敏劑,可以在小鼠腫瘤模型中實現高效的SDT療效,從而抑制腫瘤的生長.值得注意的是,具有超小尺寸的MnWOx-PEG NPs可以在小鼠體內快速代謝而幾乎沒有殘留,從而使其成為安全的SDT試劑.
5.2.6與化療藥物相結合
YANG等[43]設計了一種新型GSH響應性納米藥物遞送平臺,設計思路是根據溶膠一凝膠法合成MS NPs,并將化療藥物阿霉素(DOX)負載在其孔道中,隨后,Mn02納米結構被用作“守門人”,來堵塞MS NPs的孔道.在沒有GSH的情況下,Mn02封端的納米粒子保存完整,抑制了DOX從孔中擴散.然而,在GSH存在時,Mn02可通過氧化還原反應降解為Mn2+,釋放負載的DOX.溶液實驗表明,載有DOX的介孔二氧化硅@二氧化錳(MS@Mn02)納米粒子在0.01 mol·L-1 GSH中顯示出明顯的藥物釋放,而在沒有GSH的情況下未觀察到釋放.細胞毒性實驗結果表明,MS@Mn02NPs對人肝癌細胞(HepG2)和人正常細胞(L02)的活力沒有明顯影響,而負載DOX的MS@Mn02對HepG2細胞的毒性比L02細胞更大,這些結果表明,合成了一種具有靶向能力的藥物遞送系統,這種對GSH敏感的藥物遞送系統為細胞內控制藥物遞送開辟了廣泛的可能性.基于銀納米粒子(Ag NPs)與DOX負載的Mn02NSs的組合,ZHOU等[53]設計了一種新型多功能納米平臺,以誘導增強的癌細胞凋亡.在Ag NPs表面制備的Mn02Ss用作DOX的熒光淬滅劑,納米粒子被內吞到癌細胞中后,GSH將Mn02還原為Mn2+,DOX被釋放,熒光逐漸開啟.Ag NPs誘導的細胞凋亡和隨后的DOX遞送的協同作用導致癌細胞凋亡效果增強.
HAO等[54]開發了基于可降解Mn02NSs的氧化還原和pH雙響應納米平臺,用于癌癥的治療應用.首先合成尺寸為20~60 nm的Mn02NSs,并用(3-氨基丙基)三甲氧基硅烷(APTMS)改性,得到胺基官能化的Mn02;然后通過聚乙二醇(PEG)進行改性;最后將腫瘤靶向基團葉酸(FA)與PEG化的Mn02NSs結合,通過物理吸附將化學治療劑DOX加載到改性后的納米片上,得到Mn02-PEG-FA/DOX NPs.具有良好生物相容性的Mn02-PEG-FA/DOX NPs不僅在體內能有效地將DOX遞送至腫瘤細胞來提高了抗腫瘤效率,而且還可以應對弱酸性環境和高濃度的還原酶.此外,被GSH還原的Mn2+,可用于MRI.實驗表明,在2 mmol·L-1GSH和pH值為5.0條件下,r1值為2.26 mmol-1.s-1.這一具有雙響應可生物降解的NPs有效地結合了MRI和化學療法,為靶向腫瘤的治療提供了一個新穎而有希望的平臺.
6結語
GSH與Mn02之間的氧化還原反應已被廣泛用于生物領域,包括細胞內GSH的檢測、腫瘤的診斷和治療,不同的實驗進一步證明了該反應在實際應用中具有良好的效果.GSH與Mn02之間的氧化還原反應為監測機體GSH的水平變化和腫瘤的診療提供了簡便有效的方案.但是,在實施方案過程中如何避免其他信號的干擾,提高在生物領域應用的效率仍是首要研究問題,隨著科學家們的不斷努力和科技的進步,相信該反應會在生物領域上有更大的突破.
參考文獻:
[1] DENG R R,XIE X J,VENDRELL M, et al.lntracellularglutathione detection using Mn02-nanosheet-modifiedupconversion nanoparticles [J].Journal of the American Chemical Society,2011, 133( 50):20168 - 20171.
[2]GAO W Y, XIE X J, BAKKER E, et al. Ultrasensitive glutathione detection based on lucigenin cathodicelectrochemiluminescence in the presence of Mn02 nanosheets [J].Analytical Chemistry , 2016, 88( 15 ) : 7654 - 7659.
[3] TAN Q Q,ZHANG R R,KONG R M,et al.Detection of glutathione based on Mn02 nanosheet-gated mesoporous silicananoparcicles and target induced release of glucose measured with a portable glucose meter [J ].Microchimica Acta,2018 ,185(1) :1- 7.
[4] SHI M, HUANG Y, ZHAO J J, et al. Quantification of glutathione in single cells from rat liver by microchipelectrophoresis with chemiluminescence detection [J] .Talanta, 2018 , 179 : 466 - 471.
[5] DALTONT P, SHERTZERH G, PUGA A.Regulation of gene expression by reactive oxygen [J].Annual Review ofPhanuacology and Toxicology , 1999,39( 1) :67 - 101.
[6] QIU W X, LI H L, LI S Y, et al.ACPI conjugated gold nanorods as nanoplatform for dual image guided activatablephotodynamic and photothermal combined therapy in, vivo [J].Srua11,2017 , 13 ( 18) : 1603956.
[7]DONG Z Z,LU L H,KO C N,et al.A Mn02 nanosheet-assisted GSH detection platform using an iridium (iii) complex asa switch- on luruinescent probe [J].Nanoscale ,2017 ,9( 14 ) :4677 - 4682.
[8] LIU Z,ZHANG S J,LIN H,et al.Theranostic 2D ultrathin Mn02 nanosheets with fast responsibility to endogenous tumormicroenvironment and exogenous NIR irradiation [J] .Biomaterials , 2018 , 155 : 54 - 63.
[9] YIN J, KWON Y H, KIM D B,et al.Preparation of a cyanine-based fluorescent probe for highly selective detection ofglutathione and its use in living cells and tissues of mice [J].Nature Protocols ,2015 ,10( 11) : 1742 - 1754.
[10]HARFIELD J C , BATCHELOR-MCAULEY C , COMPTON R G.Electrochemical determination of glutathione : a review[J].Analyst,2012 ,137( 10) : 2285 - 2296.
[11] ZHANG X B, KONG R M,TAN Q Q, et al.A lahel-free fluorescence turn-on assay for glutathione detection by usingMn02 nanosheets assisted aggregation-induced emission-silica nanospheres [J].Talanta, 2017 , 169 : 1 - 7.
[12] CHEN J C ,HUANG Z M,MENG H M,et al.A facile fluorescence lateral flow biosensor for glutathione detection based onquantum dots-Mn02 nanocomposites [J].Sensors and Actuators B : Chemical,2018 ,260 : 770 - 777.
[13]GE J, CAI R, CHEN X G, et al.Facile approach to prepare HSA-templated Mn02 nanosheets as oxidase mimic forcolorimetric detection of glutathione [J].Talanta ,2019, 195 :40 - 45.
[14]YAO C P,WANG J,ZHENG A X,et al.A fluorescence sensing platform with the Mn02 nanosheets as an effective oxidantfor glutathione detection [J] .Sensors and Actuators B :Chemical, 2017,252: 30 - 36.
[15] TANG Y J,ZHENG S S, XU Y X, et al.Advanced batteries based on manganese dioxide and its composites [J].EnergyStorage Materials ,2018 ,12: 284 - 309.
[16] HOUSEL L M,WANG L, ABRAHAM A, et al.lnvestigation of ol-Mn02 tunneled structures as model cation hosts forenergy storage [J].Accounts of Chemical Research,2018 ,51 ( 3 ) : 575 - 582.
[17] MA R,BANDO Y,ZHANG L,et al.Layered Mn02 nanobelts:hydrothermal synthesis and electrochemical measurements [J].Advanced Materials ,2004 ,16(1 1) :918 - 922.
[18]WANG X,LI Y D.Selected-control hydrothermal synthesis of a-and [β-Mn02 single crystal nanowires [J].Journal of theAmerican Chemical Society,2002 , 124 ( 12 ) : 2880 - 2881.
[19] ZHENG D S , SUN S X , FAN W L, et al.One-step preparation of single-crystalline [β-Mn02 nanotubes [J].The Journal ofPhysical Chemistry B ,2005 ,109 ( 34) : 16439 - 16443.
[20] LIU J, SON Y C, CAl J, et al.Size control, metal substitution, and catalytic application of cryptomelane nanomaterialsprepared using cross-linking reagents [J].Chemistry of Materials , 2004 ,16( 2 ) :276 - 285.
[21] SUI N, DUAN Y Z, JIAO X L, et al. Large-scale preparation and catalytic properties of one-dimensional a/[β -Mn0nanostructures [J] .The Journal of Physical Chemistry C ,2009 ,113 ( 20) : 8560 - 8565.
[22] PORTEHAULT D,CASSAIGNON S,BAUDRIN E ,et al.Morphology control of cryptomelane type Mn02 nanowires by softchemistry : growth mechanisms in aqueous medium [J].Chemistry of Materials ,2007,19( 22 ) :5410 - 5417.
[23]LI Q G, OLSON J B, PENNER R M.Nanocrystalline a-Mn02 nanowires by electrochemical step-edge decoration [J].Chemistry of Materials , 2004, 16( 18 ) : 3402 - 3405.
[24]MIAO P,LIU L,NIE Y J,et al.An electrochemical sensing strategy for ultrasensitive detection of glutathione by using tw。gold electrodes and two complementary oligonucleotides [J].Biosensors and Bioelectronics,2009,24( 11 ) :3347 - 3351.
[25] YUAN B Q,ZENG X Y,XU C Y, et al.Electrochemical modification of graphene oxide bearing different types of oxygenfunctional species for the electro-catalytic oxidation of reduced glutathione [J].Sensors and Actuators B : Chemical,2013 ,184 :15 - 20.
[26]TSARDAKA E C,ZACHARIS C K,TZANAVARAS P D,et al.Determination of glutathione in baker's yeast by capillaryelectrophoresis using methyl propiolate as derivatizing reagent [J].Journal of Chromatography A , 2013 , 1300: 204 - 208.
[27] JANES L,LISJAK K,VANZO A.Determination of glutathione content in grape juice and wine by high-performance liquidchromatography with fluorescence detection [J].Analytica Chimica Acta,2010,674( 2) :239 - 242.
[28]ZHAO Z L, FAN H H ,ZHOU G F , et al.Activatable fluorescence/MRI bimodal platform for tumor cell imaging via Mn02nanosheet-aptamer nanoprobe [J] .Journal of the American Chemical Society ,2014 ,136( 32 ) : 11220 - 11223.
[29] NI,P J,SUN Y J,DAI H C ,et al.Highly sensitive and selective coloriruetric detection of glutathione based on Ag [I] ion-3 ,3 ' ,5 ,5 '-tetramethylbenzidine ( TMB) [J] .Biosensors and Bioelectronics ,2015 ,63 :47 - 52.
[30] CAI Q Y,LI J,GA J,et al.A rapid fluorescence “switch-on” assay for glutathione detection by using carbon dots-Mn02nanocomposites [J ].Biosensors and Bioelectronics,2015 , 72 :31 - 36.
[31] XU Y, CHEN X, CHAI R, et al.A magnetic/fluorometric bimodal sensor based on a carbon dots-Mn02 platform forglutathione detection [J].Nanoscale , 2016 ,8( 27 ) : 13414 - 13421.
[32]HE D G, YANG X X, HE X X, et al.A sensitive turn-on fluorescent probe for intracellular imaging of glutathione usingsingle-layer Mn02 nanosheet-quenched fluorescent carbon quantum dots [J].Chemical Communications, 2015 , 51 ( 79) :14764 - 14767.
[33] WANG Y H,JIANG K,ZHU J L,et al.A FRET-based carbon dot-Mn02 nanosheet architecture for glutathione sensing inhuman whole blood samples [J].Chemical Communications ,2015 ,51( 64) : 12748 - 12751.
[34]FU X L,HOU F,LIU F R,et al.Electrochemiluminescence energy resonance transfer in 2D/2D heterostructured g-C3N4/Mn02 for glutathione detection [J ].Biosensors and Bioelectronics,2019 ,129: 72 - 78.
[35] GOSWAMI N , GIRl A , BOOTHARAJU M S, atel.Copper quantum clusters in protein matrix: potential sensor of Pb2+ ion[J].Analytical Chemistry ,2011 ,83 ( 24 ) :9676 - 9680.
[36]WANG H B,CHEN Y,LI Y,et al.A sensitive fluorescence sensor for glutathione detection based on Mn02 nanosheets-copper nanoclusters composites [J ] .RSC Advances , 2016 ,6( 83 ) :79526 - 79532.
[37] FAN W P,BU W B,SHEN B,et al.lntelligent Mn02 nanosheets anchored with upconversion nanoprobes for concurrentpH-/H202-responsive UCL imaging and oxygen-elevated synergetic therapy [J].Advanced Materials, 2015, 27 (28) :415 5 - 4161.
[38]SUN J J, LIU F, YU W Q, et al. Highly sensitive glutathione assay and intracellular imaging with functionalizedsemiconductor quantum dots [J ].Nanoscale ,2019 ,11( 11) :5014 - 5020.
[39]MENG H M,JIN Z, LV Y F,et al.Activatable two-photon fluorescence nanoprobe for bioimaging of glutathione in livingcells and tissues [J] .Analytical Chemistry ,2014,86(24) : 12321 - 12326
[40]LIU S G,LIU T,LI N,et al.Polyethylenimine-derived fluorescent nonconjugated polymer dots with reversible dual-signalpH response and logic gate operation [J].The Journal of Physical Chemistry C ,2017,121 ( 12) :6874 - 6883.
[41] HAN L,LIU S G,ZHANG X F,et al.A sensitive polymer dots-manganese dioxide fluorescent nanosensor for “turn-on”detection of glutathione in human serum [J].Sensors and Actuators B :Chemical,2018,258: 25 - 31.
[42]LI N, DIAO W, HAN Y Y, et al.Mn02-modified persistent luminescence nanoparticles for detection and imaging ofglutathione in living cells and in, vivo [J].Chemistry : A European Journal,2014 ,20(50) : 16488 - 16491.
[43]YANG X, HE D G, HE X X, et al.Glutathione-mediated degradation of surface-capped Mn02 for drug release frommesoporous silica nanoparlicles to cancer cells [J] .Particle & Particle Systems Characterization ,2015 ,32 ( 2 ) : 205 - 212.
[44] YUAN Y X, WU S F,SHU F, et al.An Mn02 nanosheet as a label-free nanoplatform for homogeneous biosensing [J].Chemical Communications ,2014,50( 9) : 1095 - 1097.
[45]ZHAO Z L, FAN H H, ZHOU G F, et al.Activatable fluorescence/MRI bimodal platform for tumor cell imaging viaMn02 nanosheet-aptamer nanoprobe [J ].Journal of the American Chemical Society , 2014 ,136( 32) : 11220 - 11223.
[46]FU C P, DUAN X H, CAO M H, et al. Targeted magnetic resonance imaging and modulation of hypoxia withmultifunctional hyaluronic acid-Mn02 nanoparticles in glioma [J ] .Aclvanced Healthcare Materials , 2019 , 8 ( 10 ) : 1 - 11.
[47]YIN YT,FU C P, LI M,et al.A pH-sensitive hyaluronic acid prodrug modified with lactoferrin for glioma dual-targetedtreatment [J].Materials Science and Engineering: C ,2016 ,67: 159 - 169.
[48] FAN H H, YAN G B, ZHAO Z L, et al. A smart photosensitizer-manganese dioxide nanosystem for enhancedphotodynamic therapy by reducing glutathione levels in cancer cells [J].Angewandte Chemie International Edition,2016 ,55(18) :5477 - 5482.
[49] ZHU W W,DONG Z L,FU T T,et al.Modulation of hypoxia in solid tumor microenvironment with Mn02 nanoparticles toenhance photodynamic therapy [J ].Advanced Functional Materials ,2016,26(30) :5490 - 5498.
[50]LIU X M,TIAN K,ZANG J H,et al.Smart NIR-light-mediated nanotherapeutic agents for enhancing tumor accumulationand overcoming hypoxia in synergistic cancer therapy [J].ACS Applied Bio Materials ,2019 ,2( 3) :1225 - 1232.
[51] LIN L S, SONG J B, SONG L, et al.Simultaneous fenton-like ion delivery and glutathione depletion by Mn02-basednanoagent to enhance chemodynamic therapy [J ].Angewandte Chemie International Edition,2018 ,57( 18) :4902 - 4906.
[52] GONG F,CHENG L,YANG N L,et al.Ultrasmall oxygen-deficient bimetallic oxide MnWOx nanoparticles for depletion ofendogenous GSH and enhanced sonodynamic cancer therapy [J].Advanced Materials ,2019,31 ( 23 ) : 1900730.
[53]ZHOU F,ZHANG T T,ABDEL-HALIM E S,et al.A multifunctional core-shell nanoplatform for enhanced cancer cellapoptosis and targeted chemotherapy [J].Journal of Materials Chemistry B ,2016,4( 17) :2887 - 2894.
[54] HAO Y W, WANG L,ZHANG B, et al.Multifunctional nanosheets based on folic acid modified manganese oxide fortumor-targeting theranostic application [J] .Nanotechnology ,2015 , 27 ( 2) : 025101.
(責任編輯:郁慧,馮珍珍)
收稿日期:2019-11-13
基金項目:國家自然科學基金(91959105)
作者簡介:王海梅(1996-),女,碩士研究生,主要從事無機材料方面的研究.E-mail: 100044135 l@smail.shnu.edu.cn
通信作者:田啟威(19 83-),男,副教授,主要從事智能診療材料方面的研究.E-mail:qiweitian@shnu.edu.cn;楊仕平(1969-),男,教授,主要從事磁共振成像造影劑的開發及其應用方面的研究.E-mail:shipingy@shnu.edu.cn
引用格式:王海梅,田啟威,楊仕平.谷胱甘肽和二氧化錳的氧化還原反應在生物領域上的應用[J].上海師范大學學報(自然科學版),2020,49(2):203-218.

