根結線蟲生防真菌交枝頂孢原生質體的制備與再生體系構建
姚玉榮 霍建飛 郝永娟
摘要 本研究以根結線蟲生防真菌交枝頂孢Acremonium implicatum為供試菌株,探究了菌齡、降解酶種類、酶解溫度和時間、不同滲透壓穩定劑、不同pH等因素對其原生質體制備的影響,并建立了交枝頂孢原生質體制備體系;制備的原生質體在SR培養基上再生率達到17.78%。此外,GFP遺傳轉化菌株的獲得充分表明制備的原生質體可作為后續遺傳轉化材料,為進一步研究交枝頂孢對根結線蟲的生防機理奠定基礎。
關鍵詞 交枝頂孢; 原生質體制備; 再生; 綠色熒光蛋白
中圖分類號: S 435.45; S 476
文獻標識碼: A
DOI: 10.16688/j.zwbh.2019447
Abstract In order to establish protoplast-mediated genetic transformation of the biocontrol fungus Acremonium implicatum, the conditions for the isolation and regeneration of A.implicatum protoplasts were optimized, including culture time, enzyme system, enzymatic digestion time and temperature, type of osmotic stabilizers, pH value and so on. For the preparation of protoplasts, solid regeneration medium was better with a regeneration rate of protoplasts of 17.78%. The transformant strain with GFP was obtained. The system may build a foundation for further study on the mechanism of biocontrol against the root-knot nematode.
Key words Acremonium implicatum; protoplast preparation; regeneration; GFP
根結線蟲Meloidogyne spp.是一類世界性分布的重要植物病原物,給全球農業生產帶來了巨大的經濟損失[1]。蔬菜生產是農業生產中不可或缺的一部分,隨著保護地蔬菜種植面積的逐年增加,根結線蟲病害發生日益嚴重。根結線蟲種類繁多,分布廣,致病性強且寄主范圍廣泛、環境適應性強,能侵染幾乎所有的蔬菜作物[1-2]。在蔬菜作物中,以茄科、十字花科和葫蘆科等受害最重[3]。蔬菜作物被根結線蟲侵染后會導致產量降低,品質下降。根結線蟲還會與其他病原物形成復合侵染,造成更加嚴重的經濟損失。根結線蟲的防治主要為土壤熏蒸劑和化學殺蟲劑[4],但是由于使用不規范、危害人類健康、污染環境等問題的頻繁出現,越來越多的化學農藥被禁止使用[5-6]。尋找高效且環境友好的根結線蟲防治措施是當前亟待解決的問題之一。因此應用微生物防治根結線蟲已經成為國內外研究的重點內容。木霉Trichoderma spp.[7-8]、擬青霉Paecilomyces spp.[9]以及枝頂孢Acremonium spp.[10-11]等生防菌對根結線蟲的防治效果顯著。然而,對生防真菌防治線蟲機制的研究相對較少,限制了當前生物防治方法的應用。鑒于這種情況,需要加深對生防真菌防控機理的研究,而這項研究的關鍵技術就是建立生防菌的高效遺傳轉化體系。絲狀真菌高效遺傳轉化體系的構建一般通過農桿菌介導或者聚乙二醇介導的原生質體轉化來實現[12-17]。原生質體轉化具有轉化效率高、操作簡單等特點,因此原生質體的制備是遺傳轉化的首要問題。
近年來,許多學者對絲狀真菌遺傳轉化進行了大量的研究,但是由于真菌細胞壁組成和結構十分復雜,制備原生質體的體系和條件存在很大的差別。交枝頂孢A.implicatum對根結線蟲具有良好的生防作用[18-19],考慮到其在線蟲防治中良好的應用前景,對該菌進行原生質體制備與再生的研究,可為A.implicatum遺傳體系的建立以及該菌生防機理的研究奠定良好的基礎。
1 材料與方法
1.1 菌株
交枝頂孢A.implicatum菌株由中國農業科學院蔬菜花卉研究所蔬菜病害室保存。
1.2 培養基和試劑
馬鈴薯湯汁培養基(馬鈴薯200 g,D-葡萄糖20 g,定容至1 L;PDB)用于菌株產孢。馬鈴薯固體培養基(馬鈴薯湯汁培養基,1.5%瓊脂;PDA)用于制備新鮮菌絲。固體再生培養基(0.1%酵母提取物,01%酶水解干酪素,1 mol/L蔗糖, 0.7%瓊脂粉;SR),液體再生培養基(0.1%酵母提取物,0.1%酶水解干酪素,1 mol/L蔗糖; LR)。
原生質體制備所需試劑:PTC溶液(60%聚乙二醇3350,10 mmol/L Tris-Cl pH 7.5,50 mmol/L氯化鈣),STC溶液(1.2 mol/L山梨醇,50 mmol/L氯化鈣,10 mmol/L Tris-HCl)。
1.3 交枝頂孢原生質體的制備
本試驗采用酶解細胞壁法制備生防真菌交枝頂孢的原生質體。設置菌絲培養時間、裂解酶系統、酶解時間和溫度、不同pH等試驗參數,建立該菌株原生質體制備和再生體系。
1.3.1 菌絲培養時間對原生質體制備的影響
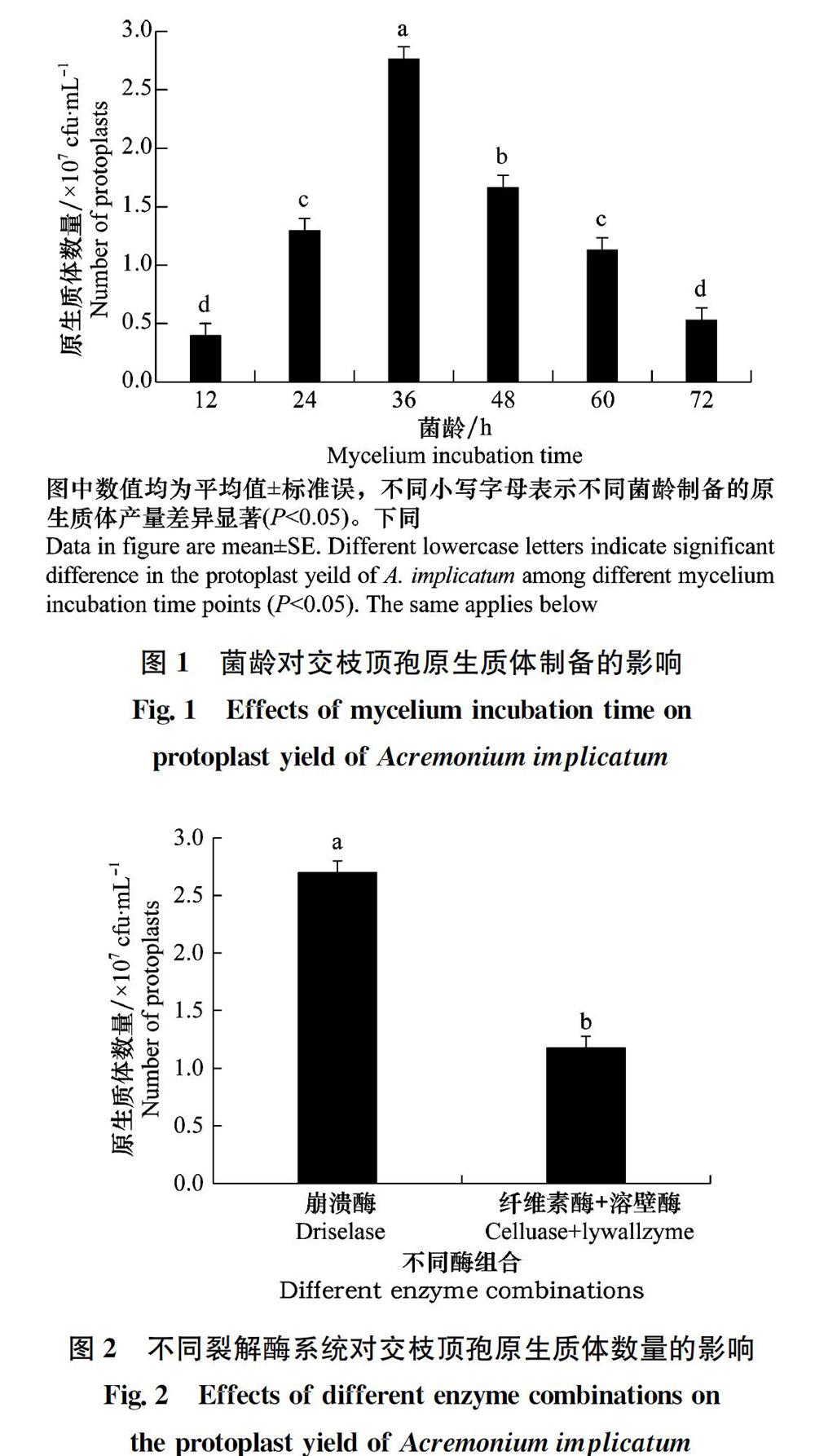
參照Parsons等[20]的方法制備原生質體并略有改動。交枝頂孢菌株在PDA平板上28℃黑暗培養5 d,用5 mm打孔器在菌落邊緣打孔,取一菌塊置于PDB中25℃,150 r/min 培養2 d,收集孢子并制備成均勻的孢子懸浮液(1×108個/mL)。取1 mL孢子懸浮液置于100 mL PDB中25℃, 150 r/min分別培養24、36、48、60、72 h,用滅菌過濾網過濾,然后用滲透壓穩定劑反復充分沖洗收集菌絲,待菌絲沖洗至團狀后轉至滅菌的50 mL離心管中(離心管需提前稱重),整個操作過程在超凈工作臺進行。用離心管稱取收集好的菌絲0.5 g,加入2 mL酶解液(20 mg/mL崩潰酶)后置于搖床上振蕩孵育,3 h后觀察原生質體獲得率,選出最適宜制備交枝頂孢原生質體的菌齡。試驗設置3次重復。
為了檢測制備的原生質體能否用于轉化,將構建好的含有GFP基因的表達載體pCH-sGFP(中國農業科學院蔬菜花卉研究所提供)通過聚乙二醇介導的方法進行遺傳轉化。在藍色激發光下,觀察到轉化子發出明亮的綠色熒光(圖8),說明GFP基因已經成功轉入交枝頂孢A.implicatum中,且能夠正常表達。
3 結論與討論
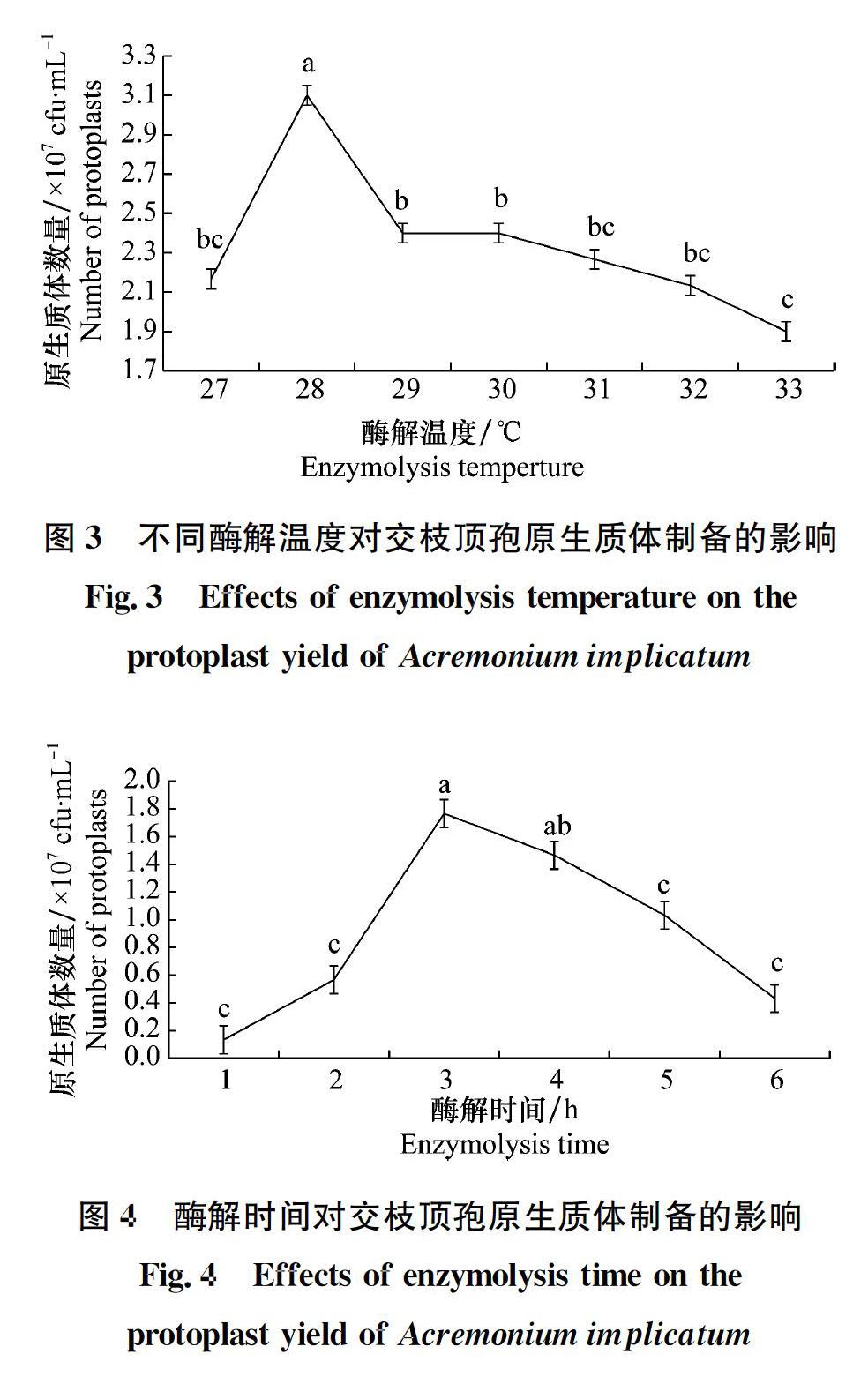
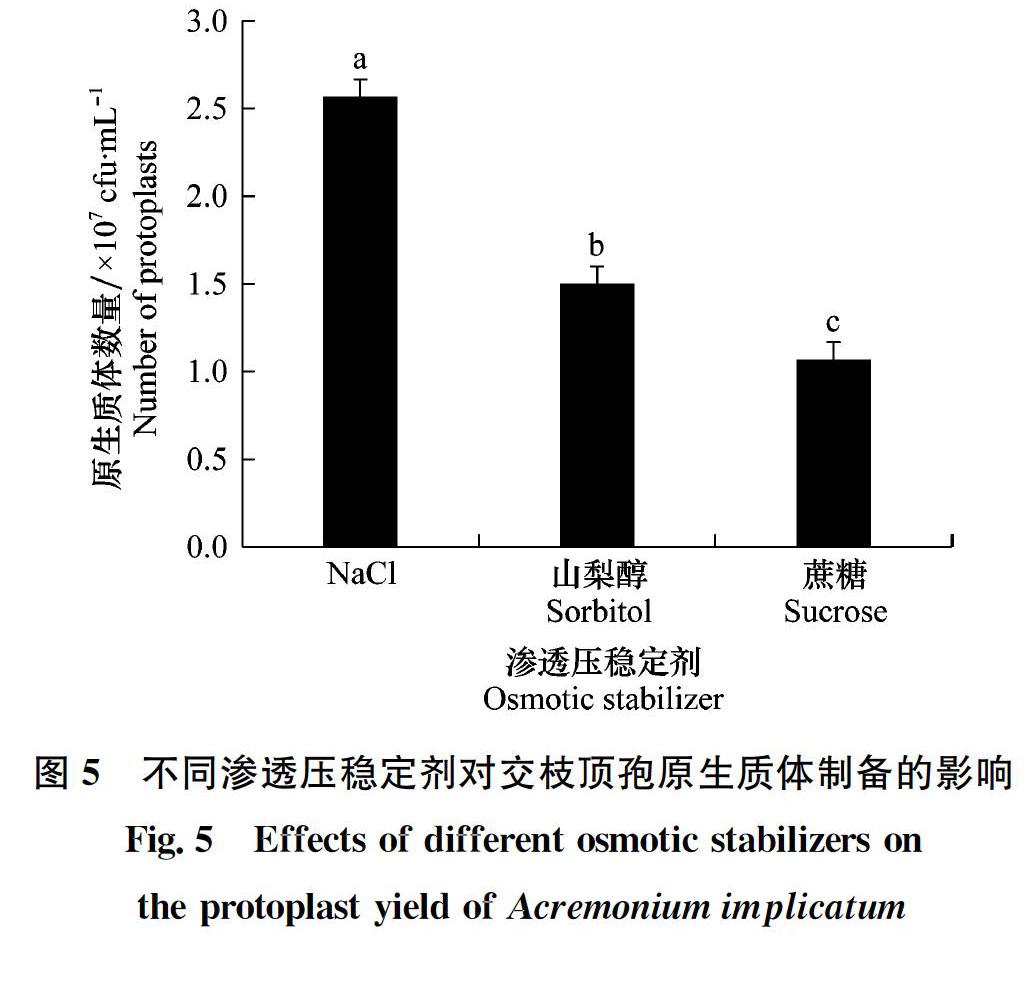
原生質體的制備和再生是建立真菌遺傳轉化體系過程中的關鍵技術,直接影響遺傳轉化效率。本研究采用單因素試驗研究了影響內生真菌交枝頂孢原生質體制備和再生的條件,明確了交枝頂孢原生質體制備及再生的最適宜條件為:孢子液搖培36 h,用滅菌的過濾網過濾后,以pH為6.5的0.7 mol/L NaCl為滲透壓穩定劑反復洗滌菌絲,用濃度為20 mg/mL的崩潰酶按照0.5 g菌絲:2 mL酶液在28℃恒溫(120 r/min)酶解3 h,以SR培養基為再生培養基。
研究發現制備原生質體時菌絲的生理狀態對原生質體產量和質量有著重要的影響。通常在菌絲線性生長早期原生質體容易制備,但也并不是菌絲越幼嫩越容易酶解。菌絲在其生長的某個階段對降解酶最為敏感,可能是由于菌絲不同生長階段細胞壁的結構組成不同,使得其對降解酶的敏感性不同[24-25]。
不同種類真菌細胞壁組成和結構不同,所用的裂解酶和酶解時間差異很大。弭寶彬等發現15 mg/mL崩潰酶對尖孢鐮刀菌辣椒專化型Fusarium oxysporum f. sp. capsicum酶解效率最高[26]。趙小強等對制備大麗輪枝菌Verticillium dahliae原生質體的條件進行優化時發現,裂解酶濃度為10 mg/mL時原生質體產量最高[27]。因此,細胞壁降解酶是原生質體制備的另一個關鍵因素。試驗采用了兩種降解酶系統,試驗結果表明對于交枝頂孢而言,20 mg/mL的崩潰酶酶解效果優于纖維素酶和溶壁酶混合酶的酶解效果。
在交枝頂孢原生質體制備的過程中,原生質體的數量隨著酶解時間的延長呈現先增加后減少的趨勢,在3 h時達到峰值,可能的原因為酶解時間長導致酶液活性降低或原生質體破裂。時濤等在橡膠多主棒孢的原生質體制備以及李伶俐等在甘藍枯萎病菌原生質體制備研究中也有類似發現[28-29]。
本研究建立了食線蟲真菌交枝頂孢原生質體的制備和再生體系,同時探明了體系相關的影響因素,為進一步研究交枝頂孢對根結線蟲的生防機理提供了重要的材料基礎。
參考文獻
[1] ABAD P, GOUZY J, AURY J M, et al. Genome sequence of the metazoan plant-parasitic nematode Meloidogyne incognita [J]. Nature Biotechnology, 2008, 26(8): 909-915.
[2] TRUDGILL D L, BLOK V C. Apomictic, polyphagous root-knot nematodes: exceptionally successful and damaging biotrophic root pathogens [J]. Annual Review of Phytopathology,2001,39(1):53-77.
[3] 劉維志. 植物病原線蟲學[M]. 北京:中國農業出版社,2000.
[4] NOLING J, BECKER J O. The challenge of research and extension to define and implement alternatives to methyl bromide[J].Journal of Nematology, 1994,26(4S): 573.
[5] 董錦艷,張克勤,趙智嫻,等.殺線蟲菌物毒素的研究進展(Ⅱ)[J].中國生物防治,2001,17(3):138-141.
[6] AMARAL D R, OLIVEIRA F E R, OLIVEIRA D F, et al. Purification of a Fusarium moniliforme metabolite toxic to Meloidogyne exigua [J]. Summa Phytopathologica (Brazil), 2003,29(1):25-29.
[7] SHARON E, BAR-EYAL M, CHET I, et al. Biological control of the root-knot nematode Meloidogyne javanica by Trichoderma harzianum [J]. Phytopathology, 2001,91(7): 687-693.
[8] GOSWAMI J, PANDEY R K, TEWARI J P, et al. Management of root knot nematode on tomato through application of fungal antagonists, Acremonium strictum and Trichoderma harzianum [J]. Journal of Environmental Science and Health Part B, 2008, 43(3):237-240.
[9] KIEWNICK S, SIKORA R A. Biological control of the root-knot nematode Meloidogyne incognita by Paecilomyces lilacinusstrain 251 [J]. Biological Control, 2006, 38(2): 179-187.
[10]YAN Xiaoning, SIKORA R A, ZHENG Jingwu. Potential use of cucumber (Cucumis sativus L.) endophytic fungi as seed
treatment agents against root-knot nematode Meloidogyne incognita [J]. Journal of Zhejiang University Science B, 2011, 12(3): 219-225.
[11]林森,武俠,曹君正, 等.產生幾丁質酶的交枝頂孢(Acremonium implicatum)對南方根結線蟲生防潛力[J].植物病理學報,2013,43(5):509-517.
[12]趙培寶,周慶新,郭芳先, 等.限制性內切酶介導的串珠鐮刀菌插入突變和致病性突變體的分離[J].植物病理學報,2007,37(5):545-548.
[13]許夢秋,姜杰,孫漫紅,等.限制性內切酶介導的粉紅粘帚霉67-1轉化體系構建[J].中國生物防治學報,2013,29(2):263-269.
[14]沈慧敏,李超,高利,等.原生質體法介導真菌遺傳轉化的研究進展[J].植物保護,2017,43(2):25-28.
[15]范亮波,李梅,冀穎,等.根癌農桿菌介導的木霉遺傳轉化及應用進展[J].生物技術通報,2010(3):1-5.
[16]胡彩平,鄭金龍,高建明,等.根癌農桿菌介導柱花草炭疽菌遺傳轉化體系的優化[J].熱帶作物學報,2013,34(6):1007-1012.
[17]JIANG Dewei, ZHU Wei, WANG Yunchuan,et al. Molecular tools for functional genomics in filamentous fungi: Recent advances and new strategies [J]. Biotechnology Advances, 2013,31(8):1562-1574.
[18]TIAN Xueliang, YAO Yurong, CHEN Guohua, et al. Suppression of Meloidogyne incognita by the endophytic fungus Acremonium implicatum from tomato root galls [J]. International Journal of Pest Management, 2014, 60(4): 239-245.
[19]YAO Yurong, LIN Runmao, TIAN Xueliang, et al. The complete mitochondrial genome of the nematophagous fungus Acremonium implicatum [J]. Mitochondrial DNA Part A, DNA Mapping, Sequencing and Analysis, 2016, 27(5): 3246-3247.
[20]PARSONS K A, CHUMLEY F G, VALENT B. Genetic transformation of the fungal pathogen responsible for rice blast disease [J]. Proceedings of the National Academy of Sciences, 1987, 84(12):4161-4165.
[21]張卉, 劉長江. 姬松茸原生質體形成和再生的研究[J]. 微生物學報, 2003,23(3):18-22.
[22]李晶瑩, 孫婷婷, 張國權,等.大型真菌原生質體的制備與再生研究[J]. 中國林副特產, 2015(4):98-101.
[23]REHMAN L, SU Xiaofeng, GUO Huiming, et al. Protoplast transformation as a potential platform for exploring gene function in Verticillium dahliae [J/OL]. BMC Biotechnology, 2016, 16(1): 57. DOI:10.1186/s12896-016-0287-4.
[24]孫傳寶,朱春寶,許文思.產黃青霉原生質體制備和再生影響因子分析[J].中國抗生素雜志,2001,26(4):241-243.
[25]宋慶濤,張國珍,董金皋.玉米大斑病菌原生質體的制備與再生[J].微生物學通報,2003,30(2):41-44.
[26]弭寶彬,張吉祥,楊宇,等.尖孢鐮刀菌辣椒專化型原生質體制備條件優化[J].生物技術通報,2013,4(4):96-100.
[27]趙小強,陳志榮,何芳,等.大麗輪枝菌原生質體的制備與再生[J].生物技術通報,2018,34(7):166-173.
[28]時濤,裴月令,劉先寶,等.橡膠樹多主棒孢病菌原生質體轉化體系的建立[J]. 熱帶作物學報,2009,30(9):1351-1358.
[29]李伶俐,嚴紅,李興紅,等.甘藍枯萎病菌原生質體的制備與再生條件的優化[J]. 中國農學通報,2011,27(10):203-207.
(責任編輯:楊明麗)

