牙周炎微環境下靜態牽張力對牙周膜干細胞中炎性細胞因子分泌的影響
蔡東軒,孫唯夫,金作林,劉 佳
牙周病是最常見的口腔疾病之一,在我國大約有90%的人患有牙周疾病,其中能造成深部牙周組織結構破壞的牙周炎發病率大于40%,有活動性牙周炎的人群比例也在逐年上升[1]。牙周炎造成的牙齒伸長、咬合創傷等情況會影響口頜系統功能和顏面美觀,因此而尋求正畸治療的患者越來越多。牙周炎癥未得到有效控制的情況下對牙周炎患者進行正畸治療會出現牙槽骨的快速吸收,這一情況大幅增加了治療難度和風險,因此在正畸治療前以及期間有效控制牙周炎癥是十分必要的[2]。但即便牙周炎癥得到控制,不可逆的牙周附著喪失等情況也會使得牙周病患者的牙周組織改建再生能力下降,正畸預后較差,其具體機制尚不清晰。作為牙周組織間充質干細胞之一的牙周膜干細胞(periodontal ligament stem cells,PDLSCs)因具有高度的增殖、自我更新和多向分化能力[3],自發現以來就是修復與再生領域的研究熱點[4],是參與牙周組織再生的主要候選干細胞[5]。然而牙周炎微環境對PDLSCs的生物學功能有很大影響,體外培養發現炎癥微環境下PDLSCs的聚集受到顯著抑制,成骨分化能力和免疫調節能力受損,其相應標記基因ALP、RUNX2、OCN的mRNA和蛋白表達水平下調[6-7]。本課題組前期研究發現牙周炎微環境會導致PDLSCs成骨能力下降,其功能損害無法通過體外培養擴增而恢復,但改善其所處的微環境,例如將其與牙囊細胞共培養時,可以恢復牙周炎環境下受損的再生能力[8]。因此,改善PDLSCs的炎癥損傷對牙周組織的改建和再生至關重要。
正畸治療時牙齒周圍骨組織吸收與再生的平衡是正畸治療的關鍵,炎癥因子IL-1β、IL-6、TNF-α和抗炎因子IL-10作為重要的信號調節分子參與了骨和牙周膜重塑的過程[9]。與正常情況相比,牙周病組織來源的牙周膜干細胞(periodontal ligament stem cells obtained from periodontal tissues of periodontitis patients, PPDLSCs)中TNF-α、IL-1β和IL-6的表達明顯上升[10],高表達的IL-1β通過激活核因子-κB(NF-κB)和有絲分裂原激活蛋白激酶(MAPK)抑制PDLSCs的成骨能力[11]。但目前關于PPDLSCs在牽張力加載情況下炎性細胞因子的表達情況仍不清晰,因此本實驗建立不同靜態牽張力(static mechanical strain, SMS)加載下正常來源的牙周膜干細胞(periodontal ligament stem cells obtained from healthy periodontal tissues, HPDLSCs)和PPDLSCs模型,通過Elisa檢測炎性細胞因子表達水平,探明不同SMS加載條件下PPDLSCs的炎癥反應情況與HPDLSCs的差異,為臨床上牙周炎患者的正畸治療提供一定的生物學依據。
1 材料與方法
1.1 試劑與儀器
α-MEM培養基(Gibco,美國);Ⅰ型膠原酶、胰蛋白酶(Sigma,美國);胎牛血清(四季青公司,中國);鼠抗人 CD105、CD29、CD14 (Bioscience,美國);ELISA 檢測試劑盒(R&D Systems,美國);Bioplate 6孔板、FX-4000T Tension Plus Unit(Flexcell,美國);CO2孵箱(Heraeus,德國);紫外線分光光度儀(Eppendorf,德國);倒置相差顯微鏡及照相系統(Olympus,日本);臺式水平離心機(Beckman,美國);流式細胞儀(Beckman-Coulter,美國);6 孔培養板(Falcon,美國)。
1.2 實驗方法
1.2.1 HPDLSCs和PPDLSCs的獲取 HPDLSCs來源于10例準備在空軍軍醫大學第三附屬醫院正畸科接受正畸治療且牙周組織健康的患者,平均年齡(37.9±7.2)歲,女5例,男5例。PPDLSCs 來源于8例準備在空軍軍醫大學第三附屬醫院正畸科接受正畸治療且被診斷為中度慢性牙周炎的患者,平均年齡(38.9±7.9)歲,女4例,男4例,診斷標準參考1999年國際研討會所制定的牙周病分類標準[12]:探診出血陽性,牙周袋深度≤6 mm,附著喪失 3~4 mm,X線片顯示牙槽骨水平吸收達根長的 1/3~1/2。上述患者均無系統性疾病、吸煙史和用藥史,因正畸原因拔除前磨牙或第三磨牙。所有患者對本研究知情同意。
1.2.2 細胞的原代培養和純化 拔出患者牙齒后,立即放入含雙抗的α-MEM培養液中轉移至超凈工作臺。使用含雙抗的0.01 mol/L的PBS避開近牙齦側和根尖部位,反復沖洗離體患牙至牙根潔凈,刮取根中1/3的牙周膜組織,用細滴管轉移至離心管中,加入適量3 g/L Ⅰ型膠原酶,放入細胞培養箱中每隔5 min震蕩1次,共消化15 min。終止消化反應后低速離心機800 r/min離心5 min,倒掉上清液保留底部沉淀組織。再次加入少許α-MEM,將離心管底部沉淀組織吹打均勻后接種于6孔板上,上蓋無菌蓋玻片以防止組織漂浮,加入少量α-MEM培養液覆蓋6孔板底層,將6孔板置于恒溫37 ℃ CO2孵箱,3天換培養液1次,約14 d細胞在六孔板底達到80%匯合。25 g/L胰蛋白酶1 mL孵箱內消化2 min,鏡下觀察細胞脫離貼壁呈球狀后加入等量含10%胎牛血清(FBS)的α-MEM中和胰蛋白酶消化反應,細滴管反復吹打六孔板底壁至所有細胞脫離貼壁,將含細胞的培養液轉移至離心管中以800 r/min離心8 min,棄掉上清液后加入α-MEM制備單細胞懸液,以每瓶1 000個的密度將細胞接種于10 cm培養皿中。10 d左右,低密度接種的細胞形成克隆團塊,將不同患者來源的多克隆細胞消化混合后傳至第3代,用于后續實驗。
1.2.3 流式細胞儀檢測間充質干細胞表面標記物 取上步實驗所得第3代HPDLSCs和PPDLSCs,加入PBS沖洗,胰蛋白酶消化后,低速離心機中800 r/min離心5 min,保留管底沉淀,加入適量培養液吹打均勻。調整細胞密度為每200μL 5×105個,分別加入2 μL鼠抗人CD105、CD29、CD14抗體,4 ℃條件下避光孵育1 h,用含30 mL/L胎牛血清的PBS沖洗3遍,流式細胞儀檢測CD分子的表達情況。
1.2.4 茜素紅染色檢查成骨分化能力 取第3代HPDLSCs及PPDLSCs,胰酶消化后制備成單細胞懸液,六孔板每孔接種2×105個細胞,用含10% FBS的α-MEM培養,待細胞達到80%匯合后,更換為含10% FBS的α-MEM,β-甘油磷酸鈉10 mmol/L,維生素C 50 mg/L,地塞米松100 nmol/L的成骨誘導液,每3 d更換1次成骨誘導液。21 d后棄掉成骨誘導液,PBS沖洗3遍,4%多聚甲醛固定30 min,使用PBS洗凈,加入茜素紅染液,放置于37 ℃孵箱內30 min,吸棄染液,PBS沖洗2遍,顯微鏡下拍照。
1.2.5 構建SMS加載裝置 取第3代HPDLSCs及PPDLSCs,制備單細胞懸液,以每孔3×105個的密度接種于Bioflex 6孔板,無血清饑餓培養使細胞同步化,24 h后更換10% FBS α-MEM培養基培養,運行FX-4000T軟件,設置頻率為0.1 Hz,力的種類為靜態牽張力(static mechanical strain,SMS),力值分別為 6%、8%、10%、12%和14%,加力時間為12 h[13-14]。對照組HPDLSCs及PPDLSCs以同樣密度接種于Bioflex 6孔板后不加力,放置于孵箱內靜置培養12 h,收集實驗組和對照組HPDLSCs及PPDLSCs用于后續實驗。
1.2.6 Elisa檢測炎性細胞因子分泌水平 吸棄上步實驗所得細胞的原培養液,每孔加入2 mL新鮮的α-MEM培養液,靜置24 h后收集上清液;設置8個標準孔,建立標準曲線;每孔按操作次序分別加入100 μL待檢測樣品,50 μL第一抗體,100 μL酶標抗體,100 μL底物液,50 μL終止液后,用分光光度儀在450 nm處檢測各孔吸光度。
1.3 統計學方法
所有數據以平均值±標準差表示,采用SPSS 16.0進行分析,兩對照組間比較,使用兩獨立樣本t檢驗,加力組及對照組各組間比較,使用One-way ANOVA及Bonferroni post hoc test檢驗,P<0.05為有統計學意義。
2 結 果
2.1 HPDLSCs 及 PPDLSCs 形態學觀察
倒置顯微鏡下觀察多克隆來源的 PDLSCs,均呈間充質干細胞樣的長梭形,漩渦狀密集排列,肉眼觀察HPDLSCs組和PPDLSCs組形態上無明顯差異(圖1)。
A:第3代HPDLSCs;B: 第3代PPDLSCs
2.2 流式細胞儀檢測間充質干細胞表面標記物
HPDLSCs組和PPDLSCs組均強陽性表達間充質干細胞表面標記物CD105和CD29,而造血系標記物CD14則呈陰性表達。此外,強陽性表達標記物CD105和CD29在HPDLSCs組中的表達比率均顯著高于PPDLSCs組(圖2)。
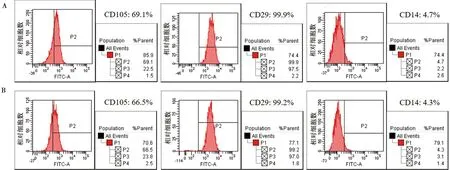
A: HPDLSCs間充質干細胞表面標記物表達情況;B: PPDLSCs間充質干細胞表面標記物表達情況
2.3 HPDLSCs 和 PPDLSCs成骨能力鑒定
21 d成骨誘導后鏡下觀察顯示PDLSCs呈復層生長,并形成散在紅色礦化結節。HPDLSCs組中礦化結節多且面積大,染色較深;PPDLSCs組中礦化結節面積小且分散,染色較淺(圖3)。
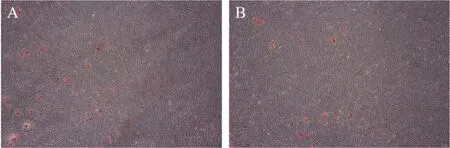
A: HPDLSCs茜素紅染色情況;B: PPDLSCs茜素紅染色情況
2.4 Elisa檢測炎性細胞因子分泌情況
PPDLSCs組中4種炎性細胞因子的表達水平均高于HPDLSCs組(P<0.05)(圖4)。牽張力加載后,HPDLSCs和PPDLSCs組中IL-1β和TNF-α的表達水平略有升高,但不同力值組間炎性細胞因子的表達無明顯差異(P<0.05)(圖4A、B);而 IL-6和IL-8 的表達水平在牽張力加載后發生了大幅上調(P<0.05)(圖4C、D),增加倍數達數百倍。同時在HPDLSCs 組,當力值低于12%時,加力組各組間IL-6和IL-8的表達水平無明顯差異,但當力值高于12%時,IL-6和IL-8的表達水平顯著上升(P<0.05)(圖4);而在 PPDLSCs 組,6%和8%的牽張力值對IL-6和IL-8表達水平的影響基本無區別,但當力值大于8%,IL-6和IL-8的表達水平會隨著力值的增大而提升(P<0.05)(圖4C、D)。
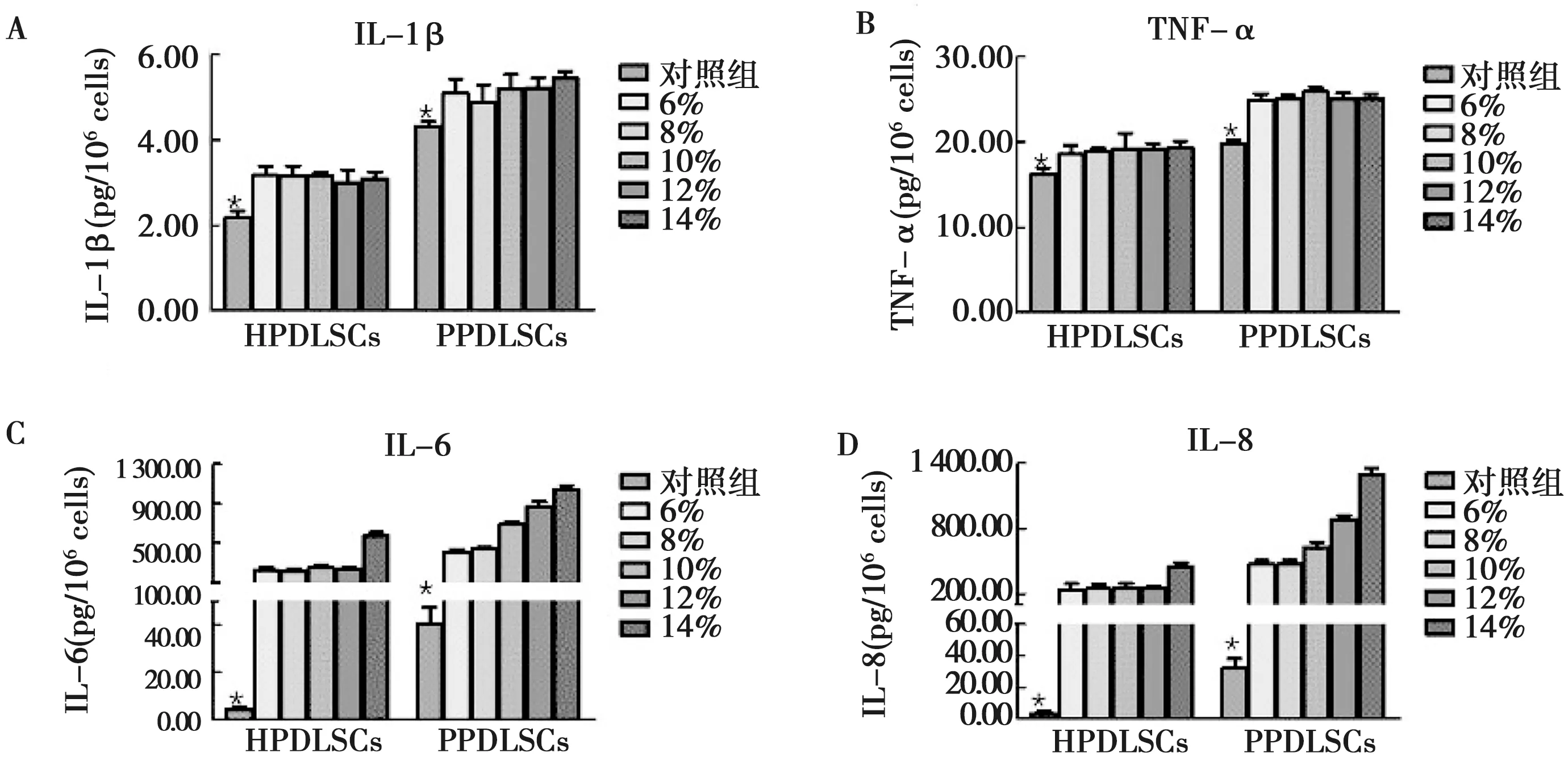
A: IL-1β的分泌水平;B: TNF-α的分泌水平;C: IL-6的分泌水平;D: IL-8的分泌水平;*: P<0.05
3 討 論
臨床上牙周炎的分級有輕度、中度和重度[15]。輕度牙周炎患者炎癥表現不明顯,不利于HPDLSCs和PPDLSCs 的生物學差異分析,而重度牙周炎患者因嚴重的牙槽骨吸收和附著喪失,牙周膜所剩無幾,很難獲得PDLSCs,因此我們選擇中度牙周炎患者作為PPDLSCs供體。已有研究表明供體年齡也會影響PDLSCs的生物學特性[16],為了控制年齡因素對實驗產生的影響,對PDLSCs供體的年齡進行篩選,確保兩組年齡間無統計學差異。
以往文獻中常采用力值為12%的SMS對PDLSCs進行機械刺激[17-18]。考慮到臨床上牙周病患者對于正畸力較健康患者更加敏感,力值偏大經常會導致牙周組織的快速吸收,本研究中假設受到牙周病微環境損害的PPDLSCs,對SMS較HPDLSCs更為敏感。同時為了觀察HPDLSCs 和PPDLSCs在較小力值和過大力值時的反應,故圍繞12%構建了力值為6%、8%、10%、12%、14%的SMS加載系統。
間充質干細胞表面標記物的表達強度在一定程度上表明間充質干細胞干性的強弱[19]。HPDLSCs和 PPDLSCs組中 CD109、 CD29 均呈強陽性表達,說明細胞來源正確。定量分析顯示, CD109、CD29 這兩種標記物在 HPDLSCs組中的表達程度均高于 PPLDSCs組,這一結果可能與間充質干細胞干性受到炎癥微環境損傷有關[20]。茜素紅染色檢驗HPDLSCs和PPDLSCs成骨分化能力的實驗結果進一步支持這一推論。
正畸牙齒的移動依賴于牙周組織吸收與形成的平衡,力加載作用下牙周組織中體液重新分布并出現局部缺氧的情況,進而引發無菌性的炎癥反應,最終導致壓力區破骨細胞的激活和張力區成骨細胞的聚集。同時正畸治療下的牙周組織改建也取決于牙周組織中的MSC正常發揮免疫調節功能[21]。文獻表明牙周組織長期處于炎癥微環境中,正常成骨破骨平衡很容易被打破,具體表現為成骨能力下降[22-23]而破骨能力增加[24],導致牙周組織喪失。炎性細胞因子過多的分泌會導致牙周組織的損害,因此為了更好的牙周改建效果應該最大程度地保持炎性細胞因子的分泌平衡,本研究從這一角度切入,重點關注 SMS 對 HPDLSCs 和 PPDLSCs 炎性細胞因子分泌的影響。根據實驗結果,對HPDLSCs 施加的力值不宜大于 12%,對 PPDLSCs 而言,牙周病的炎癥微環境使其細胞功能受損,對SMS的耐受性明顯低于HPDLSCs,若對其施加和HPDLSCs同等的力值,則會導致更多炎性細胞因子的釋放,進一步抑制其成骨能力,激活其破骨能力。本研究還發現不同的炎性細胞因子對SMS的敏感性有差異,不同級別SMS加載下,IL-1β和TNF-α的分泌量略有增加,且各組間無明顯差異,然而IL-6和IL-8的分泌量上調程度最高可達數百倍。根據實驗結果我們猜測這兩種炎性細胞因子很可能在正畸力介導下牙周組織改建的炎癥反應中發揮了重要的作用。
綜上所述,本研究發現牽張力加載下PPDLSCs中炎性細胞因子IL-1β、TNF-α、IL-6和IL-8的分泌水平相比HPDLSCs更高,其中不同力值組間IL-6和IL-8的分泌水平有較大差異,當力值大于8%時,IL-6和IL-8的分泌水平會隨著力值的增大而提升。此發現為臨床上牙周炎患者對正畸力較健康患者更敏感,更容易出現牙周組織快速吸收,提供一定的理論依據,對于牙周炎患者進行正畸治療時,要慎重選擇適宜的力值,必要時可以縮短牙周炎患者的回訪時間,及時地評估患者的牙周狀況,以便隨時更改治療計劃,防止牙周組織出現不可逆的破壞。

