牙源性干細胞來源的外泌體的研究進展
宮晟凱,孫仔昂,王 曉,蔣文凱,王 瑋
外泌體(exosomes)是細胞主動向胞外分泌的大小均一的囊泡樣小體,囊泡中包含有膽固醇、蛋白質(如各種細胞因子)及核酸(如DNA、mRNA、micro RNA)等分子[1],具有細胞間信號轉導、修復血管、免疫調節、促進骨組織修復以及腫瘤發生等[2]生理功能。不同類型的細胞均可以釋放出外泌體[3]。而間充質干細胞(mesenchymal stem cells,MSCs)分泌的外泌體由于具有與MSCs相似的生物學特性及功能,且比MSCs更穩定和易于保存受到了更多研究者的青睞[4-5]。
牙齒組織來源的MSCs均來自頭顱神經嵴細胞,其獨特的組織特異性使其和其外泌體在神經再生性疾病、牙髓牙本質再生、牙周組織再生以及其他難治性疾病方面具有潛在的優勢。牙齒組織來源的MSCs,即牙源性干細胞,主要包括牙髓干細胞(dental pulp stem cells,DPSCs)、根尖牙乳頭干細胞(apical papilla stem cells,SCAP)、脫落乳牙干細胞(stem cells from exfoliated deciduous teeth,SHED)、牙周膜干細胞(periodontal ligament stem cells, PDLSCs)、牙囊祖細胞(dental follicle progenitor cells,DFPCs)和牙齦間充質干細胞(gingival mesenchymal stem cells,GMSCs)等[6]。這些干細胞主要來自于阻生智齒、正畸拔除的前磨牙、脫落乳牙等醫療丟棄組織,取材方便,無醫源性創傷;且均具有多向分化潛能、易分離培養、核型穩定、增殖速率高等特點[5]。近年來,牙源性干細胞在組織損傷修復以及組織再生等領域的應用受到了大量的關注,但同時干細胞治療也存在一些問題如免疫排斥、干細胞遺傳物質變異、體外擴增保存不易、倫理等問題[7-8]。而外泌體既保留了MSCs的功能又避免細胞移植相關的限制和風險,具有較廣的應用價值。本文將對牙源性干細胞來源的外泌體在組織修復與再生方面的研究進展進行探討。
1 外泌體概述
外泌體是體內活細胞分泌的一種膜性小囊泡,屬于胞外囊泡(extracellular vesicles,EVs)的一種,可介導細胞相互間信息的傳遞[9]。外泌體在核內體網中形成,當多囊泡小體與胞膜融合時釋放出細胞,直徑在30~150 nm之間。研究發現不同細胞來源的外泌體具有不同的功能,其攜帶的信號分子包含脂質、蛋白質、DNA、mRNAs、miRNA以及siRNA等,均與它們存在的微環境緊密相關[10]。外泌體通過配體/受體識別,大胞飲、內吞、吞噬或直接與受體細胞胞膜融合等方式,進入到受體細胞內,并將攜帶的信號分子釋放到受體細胞中,從而觸發了受體細胞或器官中必要的分子反應[11]。外泌體在許多疾病如癌癥、免疫系統疾病、感染和心臟大血管疾病等的生理和病理過程中充當了不可忽視的角色[12-13]。
大量的證據表明外泌體參與了組織損傷修復和再生的過程,因此我們有可能利用這些天然粒子啟動復雜的生物學過程來促進組織損傷修復與再生。與運送細胞及細胞因子到達體內組織的傳統方式相比,外泌體的優勢在于[10]:首先,外泌體含有多種生理性相關因子及蛋白,可以同時激活目標組織的多種通路,有利于提高治療效果,且由于其是天然來源,故具有較好的生物相容性和穩定性;其次,外泌體不含遺傳程序,不會引起目標細胞的基因修飾或改造;再次,外泌體比較穩定,一般不會改變表型,治療結果具有可重復性和可預測性。基于以上優勢,外泌體在各個方面已嶄露頭角。外泌體可以促進血管內皮細胞增殖、遷移以及促血管化相關基因的表達和蛋白分泌,不僅可以促進新血管的形成,還可以加速它們在損傷位點的成熟[14]。同時外泌體在神經系統中也扮演著重要的角色,可以調節髓鞘形成、神經元的生長和存活以及清理病理性蛋白等[15]。另外,研究表明MSCs來源的外泌體具有抗炎和免疫調節功能,促進了巨噬細胞的極化和增殖[16]。而近年來人們發現外泌體在骨組織和牙組織再生方面也有較好的效果:研究發現人脂肪干細胞來源的外泌體錨定在PLGA支架上有效促進了骨再生[17]。MSCs來源的外泌體與脫礦骨基質支架復合有效促進了血管化和骨再生[18]。人類誘導多潛能干細胞來源的外泌體與磷酸三鈣支架復合,可通過激活PI3K/Akt通路促進成骨分化(在缺損模型中顯著促進了血管化和骨再生)[19]。牙齒的發生是由表皮-間充質間的交流以及各種生長因子共同調節完成的。外泌體在表皮-間充質間的交流中扮演著重要角色。研究表明,表皮來源的外泌體促進了MSCs的成牙分化和礦化,而MSCs來源的外泌體誘導表皮細胞產生了基底膜的復合物、釉原蛋白和成釉蛋白[20]。除了以上外泌體,牙齒組織如牙髓細胞、牙周膜細胞以及牙齒來源的MSCs也能分泌外泌體,它們在組織損傷修復及再生過程中也發揮著重要作用。
2 牙源性干細胞來源的外泌體的生物學功能
牙源性干細胞通過內分泌和/或旁分泌外泌體作用與不同類型的靶細胞進行細胞間通信,廣泛參與細胞生物學活動的調控。
2.1 促血管再生作用
牙髓作為牙齒內部唯一的軟組織,在其修復再生營養供給和疾病防御等方面起著重要的主導作用,血管生成是牙髓再生的關鍵。冼雪紅等[21]通過研究發現牙髓細胞來源的外泌體促進了血管內皮細胞的增殖、促血管形成相關因子的表達以及管腔的形成,在此過程中通過抑制p38 MAPK信號通路提高了管腔形成能力。柳鑫等[22]也發現不同濃度的人牙髓干細胞(hDPSCs)外泌體可提高內皮細胞的增殖活性,且其增殖促進作用具有濃度依賴性,可誘導內皮細胞形成管腔,這表明hDPSCs來源的外泌體可促進內皮細胞血管生成。以上均表明牙源性干細胞來源的外泌體能夠促進牙髓血管的修復再生。
2.2 免疫調節作用
巨噬細胞在炎癥環境及組織再生調控中扮演著重要的角色,其兩種亞型分別起到促炎(M1)和抗炎(M2)的作用。而促進巨噬細胞由促炎的M1型向抗炎的M2型轉化,對于實現調控組織再生顯得尤為重要。王巧云等[23]通過提取大鼠牙髓干細胞(rDPSCs)的外泌體,構建皮膚缺損模型,檢測外泌體處理的皮膚創傷組織中巨噬細胞向不同亞型極化相關因子的表達,發現外泌體能夠促進巨噬細胞向M2型極化,可能促進皮膚組織的修復再生。此外,蘇曉磊等[24]利用脂多糖(LPS)誘導大鼠急性肺損傷,并分別用LPS和LPS聯合的DPSCs外泌體處理損傷肺泡巨噬細胞,結果顯示經過高劑量DPSCs外泌體處理后的大鼠肺泡巨噬細胞內TNF-α和IL-1β表達量明顯降低,表明外泌體對LPS誘導的急性肺損傷有保護作用,其機制可能與抑制MAPK通路和激活NF-κB信號通路有關。此外,研究發現SHED來源的外泌體具有抑制急性期炎癥反應的作用,且可以保護多巴胺能神經元免受氧化應激引起的凋亡,對如炎癥和氧化應激等病理過程具有保護意義[25-26]。同時,王孟宏等[27]研究發現SHED來源的外泌體miR-100-5p能夠抑制哺乳動物雷帕霉素靶蛋白(mTOR),緩解顳下頜關節骨關節炎,抑制髁突軟骨細胞的炎癥反應,而且SHED來源的外泌體可以通過移動小膠質細胞極化來減少神經炎癥,可改善大鼠運動功能恢復,減少皮質損傷[28]。Zheng等[29]也發現PDLSCs來源的外泌體能通過Th17/Treg/miR-155-5p/SIRT1調節作用減輕炎癥微環境網絡,能最大限度地控制多個下游損傷信號因子,可能為牙周炎治療尋找新的靶點。外泌體由于通過誘導細胞分泌抗炎細胞因子和促進M2巨噬細胞的形成,因而被認為是MSCs免疫調節作用的驅動力[30-31]。
2.3 促成牙分化作用
施萬(Schwann)細胞是成牙本質細胞的主要來源。Li等[32]發現來自hDPSCs的外泌體,特別是來自LPS預處理的hDPSCs,可以促進Schwann細胞的增殖,遷移和牙源性分化,它們可以遷移到損傷部位,并在牙齒發育和再生過程中分化為成牙本質細胞。Hu等[33]通過研究DPSCs來源的外泌體的micro RNA表達譜,表明了在成牙分化誘導條件下分離的DPSCs來源的外泌體是誘導DPSCs分化的較好誘導因子。同時,Huang等[34]研究發現,成牙分化誘導條件下牙髓細胞來源的外泌體更好地促進了DPSCs和骨髓間充質干細胞的成牙分化,當其與DPSCs復合后在體內牙齒切片上促進了牙髓樣組織再生。此外,蔣歡[35]也證明了SCAP來源的外泌體能夠被大鼠的骨髓間充質干細胞內吞,促進其向成牙本質分化和礦化結節的形成。Ivica等[36]研究發現牙髓細胞來源的外泌體能促進人骨髓間充質干細胞的遷移與增殖,且此外泌體可在纖維蛋白水凝膠中實現有效緩釋,為通過以干細胞歸巢的方式實現無髓牙齒牙髓再生提供新的技術支持。綜上所述,牙源性干細胞來源的外泌體在促進細胞的遷移和成牙分化方面具有重要價值。
2.4 促進骨損傷修復
口腔頜面部是人體的重要器官,牙槽骨因感染、外傷等原因造成的缺損是口腔頜面部常見的疾病之一[37]。外泌體在生理和病理條件下對骨重建有很好的作用,另外,PDLSCs與骨損傷修復也存在著密不可分的關系,在牙周組織再生中具有重要作用[38]。Chew等[39]發現,MSCs外泌體載膠原蛋白海綿有效地修復了缺損促進了牙周組織的骨和牙周膜再生,推測MSCs來源的外泌體可通過增加細胞的運動和增殖來促進牙周組織再生。費棟棟[40]也證實PDLSCs內部不同細胞存在成骨異質性,其外泌體在介導細胞成骨分化中具有重要作用。
2.5 治療神經退行性病變

2.6 其他方面
口腔內的傷口愈合速度會比其他部位的傷口愈合速度要快,牙齦組織的修復速度大約是皮膚損傷修復速度的兩倍,其中很重要的原因之一就是GMSCs,而外泌體作為旁分泌的主要成分,傳遞信息物質、參與細胞間通訊,在GMSCs發揮修復作用的過程中具有重要的作用。時權等[42]研究發現,GMSCs來源的外泌體聯合殼聚糖/絲素蛋白凝膠海綿能有效促進糖尿病皮膚創面的修復。同時,Zhang等[43]研究發現GMSCs及其外泌體與小腸黏膜下-細胞外基質(SIS-ECM)或其外泌體的聯合移植能夠促進舌乳頭的恢復、味蕾再生和神經支配,為舌癌患者術后的舌重建提供了可能。此外,牙源性干細胞來源的外泌體在抗腫瘤方面也發揮著重要作用。Stanko等[4]發現用氧化鐵納米粒子標記DPSCs能夠維持體內腫瘤的趨化性,且由自殺基因yCD:UPRT導入的DP-MSCs釋放的外泌體能夠很容易穿透整合人類的腫瘤細胞,在前藥5-氟胞嘧啶的存在下,誘導腫瘤細胞凋亡。
3 總 結
外泌體是由各種細胞分泌的一種直徑為30~150 nm、由脂質雙分子層包裹的微囊泡結構,富含多種生物分子、生物蛋白和核酸。外泌體可通過旁分泌或內分泌方式作用于靶細胞,實現其生物學功能。其具有免疫調節作用,具備“促炎和抗炎”的雙重功能,是組織損傷修復不可或缺的因子[44];且可以介導細胞間信息傳遞及特殊功能的分子轉移,對于促組織修復再生具有重要作用[45-46],近年來的研究表明外泌體可能是一種很有前景的干細胞替代物,可能成為“無細胞治療”的有效手段[34,47-48],具有廣闊的臨床應用前景。
牙源性干細胞由于取材方便,易于培養,且具有神經源性等優勢,使其外泌體在組織損傷修復與組織再生領域成為潛在的優勢資源。文中引用的多項研究表明,牙源性干細胞來源的外泌體在血管再生、免疫調節、成牙分化、骨損傷修復、治療神經退行性病變以及皮膚、味蕾再生、腫瘤治療等方面均已取得較好的療效(圖1)。根據現有的研究,來源于牙齒不同部位的干細胞分泌的外泌體都有其獨特的功能,比如DPSCs來源的外泌體功能更多體現在血管再生、免疫調節以及治療神經退行性疾病方面,而PDLSCs來源的外泌體功能則更多體現在牙周膜和骨組織再生方面,這與其來源的干細胞的生物學特性是緊密相關的。當然目前對于牙源性干細胞來源外泌體的研究仍處于早期階段,研究也僅限于對于每種外泌體單一功能的研究,尚沒有在各個領域進行系列研究,因此還有許多未知的領域等待我們探索和發現。
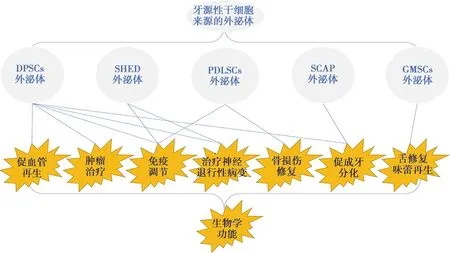
圖1 牙源性干細胞來源的外泌體的生物學功能
目前,關于外泌體的研究仍存在一些問題:①外泌體的提取和鑒定尚無明確統一的標準,提取方法并不能保證在足夠產量的前提下得到較高純度的外泌體,仍需改進提取方法或開發新的方法;②外泌體在組織損傷修復以及再生過程中的潛在作用機制仍不清楚,其中哪些成分參與了此過程并發揮作用仍需研究;③在組織再生領域,外泌體到達目標組織會出現大量的流失,無法達到有效作用濃度,如何實現外泌體的有效緩釋并研究其作用于目標組織的有效濃度仍是亟待解決的問題。

