丙酮酸乙酯通過Nrf2途徑抑制谷氨酸對大鼠小腦顆粒神經元的毒性作用*
歐陽穎,曾愛紅,張羚枚,周瑞瑜,唐淑敏,阮揚皓,李伍鳳
(中山大學孫逸仙紀念醫院兒科,廣東廣州 510120)
新生兒缺氧缺血性腦病(hypoxic-ischemic en?cephalopathy,HIE)是新生兒窒息后的嚴重并發癥,是引起智能落后、癲癇、共濟失調和腦性癱瘓[1]的主要原因之一。據報道,近10年來HIE的發病率大約在(2~3)/1 000 例活產新生兒[2-3]。到目前為止,國內外對新生兒缺氧缺血性腦病的治療,主要包括支持治療和對癥治療,但均對已有的腦損傷無作用。因此,尋找更為有效的治療方法成為當前急需解決的問題。
HIE 是圍產期新生兒缺氧、缺血引起的腦部病變,在大多數情況下,缺氧和缺血同時發生,但缺血對中樞神經系統損傷更大。缺氧缺血性腦病發病機理極為復雜,現階段普遍認為HIE 是代謝障礙、酸中毒、興奮性氨基酸的毒性作用、細胞內鈣超載、氧化應激反應、炎癥反應等一系列病理作用的結果[4-6]。因此,明確HIE 的發病機制、尋找高效且副作用少的治療方法具有重要的意義。
丙酮酸乙酯(ethyl pyruvate,EP)是丙酮酸的酯化物,是一種化學性能穩定、親脂性的小分子化合物,能迅速穿過細胞膜和線粒體[7]。EP 的主要藥理作用包括提供能量代謝物,保護細胞免受氧化產物和自由基的侵害,抑制炎癥反應[8-11]。有報道稱EP通過核因子E2 相關因子2(nuclear factor E2-related factor 2,Nrf2)/抗氧化反應元件(antioxidant response element,ARE)/血紅素加氧酶1(heme oxygenase-1,HO-1)通路激活內源性抗氧化系統[10]。此外,EP 還通過與P65[11]相互作用抑制NF-κB的活性,降低早期腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)和白細胞介素6(interleukin-6,IL-6)等炎癥因子的表達,下調[12]晚期HMGB1的合成和釋放。因此,EP 有望通過逆轉HIE 的病理過程,發揮更大的神經保護作用。研究EP 作用下體外培養新生大鼠顆粒神經元Nrf2/ARE/HO-1 信號通路的激活狀態并探討其機制,將為HIE未來臨床治療提供參考資料。
材料和方法
1 主要試劑
基礎細胞培養液和新生小牛血清購自Gibco BRL;胰酶、脫氧核糖核酸酶、胰酶抑制劑、阿糖胞苷、核糖核酸酶、谷氨酸(glutamate,Glu)、多聚賴氨酸、二乙酸熒光素(fluorescein diacetate,FDA)、碘化丙 啶(propidium iodide,PI)、Hoechst 33258、EP 和MK-801 均購自Sigma;硫酸慶大霉素購自福建三明制藥廠;Triton X-100和氯仿購自Merck;飽和重蒸酚溶液購自中山大學醫學院藥理實驗室;細胞核蛋白與細胞質蛋白提取試劑盒購自寧波唯奧公司;H2-DCF-DA 購自Invitrogen;抗Nrf2 和HO-1 抗體購自Stressgen;MTT 購自Sigma-Aldrich;二氫乙啶(dihy?droethidium,DHE)和4%多聚甲醛購自Sigma。
2 小腦顆粒神經元培養
按文獻方法[13],取新生7 d 的Sprague-Dawley(SD)大鼠,雌雄不拘,在無菌條件下斷頭、開顱,取小腦,放在解剖液[10×Krebs 緩沖液(NaCl 72.5 g,KCl 4.0 g,NaH2PO41.4 g,右旋糖26 g,苯酚紅100 mg,EP 59.6 g/L,pH 7.4)15 mL,白蛋白0.45 g,3.82%MgSO41.2 mL,pH 7.4]中,顯微鏡下去除血管和腦膜。然后用眼科剪剪成1 mm×1 mm×1 mm 大小的組織塊,胰酶(0.25 g/L)消化(37℃,15 min),立即加反應終止液I(含胰酶抑制劑0.52 g/L、DNase-I 0.08 mg/L和Mg2+3 mmol/L 的解剖液)混勻、離心、棄上層,沉淀加反應終止液II(含Mg2+3 mmol/L 和Ca2+100 μmol/L 的解剖液)2 mL 反復吹打,離心(319×g,30 s),去除未消化的組織,細胞懸液再離心(958×g,5 min),棄上層,細胞沉淀以完全培養液(BME,25 mmol/L KCl,谷氨酰胺20 mmol/L,10%胎牛血清,0.1 g/L 硫酸慶大霉素)分散,按(1.5~1.8)×109/L 種植在預先鋪有多聚賴氨酸(5 mg/L)的培養板或培養皿中,細胞數為(2~3)×106/cm2。然后置于CO2培養箱中(37℃,5% CO2)培養。24 h 后,加阿糖胞苷(終濃度為10 μmol/L)。7 d 后,加葡萄糖(終濃度為5 mmol/L)。以后每隔4 d 按前法加一次葡萄糖。7 d后,神經元分化成熟。
3 Glu興奮性模型建立與實驗分組
將體外培養7 d 的小腦顆粒神經元隨機分為:(1)空白對照(control)組;(2)Glu 組[參考文獻[13],棄去培養液,加入Locke 溶液(含154 mmol/L NaCl,5.6 mmol/L KCl,3.6 mmol/L NaHCO3,2.3 mmol/L CaCl2,5.6 mmol/L glucose,10 mmol/L HEPES,pH 7.4)和1 mol/L 甘氨酸,以充分激活NMDA 敏感的Glu 識別位點,Glu 濃度為100 μmol/L,30 min 后換成普通的完全培養液];(3)Glu+EP 組[在(2)組基礎上加入不同濃度(0.1、0.5、1、2.5 和5 mmol/L)的EP。每組有8個復孔。
4 主要方法
4.1 FDA/PI 熒光染色 用FDA 和PI 分別對活細胞和死細胞進行染色。將待處理的細胞,棄培養液后,以含糖的PBS 洗1 遍,加入FDA(10 mg/L)和PI(4 mg/L),于暗室37℃孵育5 min,棄染液后以含糖的PBS 洗2 遍,熒光顯微鏡下拍照,每組隨機選3 個視野拍照。與正常對照組比較,計算存活率。細胞存活率(%)=各處理組的活細胞數/正常對照組的活細胞數×100%。
4.2 MTT 實驗 取培養7 d 的小腦顆粒細胞,在給藥相應時間后,加入新鮮配制的MTT(溶于PBS,5 g/L)20 μL,將細胞置于含5%CO2、37℃的培養箱中孵育4~6 h后去除培養液,加入二甲基亞砜溶解結晶體,待結晶體完全溶解后,在酶標儀上(測定波長570 nm,參考波長630 nm)測吸光度(A),細胞存活率(%)=A處理組/A對照組×100%。
4.3 細胞內游離鈣濃度(intracellular free calcium concentration,[Ca2+]i)的測定 用培養第7 d 的細胞,經5 μmol/L的Fluo-3/AM負載60 min,用Hanks液洗滌3次,放在倒置熒光顯微鏡下,由自動灌洗儀持續灌流緩沖液。應用激光掃描共聚焦顯微鏡觀察細胞內Fluo-3 的熒光強度(激發波長488 nm,發射波長526 nm),每組選取20個活細胞,每個細胞間隔2 s掃描1 次,共掃描16 次,記錄16 個熒光強度數值,取平均值為該細胞的熒光強度。根據公式計算:[Ca2+]i=Kd(F?Fmin)/(Fmax?F),Kd為Fluo3 與Ca2+反應的解離常數,在室溫下為400 nmol/L;F 為實驗記錄到的熒光強度值;Fmax為最大熒光值,加入5 mmol/L CaCl2的EGTA 溶液所測得的值;Fmin為最小熒光值,由在無Ca2+緩沖液中加入10 mmol/L EGTA測得。
4.4 H2-DCF-DA 檢測 ROS 在Glu 模型作用后90 min,棄去培養液,使用PBS 清洗3 次后,加入終濃度為30 μmol/L 的H2-DCF-DA,在37℃培養箱中孵育20 min,用PBS清洗1次,迅速置于熒光酶標儀檢測熒光強度,激發及吸收波長采用475 nm/525 nm。
4.5 DHE 檢測超氧陰離子 在Glu 模型作用后90 min,棄去培養液,使用PBS 清洗3 次后,加入終濃度為10 μmol/L 的DHE,在37℃培養箱中孵育30 min,用PBS清洗1次,迅速置于多功能熒光酶標儀檢測熒光強度,激發及吸收波長采用485 nm/535 nm。
4.6 Western blot 根據試劑盒說明,提取細胞核蛋白與細胞質蛋白,于?80℃保存,后與DTT 混合、煮沸、離心,使蛋白質變性,取上清20 μL 于200 V 進行SDS-PAGE 45 min;取出硝酸纖維膜,浸入TBS+TBST+5%脫脂奶粉溶液,室溫封閉2 h,在10 mL I 抗稀釋液中把NC 膜和I抗共同輕搖孵育,4℃過夜。第2天,用1×TBST 洗NC 膜3次(每次15 mL,5 min),把NC 膜與溶解在10 mL 封閉液中的與HRP 結合的Ⅱ抗(適當比例稀釋)和HRP 結合的抗生物素抗體(1∶1 000)室溫下共同孵育1 h;用1×TBST 洗NC 膜3 次(每次15 mL,5 min),與10 mL 1× LumiGLO(含0.5 mL 20×底物B和9.0 mL水)室溫下輕搖1 min。排去過量的液體,在暗室中使其與X 光片在增感屏中緊密接觸,使X 光片感光數秒到數分鐘。顯影,定影,沖洗,晾干,拍照并進行計算機圖像分析。
4.7 免疫組化 細胞用PBS 溶液洗2 次,后用4%多聚甲醛固定在室溫下30 min。然后再用PBS 洗2次,通過0.5% Triton X-100 在室溫下孵化15 min。10%的細胞封鎖在山羊血清,室溫1 h。4℃孵育過夜。PBS 洗滌3 次,室溫下用稀釋的熒光抗體孵育1.5 h。室溫下用Hoechst 33258 染色細胞核15 min,PBS洗滌3次后,激光共聚焦顯微鏡成像。
4.8 ARE誘導轉錄活性檢測 用Promega公司雙螢光素酶報告基因試劑盒檢測熒光強度。所有的程序都是按照制造商的指示進行的。pGL6-ARE-Luc 質粒是基于pGL6 載體構建,ARE 序列為3 個串聯的CACCGTGACTCAGCAATT,并在我們的實驗中進行。誘導轉錄活性增加倍數=(藥物誘導的螢火蟲螢光素酶活性/藥物誘導的海腎螢光素酶活性)/(對照組誘導的螢火蟲螢光素酶活性/對照組誘導的海腎螢光素酶活性)。
5 統計學處理
用SPSS 16.0 統計軟件進行分析。以上實驗均重復3次,數據均采用均數±標準差(mean±SD)表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD法。以P<0.05為差異有統計學意義。
3.3.1 加強電力需求側管理。在現有用戶負荷管理范圍內,選取部分可中斷負荷,建設毫秒級精準負荷控制系統,優化升級現有負荷管理系統。應用大數據平臺,試點對用戶用電行為開展實時分析,進一步挖掘其在用電預測、錯峰調度等方面潛力,促進供需互動。
結 果
1 EP對小腦顆粒神經元的保護作用
如圖1 所示,EP 對原代培養神經元Glu 興奮性毒性的抑制作用呈劑量依賴性。100 μmol/L Glu 對原代培養的小腦顆粒神經元有明顯的損傷作用,表現為細胞數量減少,細胞體積異常,軸突/樹突斷裂和消失。FDA/PI雙染色下可見正常組絕大部分細胞染成綠色,夾雜著少許紅染的細胞,Glu 組則綠染細胞減少,而紅色的死細胞明顯增多。1 mmol/L EP 預處理30 min 后,Glu 誘導損傷下存活神經元數量顯著增加(P<0.05),EP以濃度依賴性的方式顯著提高了神經元的活力。
2 細胞內ROS檢測結果
我們通過H2-DCF-DA 檢測小腦顆粒神經元的ROS 含量,用DHE 檢測超氧陰離子含量。H2-DCFDA 染色后,含ROS 的細胞發綠色熒光,ROS 越多,熒光強度越大。與正常對照組少量的綠色熒光細胞相比,Glu 組可見到綠色熒光細胞明顯增多,熒光強度大;而Glu+EP 組則綠色熒光細胞明顯減少,熒光強度明顯減弱,見圖2。DHE 染色后,含超氧陰離子的細胞與DHE 作用而發出紅色熒光,超氧陰離子越多,熒光強度越大。與正常對照組少量紅色熒光細胞相比,Glu 組可見紅色熒光細胞明顯增多,熒光強度增大;而Glu+EP 組則紅色熒光細胞明顯減少,熒光強度較弱,見圖2。
3 小腦顆粒神經元[Ca2+]i檢測結果
我們通過Fluo-3 作為指標檢測細胞內Ca2+。在小腦顆粒神經元中,加入Glu,動態觀察[Ca2+]i水平,20 s 即可觀察到熒光強度迅速升高,達到高峰,隨時間延長逐漸降低,但6 min 時仍顯著高于正常;加入EP(2.5 和5.0 mmol/L)預處理30 min 可以部分阻滯[Ca2+]i升高(P<0.05),見圖3。
4 EP通過激活Nrf2/ARE/HO-1通路發揮神經保護作用
通過檢測EP 處理神經元中Nrf-2 的表達,觀察到EP 組中細胞質Nrf2 表達下降,細胞核Nrf2 表達明顯上調,見圖4A。之后,在Nrf2 免疫組化染色后加入Hoechst 染色,在激光共聚焦顯微鏡下觀察,正常對照組細胞漿染成紅色,核染成藍色,而EP 組中細胞質染成紅色,細胞核內因Nrf2明顯升高,核亦染成紅色,同時在Hoechst 染色后呈藍色,融合后核呈紅色,提示Nrf2 轉入核內,見圖4B。在檢測ARE 的轉錄活性實驗中,EP 組ARE 的轉錄活性顯著上調(P<0.05),見圖4C。如圖4D 所示,Glu 或EP 處理3 h、6 h 和12 h 均顯著提高HO-1 的表達水平(P<0.05),且Glu 和EP 共處理進一步增加了HO-1 的表達。相反,HO-1 抑制劑鋅原卟啉(zinc protoporphyrin,ZnPP)部分抑制了EP的神經保護作用,見圖4E。
討 論
1 Glu對體外培養小腦顆粒神經元的毒性作用
本實驗中,小腦顆粒神經元在Glu作用后24 h存活率為(28.4±2.1)%,與文獻結果相符[14]。DNA 電泳未出現梯形條帶,呈涂布狀,提示主要的死亡方式為壞死。另一研究[15]的結果則不同,在沒有甘氨酸存在及無鎂離子的Locke 液的情況下,Glu 的毒性濃度選擇為300 μmol/L,但細胞存活率仍高于本實驗模型。因此,同樣為Glu模型,濃度不同,處理方式不同,細胞死亡的方式不同,Glu 引起細胞死亡所激活的通路可能不同。
2 EP對小腦顆粒神經元的保護作用
EP 具有組織能量守恒、抗炎、抗氧化等藥理作用[16],可減輕體內的全身炎癥反應和多臟器功能障礙[17]。有研究稱EP 可以治療重癥急性胰腺炎(se?vere acute pancreatitis,SAP),減輕SAP 相關的遠端器官損傷,如肝、肺和腎[18-19]。此外,EP 能減輕外傷性腦損傷和出血性腦損傷[20]。
在本研究中,EP在濃度0.1~5 mmol/L時劑量依賴性地抑制Glu 的興奮性毒性作用,充分說明EP 具有神經保護作用,可能為一種在中樞神經系統疾病中有應用前景的藥物。
3 細胞內ROS檢測結果
4 EP抑制細胞內鈣升高
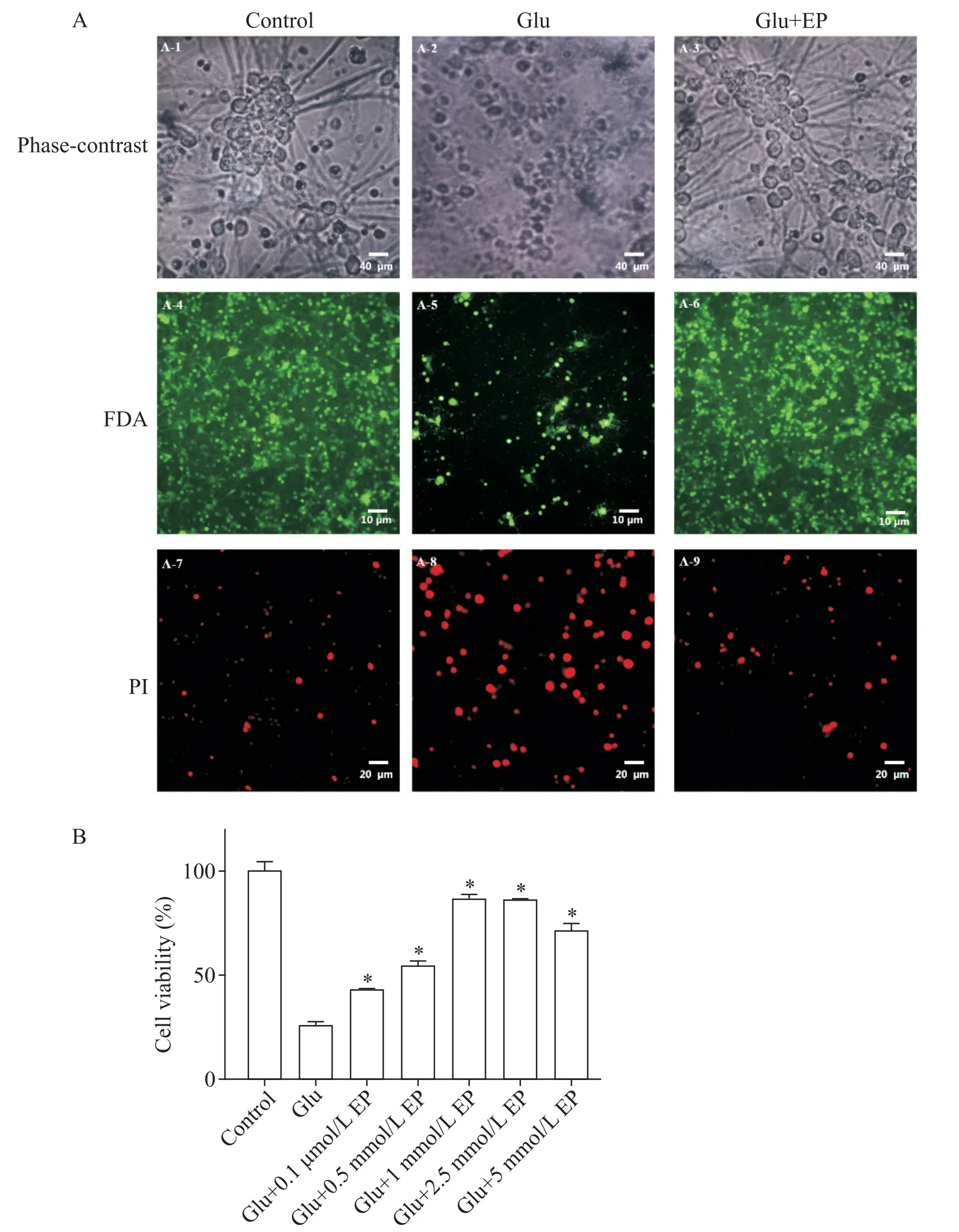
Figure 1.Protective effect of ethyl pyruvate(EP)on rat cerebellar granule neurons.A-1:normal cerebellar granule neurons,scale bar=40 μm;A-2:cerebellar granule neurons treated with 100 μmol/L glutamate(Glu)for 24 h,scale bar=40 μm;A-3:cerebellar granule neurons treated with Glu(100 μmol/L)+EP(2.5 mmol/L)for 24 h,scale bar=40 μm;A-4:normal cer?ebellar granule neurons,FDA staining,scale bar=10 μm;A-5:cerebellar granule neurons treated with Glu(100 μmol/L)for 24 h,FDA staining,scale bar=10 μm;A-6:cerebellar granule neurons treated with Glu(100 μmol/L)+EP(2.5 mmol/L)for 24 h,FDA staining,scale bar=10 μm;A-7:normal cerebellar granule neurons,PI staining,scale bar=20 μm;A-8:cerebellar granule neurons treated with Glu(100 μmol/L)for 24 h,PI staining,scale bar=20 μm;A-9:cerebellar granule neurons treated with Glu(100 μmol/L)+EP(2.5 mmol/L)for 24 h,PI staining,scale bar=20 μm.B:the effect of EP(0.1~5 mmol/L)on the viability of Glu(100 μmol/L)-induced cerebellar granule neurons.Mean±SD. n=3.*P<0.05 vs Glu group.圖1 丙酮酸乙酯對大鼠小腦顆粒神經元的保護作用
正常情況下,細胞內的鈣濃度為100 nmol/L,比細胞外的鈣低10 000倍。細胞間隙高濃度的Glu,可引起N-甲基-D 天冬氨酸受體過度興奮,Ca2+大量內流,[Ca2+]i短暫升高;經過一段時間之后,出現第2次鈣離子升高,稱之為延遲性鈣失調,為不可逆損傷,導致細胞死亡。[Ca2+]i過高可聚集在線粒體內,損傷氧化磷酸化通道,造成ATP 不足;另一方面,Ca2+與鈣調素形成復合物,激活多種蛋白酶,引起廣泛的信號傳導分子磷酸化,而產生各種細胞效應;同時促進氧自由基產生,故細胞內鈣超載被認為是細胞死亡的最后通路[22]。
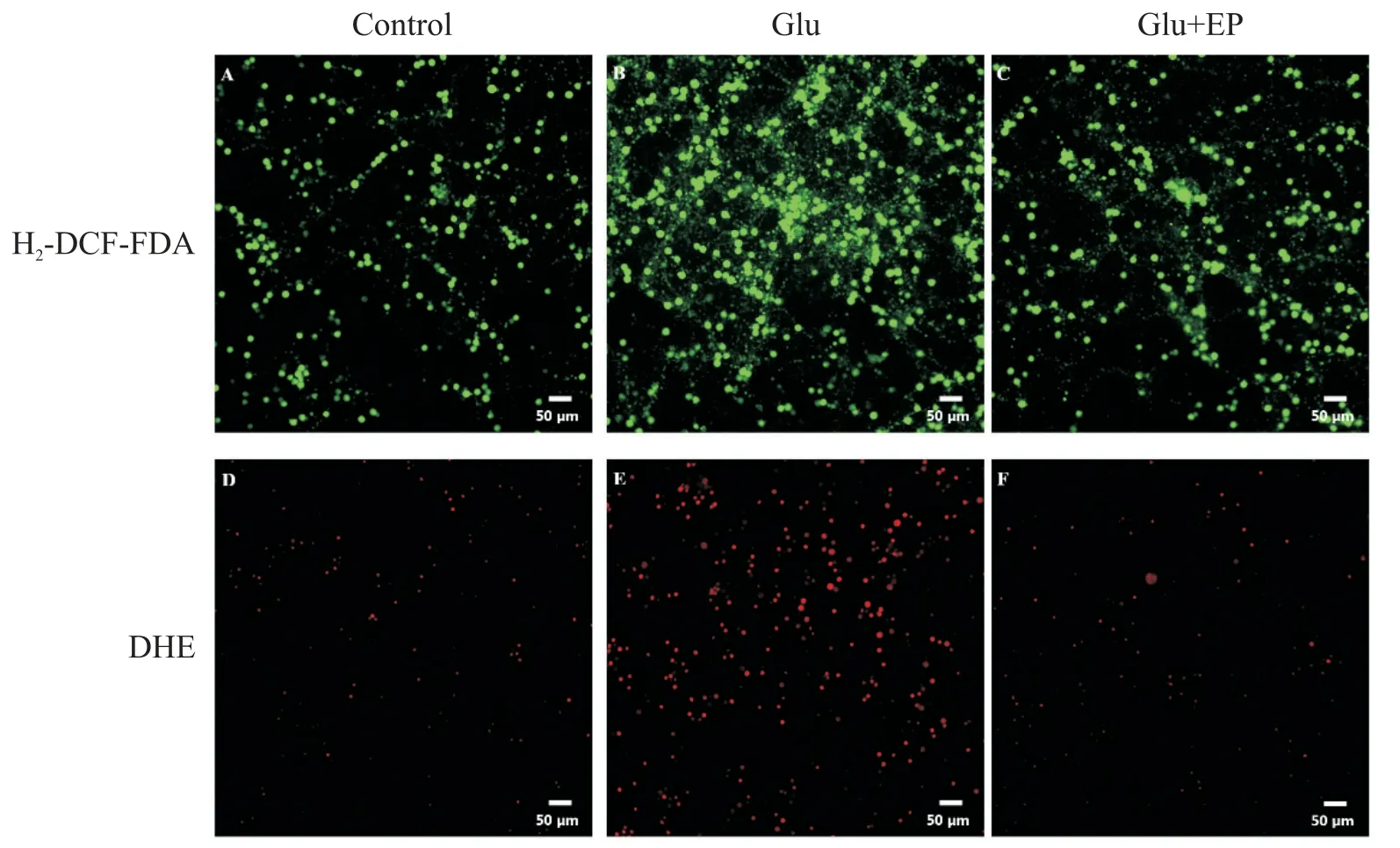
Figure 2.Detection of ROS in rat cerebellar granule neurons.A:control group,H2-DCF-DA staining;B:glutamate(Glu;100 μmol/L)group,H2-DCF-DA staining;C:Glu(100 μmol/L)+ethyl pyruvate(EP;2.5 mmol/L)group,H2-DCF-DA stain?ing;D:control group,DHE staining;E:Glu(100 μmol/L)group,DHE staining;F:Glu(100 μmol/L)+EP(2.5 mmol/L)group,DHE staining.Scale bar=50 μm.圖2 大鼠小腦顆粒神經元內ROS檢測結果
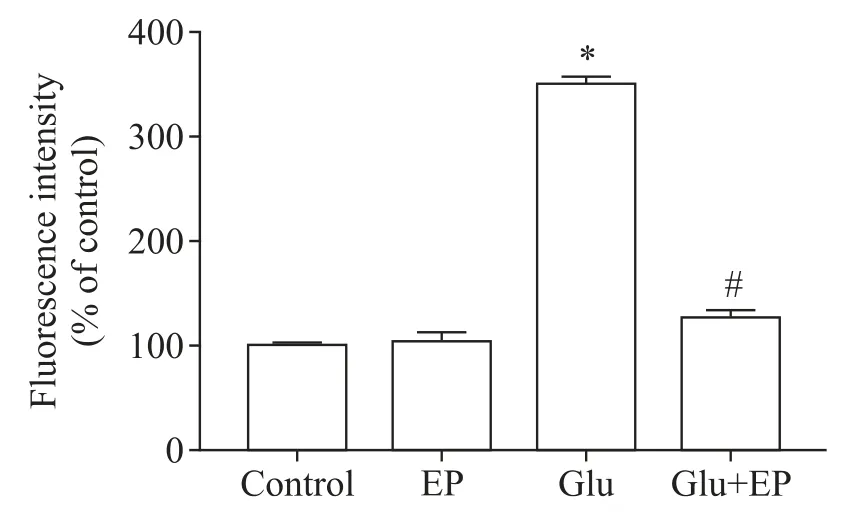
Figure 3.Detection of[Ca2+]i in rat cerebellar granule neurons.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs Glu group.圖3 大鼠小腦顆粒神經元[Ca2+]i檢測結果
本實驗中,Glu 組細胞內鈣在20 s 左右迅速升高,持續6 min 以上。而EP+Glu 組細胞內鈣較正常組升高,但顯著低于Glu組,提示EP通過抑制細胞內鈣離子濃度升高,阻斷了引起神經元損傷的上游通路。因此,抑制[Ca2+]i的升高在EP 的神經保護作用中起到很重要的作用。
5 EP 通過激活Nrf2/ARE 通路而發揮神經保護作用
Nrf2-ARE信號通路被認為是一種新型的抗氧化信號通路,以Nrf2為核心,激活一些保護性的酶的產生,如HO-1、超氧化物歧化酶及還原型谷胱甘肽;HO-1 及還原型谷胱甘肽可抑制細胞凋亡,抗氧化,緩解細胞內鈣離子超載[23]。在顱腦外傷、顱內出血和腦缺血梗死動物模型中均有Nrf2-ARE 信號通路激活。有研究顯示,移植Nrf2 過度表達的星形膠質細胞至紋狀體可減輕丙二酸誘導的細胞損害[24];應用小干擾RNA 降低Nrf2 的表達,可引起NO 誘導的神經細胞瘤細胞的凋亡增多[25]。
本實驗結果顯示,在EP 處理組,Nrf2 轉運入核中,12 h 核內Nrf2 仍升高。免疫組化染色顯示核內Nrf2 明顯增多,ARE 介導的熒光素酶轉錄活性升高,提示EP 激活Nrf2/ARE 通路,使ARE 轉錄活性增高。同時,Glu 引起HO-1 升高,證明Glu 的氧化性損傷也可引起HO-1 升高,但12 h 即下降,說明Glu 激發的HO-1 升高所起到的保護作用有限,而EP 可引起正常小腦顆粒細胞內HO-1升高,與Glu一起,協同誘導HO-1升高,可發揮較強的抗氧化損傷作用。ZnPP部分阻滯EP 的保護作用,則說明HO-1 的保護作用是確切的。因此,EP 是通過激活Nrf2/ARE/HO-1 通路而起到保護作用。
綜上所述,我們的研究為EP 在體外對大鼠小腦顆粒神經元Glu 興奮性神經毒性的保護作用提供了實驗依據。EP 的作用機制包括抗氧化、減輕腦水腫、抑制細胞凋亡,而在HIE 發病過程中,Glu 興奮性毒性是腦損傷的主要環節,因此我們推斷EP 可能在HIE神經保護治療方面具有廣闊的應用前景。
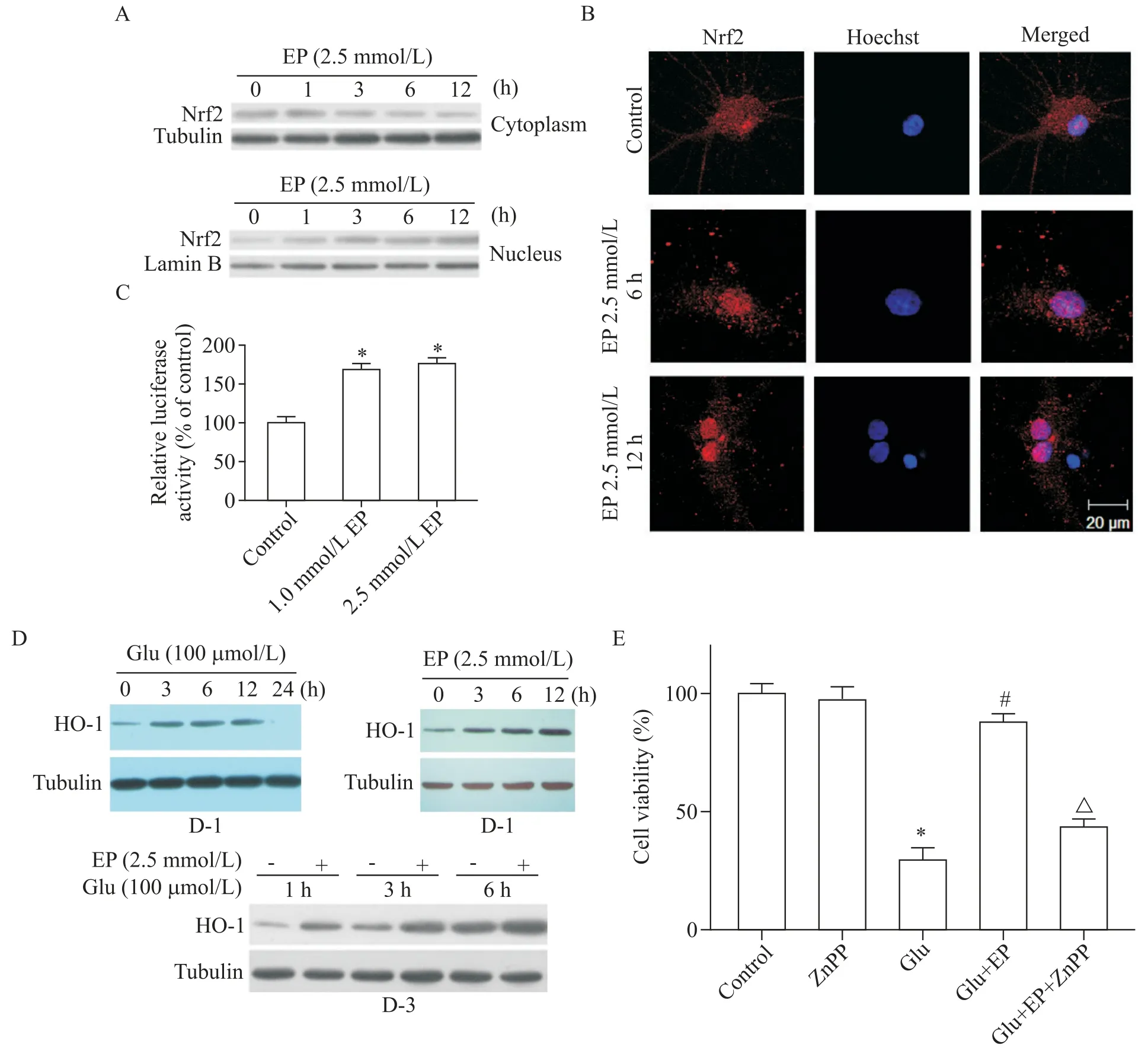
Figure 4.The expression of Nrf2/ARE/HO-1 pathway-related proteins in rat cerebellar granule neurons.A:ethyl pyruvate(EP;2.5 mmol/L)decreased cytoplasmic Nrf2,but increased nuclear Nrf2;B:cytoplasmic Nrf2 was translocated into the nucleus after treatment with 2.5 mmol/L EP for 6 and 12 h(scale bar=20 μm);C:EP elevated the relative luciferase activity in?duced by ARE;D-1:the expression of HO-1 after treatment with 100 μmol/L glutamate(Glu)for 0,3,6,12 and 24 h;D-2:the expression of HO-1 after treatment with 2.5 mmol/L EP for 0,3,6 and 12 h;D-3:the expression of HO-1 after treatment with 2.5 mmol/L EP+100 μmol/L Glu for 1,3 and 6 h;E:ZnPP partly inhibited the protective effect of EP against Glu excitotoxicity.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs Glu group;△P<0.05 vs Glu+EP group.圖4 大鼠小腦顆粒神經元內Nrf2/ARE/HO-1通路相關蛋白表達的檢測結果

