人卵巢壁層顆粒細胞和卵丘細胞體外分離及原代培養的比較*
朱潔茹,歐建平△,李 濤,朱偉杰
(1中山大學附屬第三醫院生殖醫學中心,廣東廣州 510630;2暨南大學生命科學技術學院,廣東廣州 510632)
當卵泡的竇腔形成后,顆粒細胞分化成兩種細胞亞群,分別為圍繞卵泡壁的壁層顆粒細胞(mural granulosa cells,MGCs)和附著于卵母細胞的卵丘細胞(cumuluscells,CCs)[1]。MGCs 含有多種激素受體,以自分泌和旁分泌的形式調控卵泡發育、成熟與甾體激素合成[2],常用作研究卵巢功能的細胞體外模型。目前人MGCs 主要從取卵術廢棄的卵泡液中獲取[3],來源易得,但從卵泡液中分離MGCs 需要多次離心等處理,且卵泡液中的MGCs混雜較多紅細胞和其它雜質,干擾因素多。因此,應充分闡明MGCs的細胞體外狀態,建立合適卵巢功能研究的細胞模型。
CCs是圍繞著卵母細胞生長的顆粒細胞層,與卵母細胞形成一個相輔相成的“合胞體”,為卵母細胞提供營養,調節減數分裂的恢復,影響精卵結合和早期胚胎發育[4]。在取卵術中,卵丘卵母細胞復合物被抽吸出來,隨后按體外受精(in vitro fertilization,IVF)或單精子卵胞漿內注射(intracytoplasmic sperm injection,ICSI)的需要,一部分CCs 被切割而丟棄。這部分CCs 的獲取過程簡單,且沒有過多的其它雜質,紅細胞污染少,從理論上而言,CCs是研究卵巢功能的合適細胞體外模型。但對CCs 細胞模型的實驗方法學,以及與MGCs 細胞模型的比較仍需充分評價。
自噬和凋亡是細胞在應對環境變化時的兩種方式[5-6],可以反映細胞的活性狀態。本項工作比較人MGCs 與CCs 體外分離及原代培養的效果,并檢測自噬和凋亡相關基因的表達來分析分離后的細胞特性,以期為深入認識MGCs 與CCs 的細胞體外狀態、建立卵巢功能研究的細胞模型提供參考資料。
材料和方法
1 顆粒細胞來源
選取16 例于中山大學附屬第三醫院生殖醫學中心行IVF/ICSI患者取卵日的卵泡液及其卵丘-卵母細胞復合物(223 個),所收集標本均為醫療廢物,由常規治療過程產生,標本獲取不影響患者的治療。所有患者均簽署知情同意書,本研究經中山大學附屬第三醫院倫理委員會批準。患者年齡24~43 歲,無合并全身重大臟器疾病或慢性內科疾病。
2 主要試劑
0.25 %胰酶、DMEM/F12 培養液和胎牛血清(fe?tal bovine serum,FBS)購自Gibco;淋巴細胞分離液(Ficoll-Paque PREMIUM)購自Pharmacia;臺盼藍和磷酸鹽緩沖液(phosphate buffer solution,PBS)購自北京索萊寶公司;卵泡刺激素受體(follicle-stimulat?ing hormone receptor,FSHR)流式抗體購自R&D Sys?tems;紅細胞裂解液購自BD;高純總RNA 快速提取試劑盒(離心柱型)、逆轉錄試劑盒和PCR 試劑購自TaKaRa;RIPA 裂解緩沖液購自上海碧云天生物技術研究所;脫脂奶粉購自Difco;GAPDH 抗體、微管相關蛋白1 輕鏈3(microtubule-associated protein 1 light chain 3,LC3)抗體、P62 抗體、Bax 抗體、Ⅱ抗羊抗兔IgG購自Proteintech。
3 方法
3.1 MGCs和CCs的分離
3.1.1 MGCs 的分離 收集拾卵后棄去的卵泡液,200×g離心10 min 后棄上清,PBS 重懸,并加入等體積的0.25%胰酶,室溫消化15 min 后用含10% FBS的DMEM/F12培養液終止消化,200×g離心10 min后棄上清,PBS 重懸,然后緩慢地小心地將懸液轉移到等量的Ficoll分離液液面上,400×g離心20 min,若此時液體未出現明顯分層,可適當加大離心力或延長離心時間。至分層明顯后,將中間顆粒細胞層小心吸出,用含10% FBS 的培養液洗滌1 次后重懸待計數。
3.1.2 CCs 的分離 拾卵時吸出卵丘-卵母細胞復合物后,在MOPS 緩沖液中用1 mL 注射器機械切割挑出卵子周邊的卵丘顆粒細胞團,并用IVF 液沖洗,隨后轉移至無菌離心管中,加入1~2 mL 0.25%胰酶,室溫下消化并反復吹打,3~5 min 后用含10%FBS 的DMEM/F12 培養液終止消化,PBS 洗滌1 次,離心后重懸待計數。
3.2 細胞計數與存活率檢測 稱量4 g 臺盼藍粉末,加入100 mL純水溶解,過濾后取濾液,即配成4%臺盼藍母液;使用時將臺盼藍母液與PBS 緩沖液以1∶9 的比例配成0.4%工作液。將MGCs 和CCs 細胞懸液稀釋成(1~10)×105/L 的密度,吸取100 μL 至EP管中,以1∶1 的比例與0.4%臺盼藍工作液混合,靜置3 min 后吸取10 μL 至血球計數板中,進行細胞計數和存活率檢測。
3.3 細胞原代培養、細胞爬片與HE染色 將MGCs和CCs 細胞懸液接種至6 孔板中,置于37℃、5%CO2的培養箱中培養,(24~48)h 換液1 次,第1 次為半量換液,以后為全量換液。培養后48 h 于顯微鏡下觀察細胞貼壁和生長狀態并拍照。繼續培養至對數生長期,留作后續qPCR和Western blot實驗。
另將部分MGCs 和CCs 分別接種至預先放有防脫載玻片的24孔板中,置于37℃、5%CO2的培養箱中培養,(24~48)h 換液1 次,第1 次為半量換液,以后為全量換液。當細胞爬滿載玻片的70%時取出載玻片進行HE染色。
3.4 細胞純度鑒定 采用流式細胞術檢測FSHR的表達以進行細胞純度鑒定。兩種細胞每106個細胞孵育10 μL FSHR 流式抗體,渦旋震蕩,室溫避光孵育30 min,隨后300×g離心5 min,棄上清后加入2 mL PBS 重懸,洗滌1 次。再加入2 mL 紅細胞裂解液,室溫避光孵育10 min,洗滌2 次。然后加入200~400 μL PBS,重懸于FACS 流式管中,置于流式細胞儀上檢測。實驗重復3次。
3.5 LC3、P62 和Bax mRNA 的qPCR 檢測 收集對數生長期的MGCs和CCs,根據高純總RNA快速提取試劑盒(離心柱型)使用說明抽提總RNA,根據逆轉錄試劑盒步驟進行逆轉錄反應,依次在PCR 反應管中加入20 反應體系,包括ddH20 7.4 μL,SYBR 10 μL,逆轉錄產物1 μL,引物1.6 μL,于PCR 儀上反應,反應條件為:94℃10 s,60℃15 s,72℃12 s,總共40個循環。所有樣本均按3個復孔加樣。引物序列見表1。
3.6 LC3、P62 和Bax 蛋白的Western blot 檢測 每個樣品根據細胞數量分別加入20~50 μL 含苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)的RI?PA 裂解緩沖液,用BCA 法檢測蛋白濃度。每孔上樣量20 μg,在15%(LC3)或12%(P62、Bax)SDSPAGE 中分離,隨后轉移到聚偏二氟乙烯(polyvinyli?dene fluoride,PVDF)膜上(LC3 采用0.22 μm PVDF膜,P62、Bax采用0.45 μm PVDF膜)。將PVDF膜在5%脫脂奶粉溶液中室溫浸泡1 h,置于含有內參抗體、目的抗體的盒子中4℃孵育過夜(抗體稀釋比例如 下:LC3 為1∶500,P62 為1∶1 000,Bax 為1∶1 000,GAPDH 為1∶1 000)。用1×TBST 洗滌后,將膜與Ⅱ抗(稀釋1∶50 000)室溫下放置1 h,1×TBST洗膜3次,超敏發光液曝光顯色及拍照。
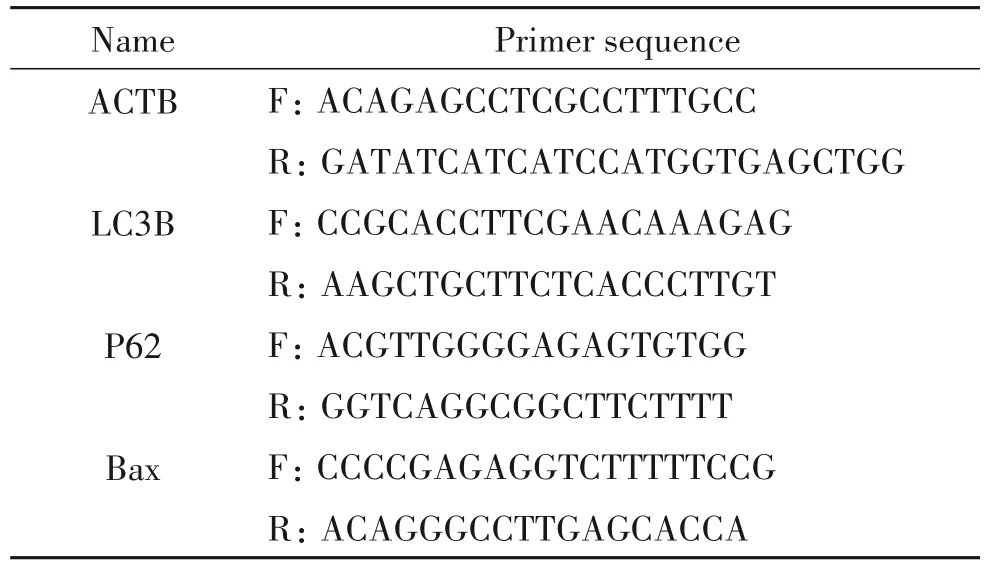
表1 qPCR引物序列Table 1.Sequences of the primers for qPCR
4 統計學處理
細胞分離與培養實驗重復3 次。qPCR 數據用LightCycler 480 軟件進行分析,采用相對定量法比較2?ΔΔCt的值;Western blot應用ImageJ 1.48圖像處理軟件進行灰度分析。使用SPSS 20.0進行統計學分析,結果用均數±標準差(mean±SD)表示,采用兩獨立樣本t檢驗進行均數間比較。以P<0.05 為差異有統計學意義。
結 果
1 MGCs和CCs的分離耗時、細胞總數及存活率
CCs 的分離耗時少于MGCs,分離結束時的存活率高于MGCs,但細胞總數少于MGCs(P<0.05)。見表2。

表2 MGCs和CCs的分離情況比較Table 2.The comparison of isolation parameters between MGCs and CCs(Mean±SD.n=16)
2 MGCs和CCs的細胞純度
使用流式細胞術檢測FSHR 的表達進行細胞純度鑒定,分離后CCs 與MGCs 的FSHR 表達量分別為(92.23±2.66)%和(81.33±6.57)%,差異具有顯著性(P<0.05)。流式細胞術分析圖見圖1。
3 MGCs和CCs體外原代培養的生長狀態
HE 染色可見MGCs 和CCs 生長狀態良好,細胞形態呈類成纖維細胞狀,細胞偽足延展,相互連接;細胞核藍染,圓形,核仁明顯;胞質透亮呈淡紅色,可見豐富的黑色顆粒分布,見圖2。培養48 h 后,光鏡下可見細胞單層貼壁生長,呈梭形或星形,偽足呈絲狀突起,CCs 比MGCs 的細胞外觀更純凈,細胞體積更大,伸展狀態更佳,見圖2。
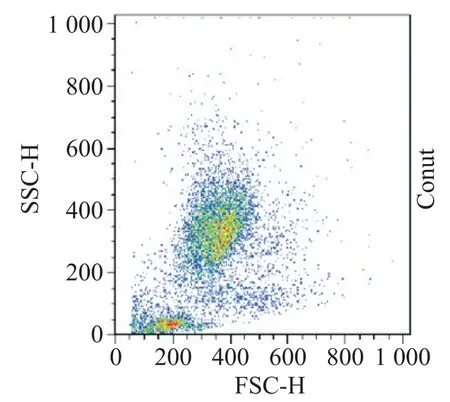
Figure 1.FSHR expression of MGCs and CCs after isolation.圖1 分離后MGCs和CCs的FSHR表達量
4 LC3、P62、Bax在MGCs與CCs中的mRNA表達水平
CCs 的LC3 mRNA 表達水平顯著低于MGCs(P<0.01),Bax 的mRNA 表達水平顯著高于MGCs(P<0.05),CCs 與MGCs 的P62 mRNA 表達水平比較,沒有顯著差異(P>0.05)。見圖3。
5 LC3、P62 和Bax 蛋白在MGCs 與CCs 中的表達水平
CCs 的LC3-Ⅱ/Ⅰ水平顯著低于MGCs(P<0.01),Bax 蛋白表達水平顯著高于MGCs(P<0.05),CCs 與MGCs 的P62 蛋白表達水平比較,沒有顯著差異(P>0.05)。見圖4。
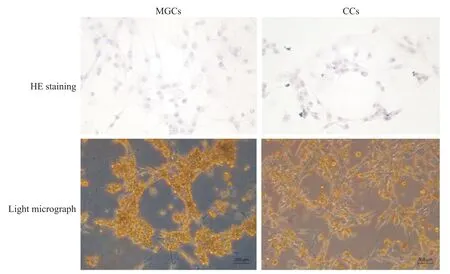
Figure 2.The growth status of MGCs and CCs primary cultured in vitro.HE diagrams of cells climbing 70% of glass slide and light micrograph of cells after primary culture for 48 h were showed(scale bar=200 μm).圖2 MGCs和CCs體外原代培養的生長狀態
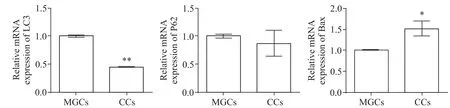
Figure 3.The relative mRNA expression of LC3,P62 and Bax in MGCs and CCs.Mean±SD.n=16. *P<0.05,**P<0.01 vs MGCs.圖3 MGCs和CCs的LC3,P62,Bax mRNA表達水平
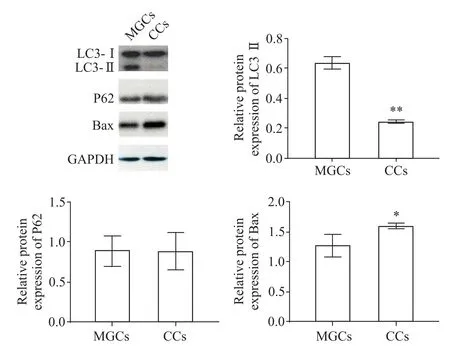
Figure 4.The protein expressions of LC3,P62 and Bax in MGCs and CCs.Mean±SD. n=3. *P<0.05,**P<0.01 vs MGCs group.圖4 MGCs和CCs的LC3、P62和Bax蛋白表達水平
討 論
顆粒細胞是卵泡中最大的功能細胞群,它以自分泌和旁分泌參與卵母細胞發育、成熟[7],與卵母細胞生殖生理有著密切聯系。MGCs 和CCs 是顆粒細胞的兩個亞群,借助于MGCs和CCs的研究可以增進卵巢功能內分泌調控的認識。故此,有必要對MGCs和CCs的細胞模型進行充分評價。
以往實驗評價了多種人卵巢MGCs 的分離和提純方法,包括密度梯度離心法、裂解法和沉淀法等,但都不可避免出現分離耗時長、細胞純度低等問題[8],直接影響了細胞體外狀態及模型的效果。在本實驗,我們采用機械切割法+酶解法分離CCs,分離耗時顯著少于密度梯度離心法分離MGCs。成熟卵子周圍的卵丘細胞團主要成分是CCs 和透明質酸等細胞外基質,故此,分離CCs 只需要把卵丘細胞團從卵丘-卵母復合物中切割出來,用胰酶或透明質酸酶把透明質酸消化即可,操作簡單,因而耗時少。而密度梯度離心法利用淋巴細胞分離液離心后形成不同的密度梯度,卵泡液中的各種細胞成分根據密度不同分布在離心管內不同層面,從而實現細胞的分離純化[9-10]。由于分離MGCs 需收集卵泡液,卵泡液量多,要作多個離心管分裝進行分離,且加在分離液層上的卵泡液一般約3 mL,否則會影響細胞的沉降速度[11];加上該分離方法需要多次離心,整個操作過程較為繁瑣,故分離MGCs耗時較長。
FSHR 特異性表達于顆粒細胞,可用于鑒定顆粒細胞的純度[12]。在本研究中,應用流式細胞術比較分離后CCs 與MGCs 的FSHR 的表達,結果顯示CCs細胞純度高于MGCs。由于卵泡液成分復雜,含有大量紅細胞、少量白細胞和其他成分[13],難以通過離心完全棄去雜質,導致分離后MGCs仍混有其他細胞成分,使細胞純度降低。此外,密度梯度離心法分離MGCs 需要時間長于CCs 分離法,且MGCs 須經歷多次離心洗滌程序,離心力會對細胞造成損傷[14],上述因素可能導致MGCs存活率顯著低于機械切割法+酶解法分離CCs,這是應用MGCs 模型須注意的問題;另一方面,相對于從卵泡液可收集到MGCs,CCs 是顯微鏡下對卵丘-卵母細胞復合物作切割獲得,切割出來的CCs 包裹著大量的黏液團,其為細胞外基質成分。為避免黏液團的黏性限制CCs 在體外生長[11],本實驗采用胰酶消化。由圖2 可見,消化了黏液團后的CCs比MGCs生長的體積更為飽滿,偽足伸展性更佳,貼壁更好。MGCs在分離時難分散成單個細胞,培養時細胞容易成團塊狀生長,限制了其延展,且分離的MGCs 不可避免混有紅細胞,紅細胞沉降在培養皿底部,影響了細胞的貼壁。因此,在體外培養,CCs比MGCs顯示出更好的細胞延展性。
CCs 和MGCs 需經歷分離、純化等一系列人為操作才作為細胞模型用于實驗。為了解體外處理后的細胞狀態,除了細胞存活率,本研究采用了自噬和凋亡基因的表達變化來進一步了解細胞特性。LC3 是自噬延伸階段的重要泛素化蛋白,其數量和自噬體的數量呈正相關,是分析自噬強弱的指標[15];選擇性接頭蛋白P62可用于評估自噬流的通暢程度[16];Bax是B 細胞淋巴瘤/白血病2(B cell lymphoma/leukemia-2,Bcl-2)家族中的促凋亡蛋白,通常認為它的激活是導致凋亡發生的重要事件[17]。結果表明,CCs 與MGCs 的P62 mRNA 和蛋白表達水平沒有顯著差異,提示兩種細胞的自噬流通暢程度相似;CCs 中LC3 mRNA 和LC3-II/I 的水平顯著低于MGCs,而Bax mRNA 和蛋白的表達水平顯著高于MGCs,提示在體外培養下,CCs 可能比MGCs 有較低的自噬活性和較高的凋亡活性,這種情況或許與CCs 脫離了卵母細胞有關。在體內,CCs圍繞卵母細胞生長,卵丘-卵母復合物形成獨特的微環境,CCs的生理功能受卵母細胞分泌因子的調控,卵母細胞分泌因子可保護CCs免于凋亡[18],而CCs 脫離了卵母細胞,失去了卵母細胞分泌因子的調控,有可能使細胞的凋亡活性升高。
綜上所述,CCs 比MGCs 分離提純更高效。機械切割法+酶解法分離CCs 方法簡便,收集細胞的純度高,細胞狀態良好,可用于原代培養實驗。如需長期體外培養,單獨的CCs 可能容易發生凋亡,或需加入卵母細胞分泌因子等模擬CCs 在體內的微環境,以提高CCs體外培養的穩定性。

