Piancatelli反應在有機合成中的應用研究進展
胡茂群,張夢瑤,田晨曦,韓玉,王程宇
(臨沂大學化學化工學院,山東 臨沂 276000)
早在1976 年,Piancatelli 小組[1]發現呋喃醇在酸性水溶液中經多步重排環化反應合成環戊烯酮類化合物。其可能的反應機理(如圖1 所示)。
酸性條件下呋喃醇脫水重排成A 中間體,使得呋喃5-位親電性增強,反應體系中的水作為親核試劑進攻呋喃5-位,形成中間體B,進而C-O 鍵斷裂,得到中間體C。異構化得到中間體D,4π 順旋環化得到環戊烯酮產物。我們將這一串聯環化反應稱為Piancatelli 反應。該反應的發現為環戊酮衍生物的合成提供了一種非常便利的方法。隨后幾十年里,化學家們圍繞該反應展開了系列研究,包括親核試劑種類、新型催化體系開發、通過反應底物設計合成環戊酮衍生物的螺環、并環、橋環結構等。本文將圍繞如何通過反應底物設計,將Piancatelli 反應應用于合成不同取代類型環戊烯酮骨架、環戊酮螺環、并環、橋環化合物的構建。
1 不同取代類型環戊烯酮骨架構建
在Piancatelli 反應中,如果改變親核試劑種類或改變反應底物,將呋喃醇改為呋喃胺衍生物,是否可以發生類似的反應,得到4,5-二胺基取代的環戊烯酮衍生物呢?2007 年Batey 課題組[2]對此進行了嘗試,以呋喃醛、仲胺為反應底物,10mol%Ln(OTf)3為反應催化劑,乙腈為反應溶劑,室溫條件下即能以77%~99%收率得到二胺基取代的環戊烯酮化合物。其中4,5~位二胺基為反式構型,如圖所示。該反應將Piancatelli 反應中水作為親核試劑,拓展至以胺類化合物為親核試劑,反應底物由呋喃醇拓展至呋喃醛,拓展了其應用范圍。
2010 年,Alaniz 課題組[3]以胺、呋喃醇為反應底物,5 mol%Dy(OTf)3為反應催化劑,乙腈為反應溶劑,80oC 反應條件下能以68%-89%收率得到不同取代類型4-胺基取代環戊烯酮化合物。該反應原料簡單易得,反應條件溫和,底物適用性廣,適用于伯胺、仲胺底物。作者以此為關鍵反應步驟,完成了hNK1 抑制劑藥物。
2 環戊烯酮螺環骨架的構建
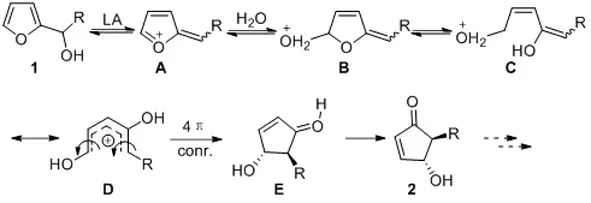
圖1
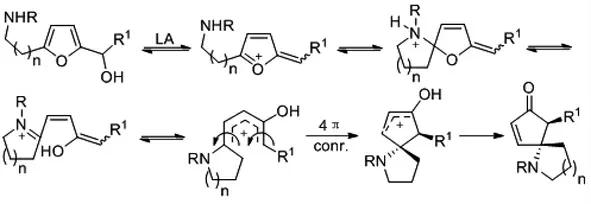
圖2
在Piancatelli 反應中,如果將親核位點及呋喃醇片段構建在同一個分子內,按照類似反應路徑(如圖2 所示),是否可以構建出含環戊烯酮片段的螺環分子呢?2011 年Alaniz 課題組[4]對此進行了實驗嘗試,作者發現5 mol%Dy(OTf)3為反應催化劑,乙腈為反應溶劑,80oC 反應條件下可以順利得到預想的環戊烯酮氮雜螺環化合物。2013 年該課題組[5]將羥基與呋喃醇片段構建在同一個分子內,類似的反應條件下完成了環戊烯酮氧雜螺環化合物的合成。
3 環戊酮并環化合物的構建
在Piancatelli 反應中,如果引入具有雙親核位點的親核試劑參與反應,是否會先發生Piancatelli 反應、然后另外的親核位點對烯酮進一步發生Michael 加成反應,構建出環戊酮的并環化合物呢?2014 年,我們小組[6]率先對此進行了實驗嘗試,我們選擇具有雙親核性能的烯胺酮為反應底物,使之與呋喃醇反應,發現以10%ZnCl2 為反應催化劑,DCE 為溶劑,80oC 反應條件下,能以72%~99%得到相應的環戊酮并二氫吡咯衍生物。2017 年Chandrasekhar 課題組[7]以2-氨基苯甲酰胺為雙親核試劑,使之與呋喃醇反應,構建出環戊酮并二氮雜七元環骨架。(如圖3 所示)
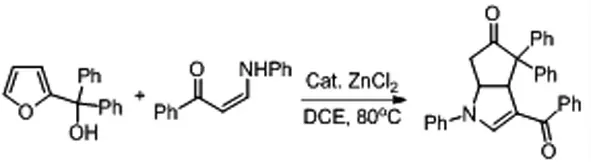
圖3
4 環戊酮橋環化合物的構建
在Piancatelli 反應中,如果呋喃醇片段中的引入親核位點,是否在發生相應的piancatelli 反應后,能夠繼續對烯酮片段發生Michael 加成反應呢?2020 年Leboeuf 課題組[8]合成了2-氨基苯基呋喃醇底物,使之與胺類化合物反應,反應首先發生piancatelli 環化反應,進而分子內的氮原子對烯酮片段發生邁克爾加成反應,得到相應的氮雜橋環化合物。(如圖4 所示)
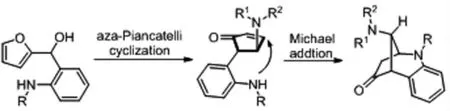
圖4
5 結語
綜上所述,通過Piancatelli 反應可以有效構建出4-羥基(氨基)取代環戊烯酮骨架;將親核試劑與呋喃醇構建在同一個分子內,發生分子內Piancatelli 反應可以有效構建出不同環徑大小的氮雜、氧雜螺環戊烯酮骨架;采用具有雙親核性能的親核試劑與呋喃醇反應,發生Piancatelli 反應后,進而發生Michael 加成反應,得到環戊酮并環結構;在呋喃醇R 取代基引入親核基團,使之與芳胺反應,經類似反應路徑,可以構建出氮雜含環戊酮片段的橋環化合物。本文從反應底物設計角度,簡要綜述了Piancatelli反應在有機合成的應用研究進展,期望能為本領域的研究起到一定的輔助與推動作用。

