粉煤灰堿熔-水熱合成沸石用于水溶液中汞的吸附
燕可翀,李子鵬,李楊敏,王平治
(1.太原城市職業技術學院工程經濟系,太原 030027;2.太原理工大學環境科學與工程學院,晉中 030600)
0 引 言
世界衛生組織認為汞是十大危害公眾健康的污染物之一。含汞廢水的肆意排放會對土壤、沉積物和水體造成不可逆的環境危害,而且若無機汞轉變為有機汞,如甲基汞等,其有可能通過食物鏈富集,進而嚴重危害到人類健康[1]。基于此,眾多科研人員致力于去除水體中的汞。目前,常見的水體除汞技術有吸附、沉淀、共聚、反滲透等,其中吸附法被認為是最為簡單易行的方法,故得到了廣泛的應用。對于吸附法而言,其關鍵在于吸附劑的選擇。在不同的吸附劑中,活性炭已被廣泛應用于去除工業廢水中的汞。然而,由于該技術的成本高、制備難、再生難等問題,使得其在大規模吸附系統的應用被限制[2]。
近年來,關于低成本吸附劑制備的研究越來越多。其中,以粉煤灰為原料制備沸石用于吸附廢水中重金屬污染也有諸多報道[3-5]。粉煤灰作為燃煤電廠產生的固體廢棄物,因含有大量的氧化鋁和氧化硅,故可用于合成鋁硅沸石。目前,粉煤灰合成沸石的主要工藝包括:直接水熱法,即直接用堿性溶劑與粉煤灰反應獲得沸石;活化-水熱法,即對粉煤灰進行機械力活化、堿熔活化等后,再用堿性溶劑與活化粉煤灰反應制得沸石;此外,還包括微波、超聲波、模板劑等輔助方法[3-4]。上述方法中特別是以堿熔活化后,再結合水熱法合成沸石的轉化率最高,得到廣泛關注。然而,針對采用該法所合成沸石用于脫除工業廢水中汞的研究尚無詳盡報道。
本文以粉煤灰為原料,通過堿熔-水熱法合成沸石。首先考察了堿熔產物在堿液中的溶解性能及規律;然后利用溶出的鋁、硅等,通過水熱法合成沸石;對于合成的沸石,進一步考察其對含汞水體中汞的吸附性能和吸附動力學過程。本研究有望為粉煤灰合成沸石用于工業廢水中汞的去除提供一定的理論指導。
1 實 驗
1.1 實驗材料
實驗所用粉煤灰取自太原某電廠。經自然晾曬后,在105 ℃下干燥24 h備用。通過X射線熒光光譜分析,粉煤灰原料化學組成(質量分數)見表1,其主要包括氧化鋁37%和氧化硅50%,二者質量分數之和可達87%,易合成沸石。

表1 粉煤灰原料的化學組成Table 1 Chemical composition of raw coal fly ash
實驗所用其他材料均為分析純試劑,如碳酸鈉、氫氧化鈉等;用于配置含汞溶液所用的標液為光譜純試劑。
1.2 實驗過程
(1)粉煤灰合成沸石
將粉煤灰和碳酸鈉按照等質量比例加以混合,置于剛玉坩堝內,于程序升溫電阻爐內850 ℃下焙燒活化2 h[6];反應樣品隨爐冷卻至室溫,粉磨細化后備用,標記為堿熔粉煤灰;將4 mol/L的氫氧化鈉溶液(NaOH)與堿熔粉煤灰置于四口燒瓶中,液固比為1∶10,攪拌速度500 r/min,反應溫度95 ℃[7];在反應特定時間段內間隔取樣,采用電感耦合等離子體發射光譜法測定上清液中硅、鋁的含量;根據水熱合成沸石的條件[8],添加鋁、硅外源,調整SiO2和Al2O3的摩爾比至2,在室溫下陳化24 h后,于水熱反應釜中100 ℃下晶化8 h,所得產品洗滌干燥研磨后備用。
(2)沸石吸附汞離子
以1 000 mg/mL汞標液為原料,配置初始濃度為10 mg/L汞的模擬廢水[9]。吸附實驗在恒定室溫條件下,連續振動的振動床上進行。向100 mL含汞溶液中添加5 g的粉煤灰基沸石;反應一段時間后,通過真空循環水泵實現固液分離。濾液通過0.45 μm濾膜后,采用電感耦合等離子體發射光譜法測定其中汞的含量。作為對照樣品,在沒有任何吸收劑的情況下,對配置的含汞模擬廢水進行相同的操作,以消除容器壁吸附的影響。所有試驗進行三次測量取平均值,以提高準確性、可靠性和再現性。
汞的去除率Rm(%)計算方法如式(1)所示:
(1)
式中:C0和Ce分別表示溶液中汞的初始濃度和平衡濃度,mg/L。
單位質量粉煤灰基沸石的汞吸附量(q)計算方法如下所示:
(2)
(3)
式中:qe為吸附平衡時單位質量粉煤灰基沸石的汞離子量,mg/g;qt為吸附過程中某一時刻單位質量粉煤灰基沸石的汞離子量,mg/g;V為試驗溶液體積,L;m為吸附劑重量,g。
1.3 測試表征
利用S8 TIGER型X射線熒光光譜儀(XRF,Bruker,德國),通過硼酸壓片法分析粉煤灰樣品的化學組成,電壓50 kV,電流40 mA,掃描間隔40 s;利用D2 PHASERX射線衍射儀(XRD,Bruker,德國)對粉煤灰、堿熔粉煤灰及沸石進行物相組成分析,Cu Kα靶,電壓40 kV,電流40 mA,掃描范圍10°~80°,步長為0.02°;電感耦合等離子體原子發射光譜(ICP-AES,Optima-3000 DV系統,Perkinelemer,MA)用于測量溶液中鋁、硅、汞的含量,Al、Si、Hg的測定波長分別選定為308.2 nm、251.6 nm和196.164 nm;使用ICP分析軟件(Agilent Technologies,CA)通過峰面積積分減去背景計算凈強度[9]。
2 結果與討論
2.1 堿熔預處理粉煤灰
粉煤灰原料的XRD譜如圖1所示。粉煤灰中的鋁、硅組分主要是以莫來石、石英以及非晶相礦物形式存在。通常情況下,它們的化學反應活性較差,導致沸石合成過程中鋁、硅的轉化率較低。堿熔預處理可有效激發粉煤灰中鋁、硅的反應活性。將粉煤灰和碳酸鈉按照等比例質量混合后,在850 ℃下焙燒活化2 h,其XRD譜如圖2所示,粉煤灰中莫來石、石英以及非晶相礦物轉變為鈉鋁硅酸鹽、硅酸鈉和鈉霞石等礦物[10]。
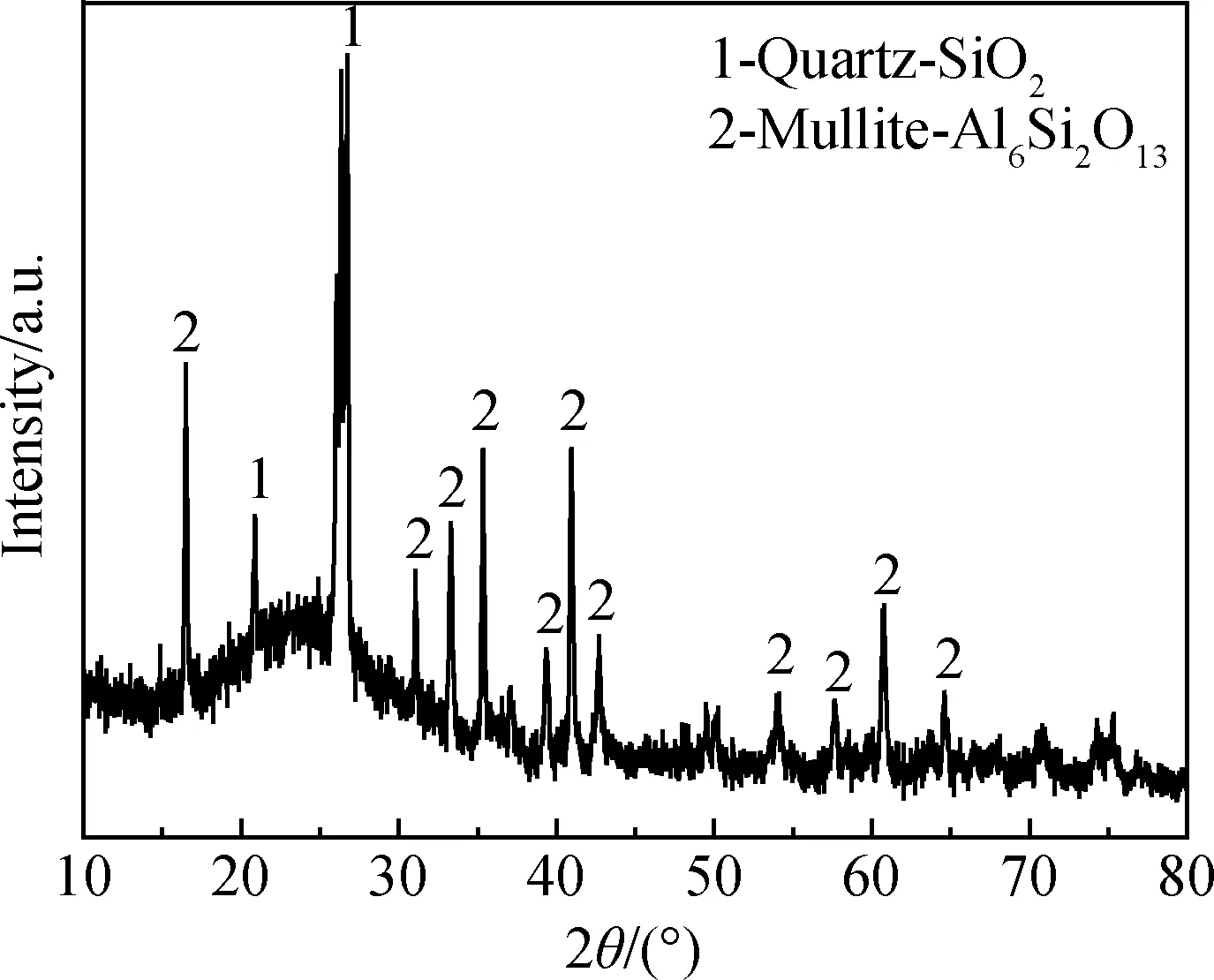
圖1 粉煤灰原料的XRD譜Fig.1 XRD pattern of raw coal fly ash
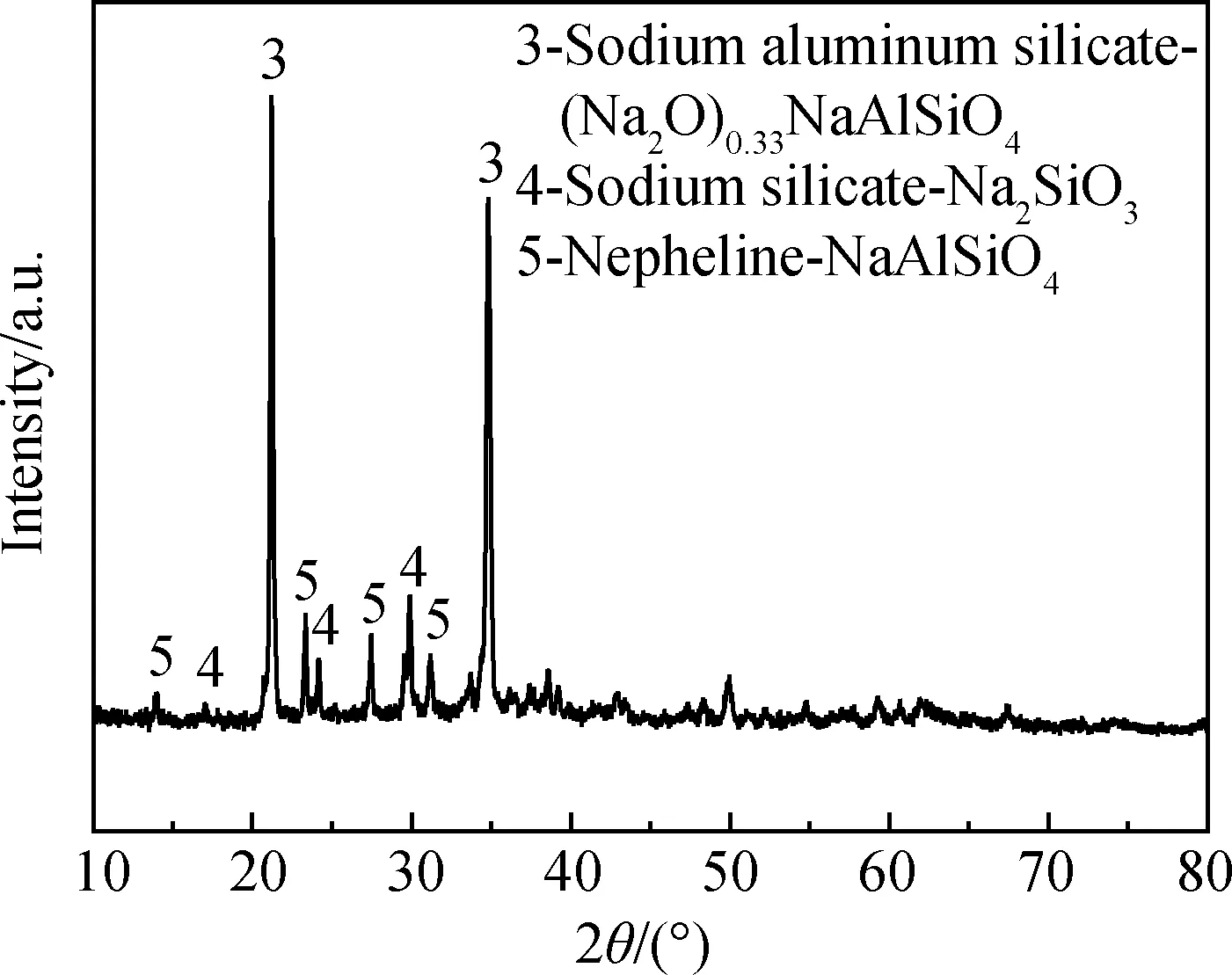
圖2 堿熔活化粉煤灰的XRD譜Fig.2 XRD pattern of coal fly ash calcined with alkali
2.2 堿熔活化粉煤灰的溶解
堿熔活化粉煤灰在95 ℃下溶解于4 mol/L的氫氧化鈉溶液,溶液中鋁離子濃度(CAl)和硅酸根離子濃度(CSi)隨時間的變化曲線見圖3。從圖3中可以看出,隨著時間的延長,粉煤灰逐漸溶解,溶液中CAl和CSi相應的升高。反應開始階段(0~50 min),堿熔活化粉煤灰中鋁、硅大量溶出,溶液中CAl和CSi顯著提升;當反應時間超過50 min后,鋁、硅的溶解速率趨于穩定,反應達到平衡,溶液CAl和CSi不再發生明顯變化。堿熔活化粉煤灰在氫氧化鈉溶液中溶解平衡時,鋁、硅的溶解濃度分別可達10.50 mg/mL和12.78 mg/mL。
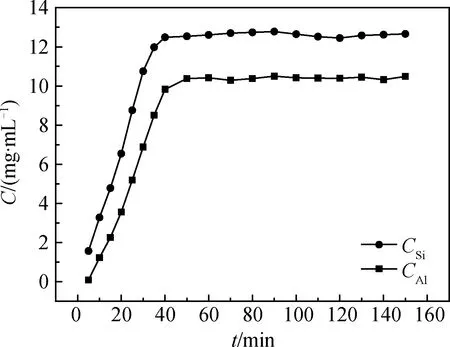
圖3 堿熔活化粉煤灰溶解過程中鋁離子濃度和硅酸根離子濃度隨時間的變化Fig.3 Concentration change of aluminum and silicon during the dissolution of coal fly ash calcined with alkali
2.3 水熱合成沸石
在堿熔活化粉煤灰溶解所得溶液中,添加鋁、硅外源,調整溶液中SiO2和Al2O3的摩爾比至2;根據水熱合成沸石的條件[8],在室溫下陳化24 h后,于水熱反應釜中100 ℃下晶化8 h制得沸石。圖4為堿熔-水熱合成粉煤灰基沸石的XRD譜。經XRD分析可知,該法所制得的產物為NaA型分子篩[11];特征峰明顯尖銳,說明合成沸石的晶型規則完整。
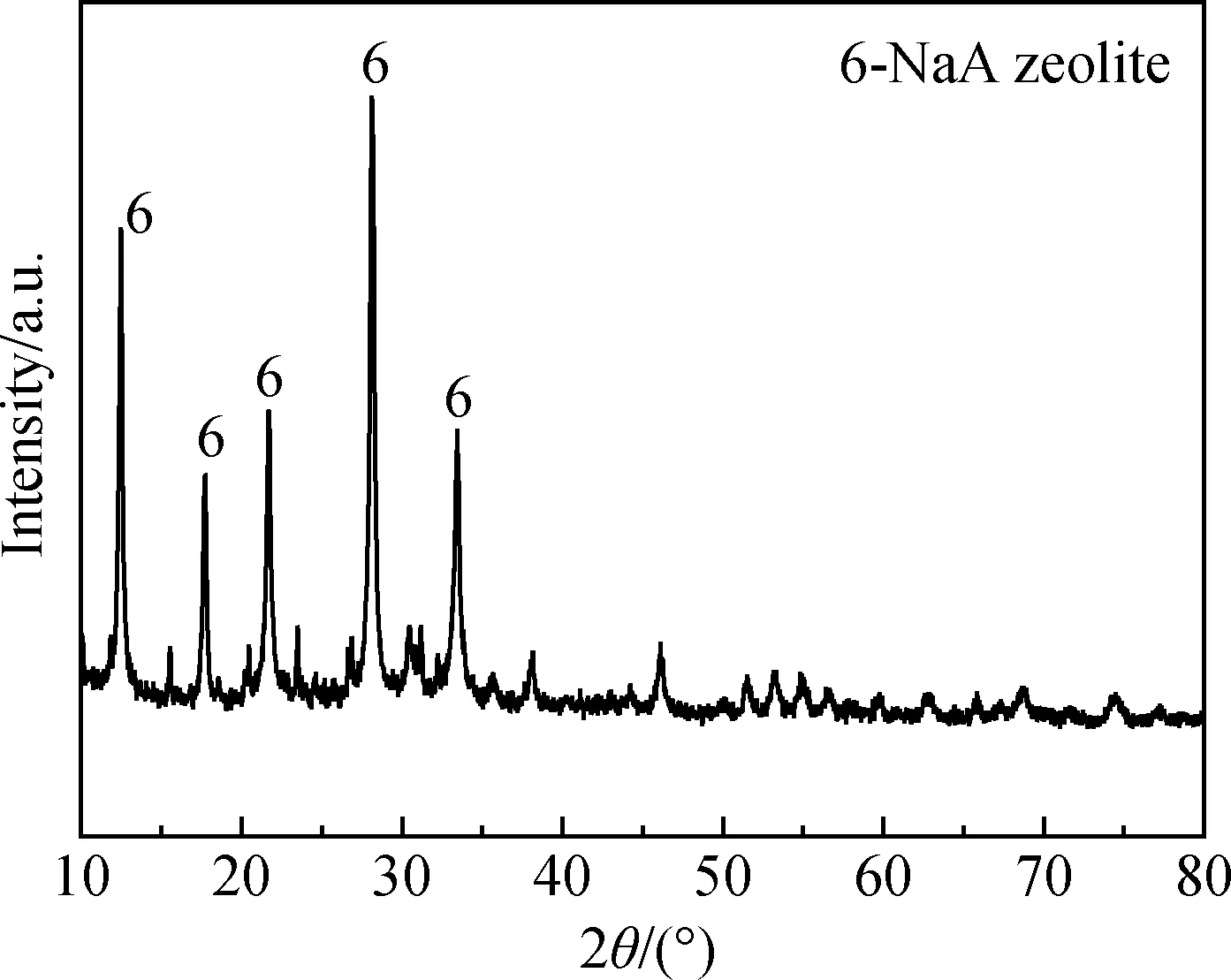
圖4 堿熔-水熱合成粉煤灰基沸石的XRD譜Fig.4 XRD pattern of zeolite from coal fly ash by alkaline-fusion and hydrothermal method
表2是堿熔-水熱合成粉煤灰基沸石經XRF分析所得化學組成結果。從表2可以計算出,產物的分子式為Na1.00Al1.02SiO4.78,沸石產物中NaA型分子篩[12](Na2O·Al2O3·2SiO2·4.5H2O)占總質量的90.32%,是理想的NaA沸石產物。

表2 堿熔-水熱合成粉煤灰基沸石的化學組成Table 2 Chemical composition of zeolite from coal fly ash by alkaline-fusion and hydrothermal method
2.4 沸石除汞
以堿熔-水熱合成的粉煤灰基沸石為吸附劑,在Hg(II) 10 mg/L、吸附劑50 g/L、pH=2.5、室溫條件下,考察其對模擬含汞廢水中Hg(II)的吸附能力,結果如圖5所示。從圖5中可以看出,沸石的初始吸附量較低;隨著反應時間延長,吸附能力很快提升至較高水平;在 15 min 左右,模擬廢水中Hg(II)的去除率已達92.58%;在15~120 min范圍內,Hg(II)的去除率不斷提升,增速較緩;在120 min左右,達到吸附平衡, Hg(II)的去除率最高可達95%左右。
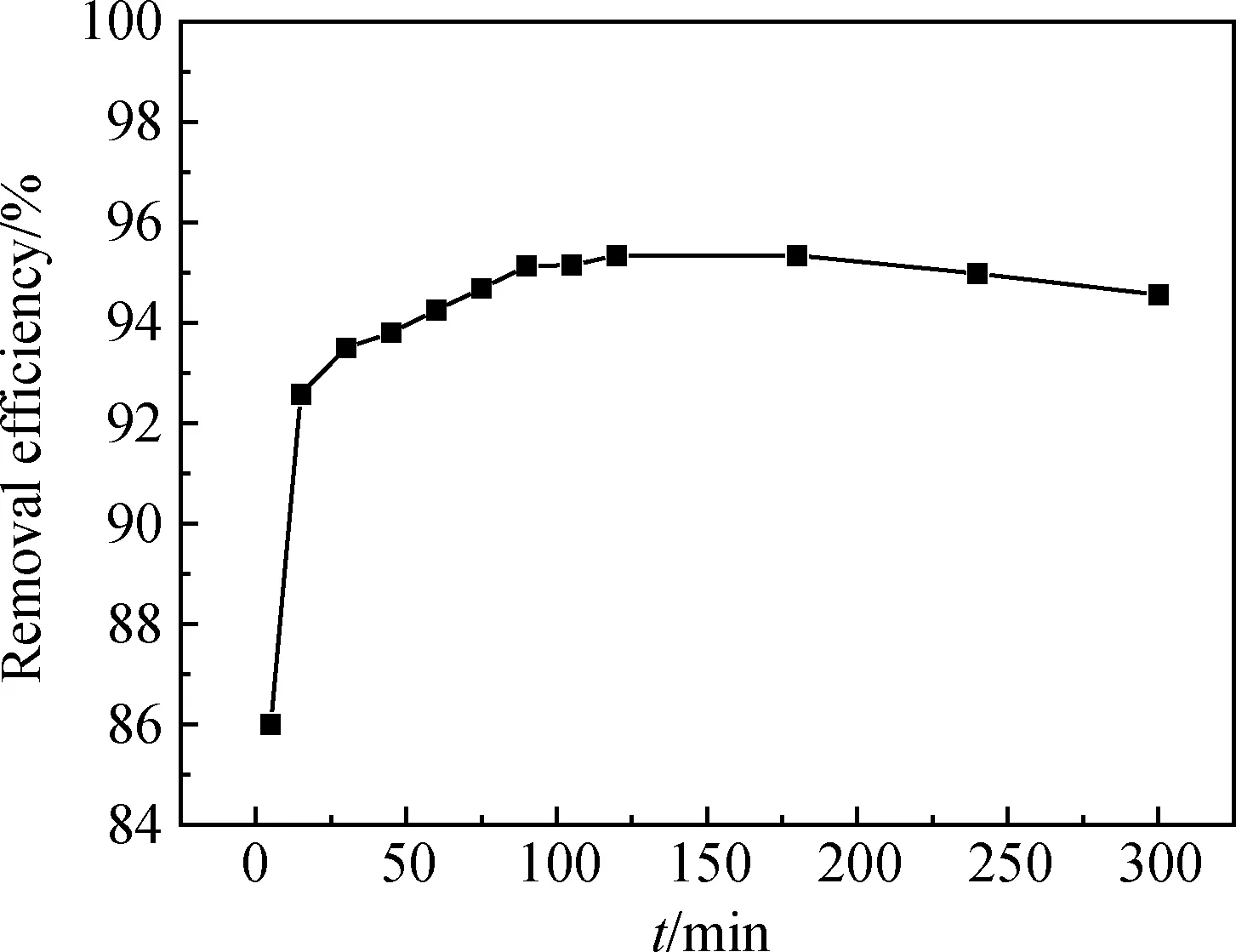
圖5 沸石對Hg(II)吸附能力隨時間的變化Fig.5 Adsorption capacity of zeolite to Hg(II) as a function of time
以吸附數據為基礎,通過比較擬一級動力學模型和擬二級動力學模型的擬合結果,研究堿熔-水熱合成粉煤灰基沸石吸附汞(II)的動力學過程[13], 計算結果見表3和圖6。擬一級動力學模型采用動力學數據繪制ln(qe-qt)與t的關系圖(見圖6(a)),實驗測得的吸附數據呈現非線性結果,表明Hg(II)在堿熔-水熱合成粉煤灰基沸石上的吸附不能使用擬一級動力學模型來描述。相比較而言,根據動力學數據繪制的t/qt值與t的關系圖(見圖6(b)),則呈現明顯的線性關系(R2=0.999 5),表明Hg(II)在堿熔-水熱合成粉煤灰基沸石上的吸附更接近于擬二級動力學模型,以化學吸附為主[14]。

表3 擬一級和擬二級吸附動力學擬合參數Table 3 Parameters of pseudo-first-order and pseudo-second-order for the adsorption
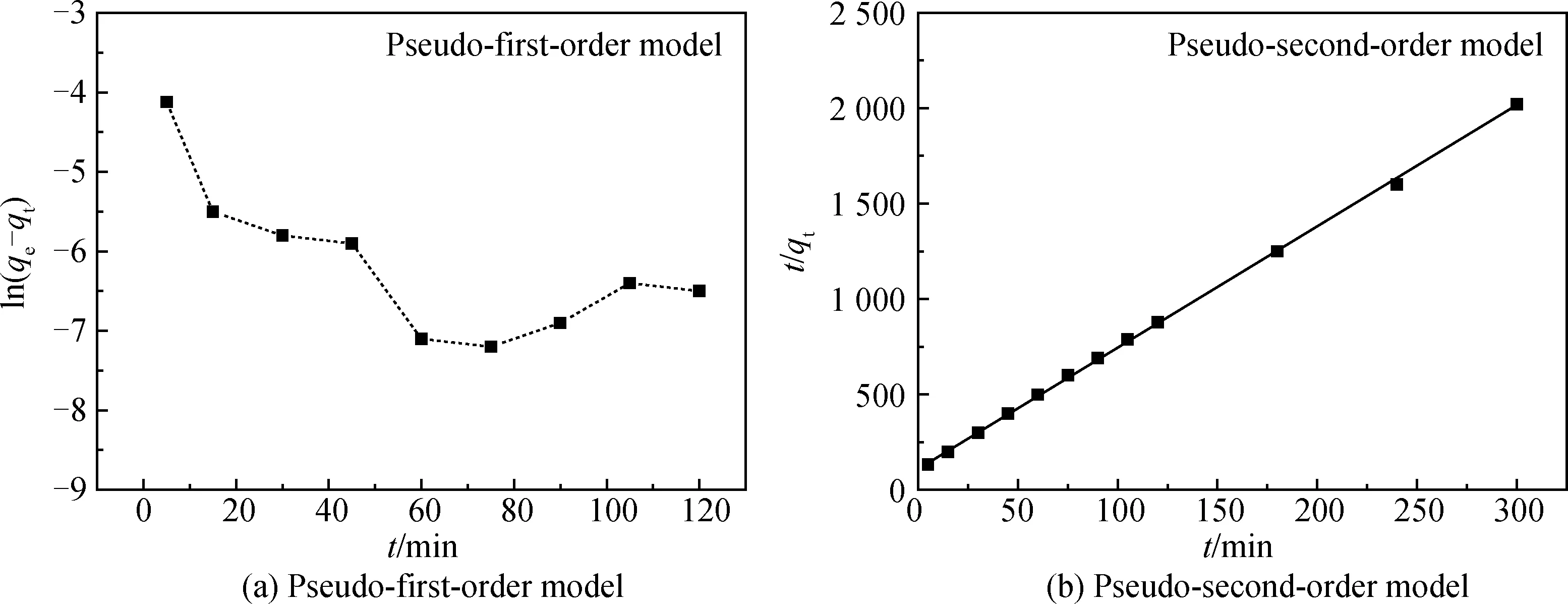
圖6 沸石對Hg(II)吸附動力學計算Fig.6 Adsorption kinetic of zeolite to Hg(II) as a function of time
根據經典擴散模型可知,對于Hg(II)在堿熔-水熱合成粉煤灰基沸石上的吸附而言,需要經過三個步驟:(1)Hg(II)輸送到沸石外表面;(2)沸石外表面吸附Hg(II);(3)Hg(II)在沸石孔道內的遷移和吸附[15]。上述步驟中速度最慢的一步將決定吸附的總速率。顆粒內擴散模型通過繪制t1/2與qt的關系可得,結果見圖7。圖7的分段線性性質表明吸附過程中存在兩個擴散控速步驟,即顆粒內擴散不是唯一的速率限制步驟[15]。圖5中Hg(II)從溶液中初始去除速率很高,對應于外部表面吸附或邊界層效應;而對于剩余過程,即受到顆粒內擴散控制,直至吸附達到平衡。
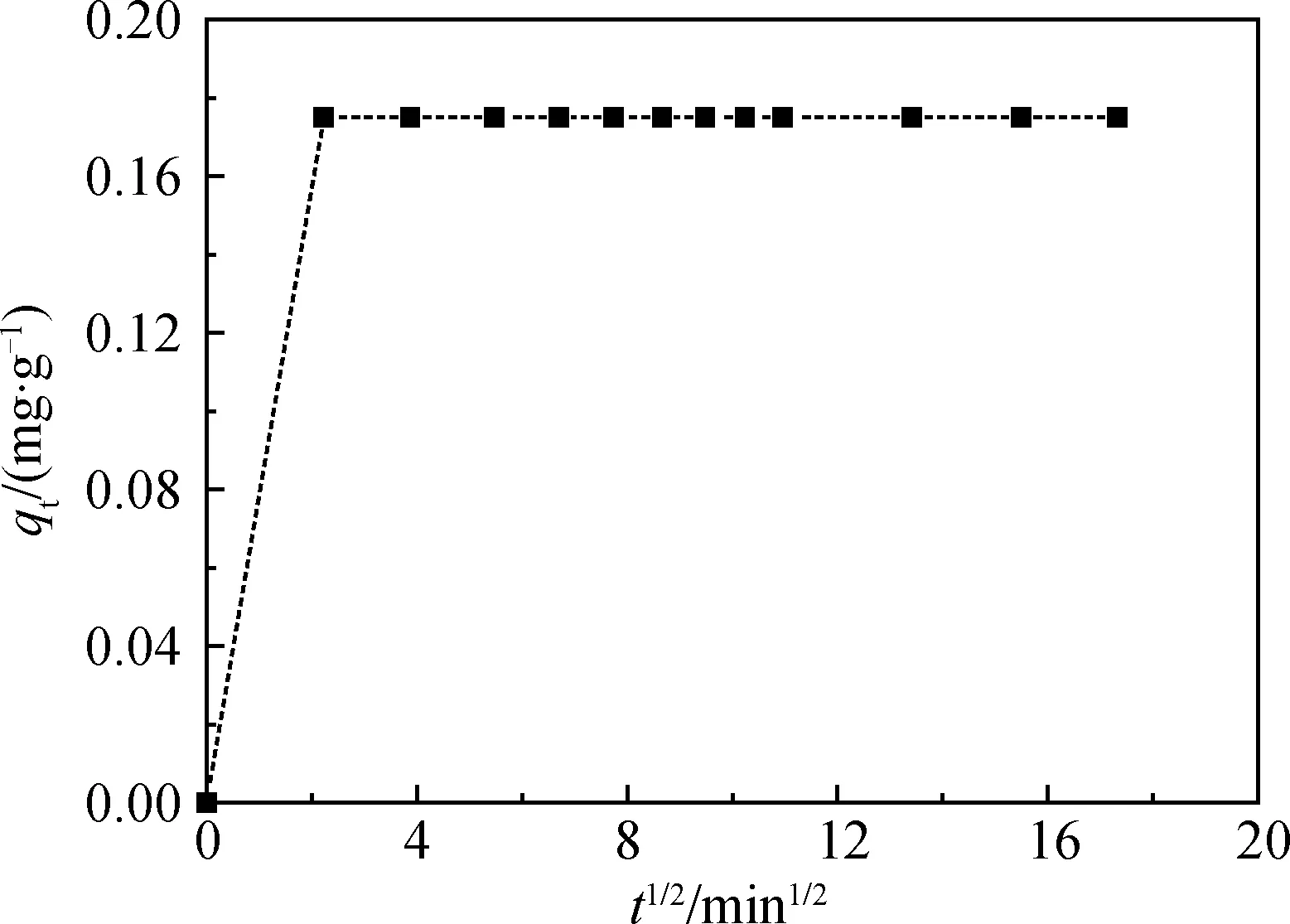
圖7 Hg(II)在沸石表面吸附擴散模型計算Fig.7 Application of the diffusion model to the adsorption of zeolite to Hg(II)
3 結 論
(1)堿熔活化可使得粉煤灰中穩定的莫來石、石英及非晶相礦物轉變為鈉鋁硅酸鹽、硅酸鈉和鈉霞石等礦物;這些礦物可溶于氫氧化鈉溶液中,形成富含鈉、鋁、硅的堿性溶液,鋁、硅的溶解濃度分別為10.50 mg/mL和12.78 mg/mL;在適宜的水熱條件下,富含鈉、鋁、硅的堿性溶液通過調配鋁硅比至2,可合成晶型良好的NaA型沸石,且純度高達90.32%。
(2)通過堿熔-水熱法合成的粉煤灰基沸石可有效吸附水溶液中的Hg(II),去除率可達95%左右,該過程符合擬二級吸附動力學模型(R2=0.999 5),以化學吸附為主;吸附過程中存在兩個擴散控速步驟,Hg(II)從溶液中初始去除速率很高,對應于外部表面吸附或邊界層效應;而對于剩余過程,則受到顆粒內擴散控制,直至吸附達到平衡。

