克氏原螯蝦sex-lethal基因的克隆與表達分析
費佳敏,石林林,李艷和,2
1.華中農業大學水產學院/農業農村部淡水生物繁育重點實驗室/農業動物遺傳育種與繁殖教育部重點實驗室,武漢 430070;2.長江經濟帶大宗水生生物產業綠色發展教育部工程研究中心,武漢 430070
克氏原螯蝦(Procambarusclarkii),俗稱小龍蝦,因其生長迅速、適應性強、肉味鮮美、蛋白質含量高等特點,目前已成為我國重要的淡水經濟養殖品種之一。 在自然發育和人工養殖過程中,雌雄個體間的生長速度存在一定的差異。在達到性成熟之前,雌雄個體相差不大且生長速度相當;接近性成熟時,由于雌蝦需要為卵巢提供大量的營養物質,雄蝦的體長和體質量增長較雌蝦快[1]。因此,研究克氏原螯蝦中與性別分化相關的基因,將有利于人為控制其性別的分化,達到在養殖過程中進行單性養殖以獲得更高利益的目的,并推動我國小龍蝦產業的發展。
目前有關昆蟲雌雄性別發育相關基因的研究已有一定的進展,其中關于黑腹果蠅(Drosophilamelanogaster)性別決定機制的研究最為成熟,可為其他物種的研究提供一定的參考作用。在昆蟲的體細胞中性別決定信號的調控是由一系列涉及多個基因的聯級反應組成的,其中一些基因編碼RNA結合蛋白來控制前體mRNA的性別特異性剪接[2],從而達到對昆蟲性別分化的調控作用。在這些性別決定相關的基因中,Sxl位于聯級反應的最上游,被認為是黑腹果蠅性別決定的關鍵基因,是控制著體細胞的性別分化、生殖細胞的分化以及劑量補償的樞紐[3],其表達受到X∶A的信號調控[2]。當X∶A(2X∶2A)的比值為1時,Sxl被激活產生有活性的Sxl蛋白,調控下游性別分化相關基因的表達,使果蠅個體發育成雌性。相反當X∶A(XY∶2A)為0.5時,Sxl沒有被激活,一系列的聯級調控反應無法進行,促使果蠅個體發育成雄性[4]。
在一些甲殼動物中,與性別決定聯級反應有關的一些基因已經被報道,如,羅氏沼蝦(Macrobrachiumrosenbergii)的1個Sxl基因,2個Dmrt轉錄異構體[5];南美白對蝦(Penaeusvannamei)的Sxl基因[6];中華絨螯蟹的(Eriocheirsinensis) 4種Sxl轉錄異構體[7];紅螯螯蝦(Cheraxquadricarinatus)的4種Sxl轉錄異構體[8];中國對蝦(Fenneropenaeuschinensis)的1個Tra-2基因[9];日本沼蝦(Macrobrachiumnipponense)的2個Sxl異構體和1個Tra-2基因[10-11]。甲殼動物的這些基因大多與昆蟲的同源基因具有高度的序列相似性,但是這些基因在甲殼動物的性別決定中的作用仍然沒有被明確,而研究與其性別調控相關基因的結構與功能又是探明甲殼動物的性別決定機制的突破口。因此,筆者克隆和分析克氏原螯蝦性別相關基因Sxl的結構和表達情況,以期為克氏原螯蝦性別決定和性別分化機制的研究奠定一定的基礎。
1 材料與方法
1.1 動物材料
試驗用蝦來自華中農業大學水產養殖示范基地,養殖水溫20~23 ℃,每天投喂2次,1周換水1次。采集健康的(20±5) g成年雌雄克氏原螯蝦的腹部腹神經索、胸部腹神經索、食道下神經節、圍食道神經、腦、眼柄、心、肝胰腺、胃、前腸、中腸、后腸、觸角腺、肌肉、鰓、血、皮膚、精巢、輸精管、促雄性腺、卵巢等21種組織樣品,以及克氏原螯蝦無節幼體期和蚤狀幼體期的受精卵,出膜后1、3、6、13、15、17 d的整只蝦樣品,出膜后出現雌雄分化的23、28、36、41、48、98、103、109、115 d的雌雄蝦的頭胸甲樣品,共計26種樣品。其中每種試驗樣品采集3只蝦為1組,采集后的樣品經液氮罐速凍后于-80 ℃冰箱保存備用。
1.2 總RNA的提取和cDNA的合成
采用TRIZol?Reagent(Thermo Scientific,Waltham,MA,USA)法提取各個試驗樣品的總RNA。取1 μL RNA,使用紫外分光光度計NanoDrop 2000(Thermo Scientific,Waltham,MA,USA)進行上機檢測,測定其A260/A280在1.8~2.0之間,質量濃度在20 ng/μL以上;根據反轉錄試劑盒ReverAid First Strand cDNA Synthesis Kit(Thermo Scientific,Waltham,MA,USA)操作步驟對提取的總RNA(1 μg)進行反轉錄,以獲得cDNA第一條鏈。剩余RNA樣品以及反轉錄得到的cDNA樣品保存于-80 ℃冰箱備用。
1.3 Sxl的cDNA序列的克隆
根據NCBI數據庫中已知的甲殼類動物的SxlcDNA序列,利用MEGA 5.1軟件,找出其高度保守區域。遵循引物設計的原則,利用生物學軟件Primer Premier 6.0設計簡并引物Sxl-F/R(表1),擴增獲得Sxl基因的部分cDNA片段。基于獲得的SxlcDNA的中間序列,按照SMARTerTMRACE(TaKaRa,大連)試劑盒要求,用Primer Premier 6.0設計用于擴增SxlcDNA 5′端的特異性引物Sxl5′R1/2 (Kit)以及3′端的特異性引物Sxl3′F1/2 (Kit) (表1)。根據試劑盒的方法擴增3′、5′末端未知序列。
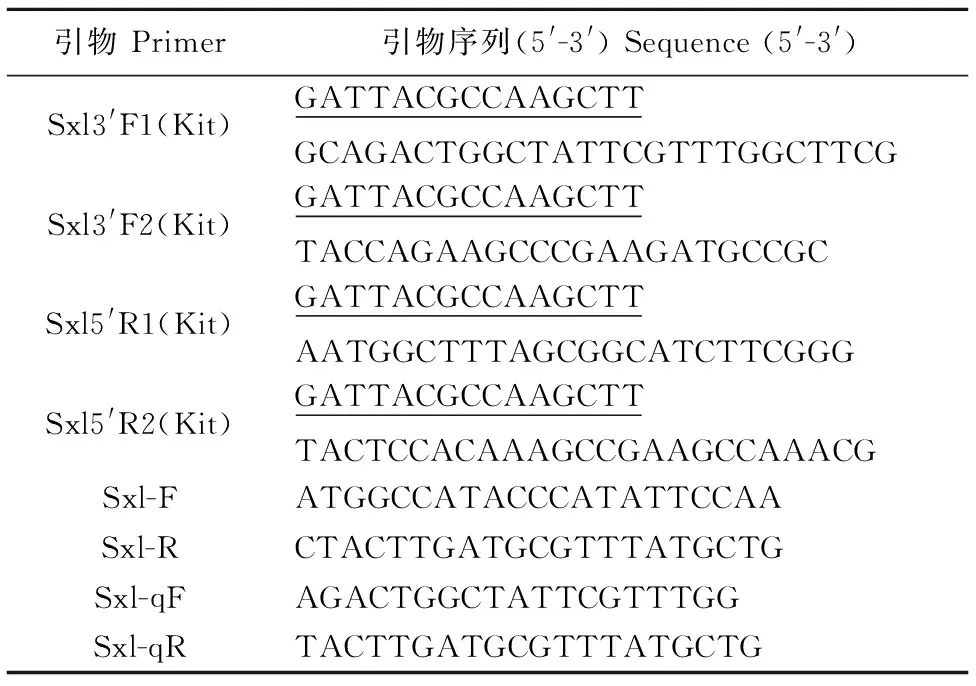
表1 試驗所用引物序列 Table 1 Sequence of different primers used in this experiment
1.4 序列分析
使用Seqman軟件對序列進行拼接,得到SxlcDNA全長。用在線生物軟件Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)將獲得的全長與其他物種的Sxl序列進行比對,用ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder/)預測其ORF區,用DTU Bioinformatics (http://www.bioinformatics.dtu.dk/)和ExPASy(https://web.expasy.org/compute_pi/)推導其氨基酸序列結構特點,并分析其蛋白質分子質量和等電點,通過SMART在線軟件(http://smart.embl-heidelberg.de/)預測結構域。使用DNAMAN軟件的Clustal W對各物種的Sxl氨基酸序列(表2)進行比較分析。使用MEGA 5.1構建系統進化樹(鄰接法),其中分支節點值(bootstrap-value)設置為1 000次重復抽樣試驗,檢驗各節點的置信度。
1.5 熒光定量PCR
基于已獲得的PcSxlα、PcSxlβ、PcSxlγ和PcSxlδ4種轉錄異構體序列的保守區域,遵循引物設計原則,利用Primer Premier 6.0設計熒光定量PCR引物Sxl-qF/R(表1),使用SYBR?PremixExTaqTMⅡ熒光染料試劑(TaKaRa,大連),以及Quant Studio 6熒光定量PCR儀(Thermo Scientific,Waltham,MA,USA)對成年雌雄克氏原螯蝦各組織以及各發育階段的組織樣品中的Sxl表達情況進行定量分析。每個樣品重復3次,反應程序如下:95 ℃預變性10 min;95 ℃變性30 s;59 ℃退火45 s;72 ℃延伸30 s;40個循環。同時選用18S RNA為內參基因進行對照。
表2 序列比對及聚類分析所用Sxl氨基酸序列信息 Table 2 Information of Sxl used in sequence alignment and phylogeny analysis
使用2-△△Ct法分析克氏原螯蝦Sxl基因在不同組織及發育時期的相對表達情況。使用生物統計學軟件GraphPad Prism 7對數據進行統計分析,使用單因素方差分析和多因素方差分析的方法進行顯著性差異分析。P<0.05代表存在顯著性差異,P<0.01代表存在極顯著性差異。
2 結果與分析
2.1 克氏原螯蝦Sxl基因的序列分析
從雄性克氏原螯蝦精巢中擴增出了4個不同轉錄異構體的SxlcDNA序列,分別命名為PcSxlα、PcSxlβ、PcSxlγ和PcSxlδ,序列提交至Genbank數據庫,登錄號分別為MT680909~MT680912。其中,PcSxlα有102 bp 5′UTR、696 bp ORF(編碼231 aa)和392 bp 3′UTR;起始密碼子和終止密碼子分別為ATG和TAA,3′端有1個加尾信號AATAAA;預測的PcSxlα多肽的分子質量為25.75 ku,理論等電點pI為9.06。PcSxlβ有102 bp 5′UTR、648 bp ORF(編碼215 aa)和518 bp 3′UTR;起始密碼子和終止密碼子分別為ATG和TGA,3′端無加尾信號AATAAA,但有U元素富集區;預測的PcSxlβ多肽的分子質量為24.24 ku,理論等電點pI為9.13。PcSxlγ有102 bp 5′UTR、939 bp ORF(編碼322 aa)和1 128 bp 3′UTR;起始密碼子和終止密碼子分別為ATG和TGA,3′端有1個加尾信號AATAAA;預測的PcSxlγ多肽的分子質量為33.97 ku,理論等電點pI為9.25,有2個N-糖基化位點N283和N293。PcSxlδ有102 bp 5′UTR、717 bp ORF(編碼238 aa)和1 429 bp 3′UTR;起始密碼子和終止密碼子分別為ATG和TGA,3′端有1個加尾信號AATAAA;預測的PcSxlδ多肽的分子質量為26.59 ku,理論等電點pI為 9.36。這4種不同的PcSxlcDNA序列及編碼的氨基酸序列具體如圖1A所示。
如圖1B所示,這4種不同剪接方式的PcSxlmRNA具有相同的5′UTR及部分相同的ORF。PcSxlα、PcSxlβ、PcSxlγ與PcSxlδ相比,PcSxlα只有前729 bp與PcSxlδ相同,而圖1B中黃色方塊區域則是與PcSxlδ不同的序列;PcSxlβ缺失了2個片段,一段在PcSxlδORF,長度為69 bp,另一段在3′端,長度為914 bp;PcSxlγ缺失77 bp,缺失的區域包含PcSxlδ的部分ORF序列和部分3′端序列。

A: 4種不同的PcSxl cDNA序列及預測的氨基酸序列。圖中藍色陰影加下劃線為PcSxls的2個RRM結構域。B: PcSxl mRNA對比圖。 A: The nucleotide sequences and deduced amino acid sequences of PcSxl cDNA. The two RRM domains of PcSxl are indicated by blue shade with an underline. B: The comparison of PcSxls.
2.2 克氏原螯蝦Sxl氨基酸序列分析
在DANMAN軟件上,用Clustal W算法將測得的序列與其他物種的Sxl氨基酸序列和RRM結構域氨基酸序列分別進行多重比較分析,所得到的結果見圖2A。通過多序列比較分析發現,螯蝦類的Sxl氨基酸序列一致性高達75.76%;蝦蟹類的高達72.24%;而整個甲殼類的一致性則為68.98%。PcSxlα與紅螯螯蝦(Cheraxquadricarinatus)的Sxl4(CqSxl4)一致性達66.47%;PcSxlγ與CqSxl1的一致性高達87.54%;PcSxlδ與CqSxl3的一致性為69.83%;而PcSxlβ與CqSxl3的一致性只有63.2%。總的來說整個甲殼類的Sxl氨基酸序列較為一致。

A:甲殼動物Sxl氨基酸序列的多重比較。彩色背景標識的氨基酸殘基為保守性大于50%的氨基酸殘基。克氏原鰲蝦的Sxl氨基酸序列在圖中用紅色方框標出。 B:預測的PcSxl蛋白結構域。RRM表示RNA識別模體區,粉色方塊表示低復雜區。A: The multiple-sequence alignment analyses of deduced Sxl amino acid sequences in different crustaceans. The amino acid residues identified by color background in the figure are those whose conservation is greater than 50%. The P. clarkii Sxl amino acid sequences were shown in the red box. B:The predicted domains of PcSxls. RRM represents the region of RNA recognition motif,and the pink square represents the region of low complexity.
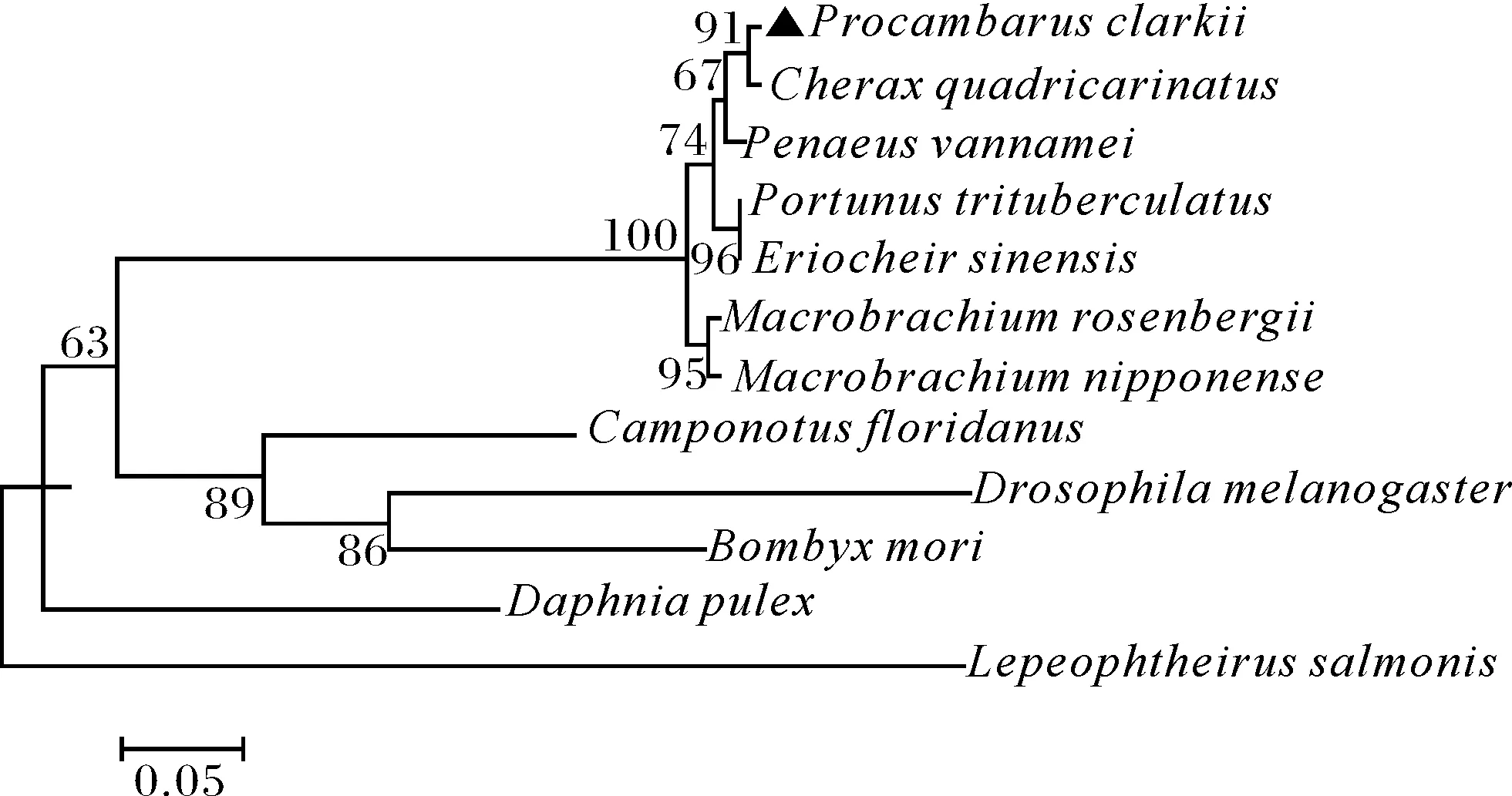
克氏原螯蝦的Sxl序列在圖中用黑色三角標出。The Sxl amino acid sequences of the red swamp crayfish were shown in black triangles.
如圖2B所示,在相同的ORF序列中,其對應編碼的氨基酸序列包含2個RRM結構域,即這4個PcSxl轉錄異構體擁有相同的RRM結構域,其中1個RRM結構域包含74個氨基酸,另1個包含76個氨基酸,2個RRM結構域之間還有12個氨基酸。
使用MEGA 5.1軟件對Sxl基因氨基酸序列進行系統進化分析,采用鄰接法構建系統進化樹,bootstrap-value設置為1 000次用于計算重復。構建的系統發育進化樹如圖3所示,其中,弗羅里達弓背蟻(Camponotusfloridanus)、黑腹果蠅(Drosophilamelanogaster)和家蠶(Bombyxmori)3種昆蟲聚為一支;淡水枝角水溞(Daphniapulex)和鮭瘡痂魚虱(Lepeophtheirussalmonis)又各聚為一支;整個蝦蟹類單獨聚為一支,而在蝦蟹一支中,又分枝為螯蝦類(P.clarkii和C.quadricarinatus)、對蝦類(P.vannamei)、沼蝦類(M.rosenbergii和M.nipponense)以及蟹類(E.sinensis和P.trituberculatus)。
2.3 克氏原螯蝦Sxl在成年雌雄不同組織中的表達分析
對成年雌雄克氏原螯蝦的腹部腹神經索(VN)、腦(Br)、眼柄(Es)、觸角腺(AnGl)、肌肉(Mu)、鰓(Gi)、血(Hem)、精巢(Te)、輸精管(TD)、促雄性腺(AG)、卵巢(Ov)等各組織的Sxl表達情況進行了分析。結果顯示,Sxl在所檢測的雄性和雌性組織中均有所表達,但不同的組織中存在著較大的差異(圖4)。
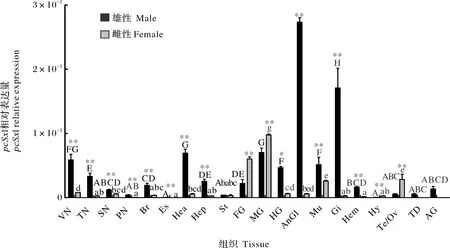
雌雄間的差異用“*”(P<0.05)和“**”(P<0.01)表示,各組織間的差異用標字母法表示(P<0.05)。VN:腹部腹神經索;TN:胸部腹神經索;SN:食道下神經節;PN:圍食道神經;Br:腦;Es:眼柄;Hea:心臟;Hep:肝胰腺;St:胃;FG:前腸;MG:中腸;HG:后腸;AnGl:觸角腺;Mu:肌肉;Gi:鰓;Hem:血;Hy:皮膚;Te:精巢;TD:輸精管;AG:促雄性腺;Ov:卵巢。The difference between males and females was marked by “*” (P<0.05) and “**” (P<0.01). Differences between tissues are indicated by alphabetical notation (P<0.05). VN:Ventral nerve cord; TN:Thoracic ventral nerve cord; SN:Subesophageal nerve; PN:Periesophageal nerve; Br:Brain; Es:Eyestalk; Hea:Heart; Hep:Hepatopancreas; St:Stomach; FG:Foregut; MG:Midgut; HG:Hindgut; AnGl:Antennary glands; Mu:Muscle; Gi:Gill; Hem:Hemocytes; Hy:Hypodermis; Te:Testis; TD:Testicular ducts; AG:Androgenic gland; Ov:Ovary.
從圖4中可以看出,PcSxl在成年雄性克氏原螯蝦的觸角腺和鰓中表達量最高,其次是心臟、中腸、腹部腹神經索、后腸及肌肉組織,其他各組織PcSxl表達相對較低,特別是在眼柄和皮膚中;PcSxl在成年雌性克氏原螯蝦的中腸中表達量最高,其次是前腸、肌肉和卵巢,而在其他組織中PcSxl表達相對較低,尤其是在圍食道神經、眼柄和血中。此外,PcSxl在胃中的表達水平不存在雌雄差異;在雌性的前腸、中腸、皮膚和卵巢中PcSxl的表達量極顯著高于雄性相應組織中PcSxl的表達量(圖4);而在觸角腺和鰓及其他組織中,PcSxl在雄性組織中的表達水平要高于雌性相應組織中PcSxl表達水平。
2.4 克氏原螯蝦Sxl在不同發育時期的表達分析
PcSxl在不同發育時期的表達模式如圖5所示,熒光定量PCR的結果顯示PcSxl在所檢測的發育時期中都有所表達,其在蚤狀幼體期的表達量達到高峰,出膜后的1~6 dPcSxl的表達水平量次之;并且從出膜后的第1天起其表達量整體呈現出下降趨勢;在出膜后第23天和第28天,雄性幼蝦的PcSxl表達水平顯著高于雌性PcSxl表達水平。
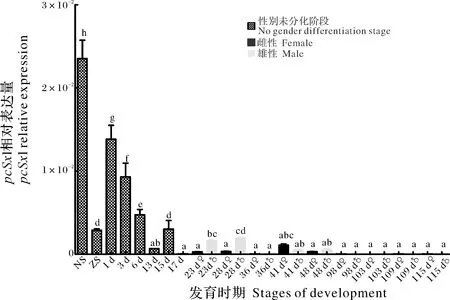
NS:無節幼體;ZS:蚤狀幼體;1~115 d:出膜后1~115 d。顯著性差異在圖中用標字母法表示(P<0.05)。NS:Nauplius stage; ZS:Zoea stage; 1-115 d:1-115 days after hatching. The significant differences are indicated by alphabetical notation (P<0.05).
3 討 論
Sxl在黑腹果蠅中可以通過性別特異性的剪接對體細胞的性別分化起到調控作用,但是在其他非果蠅的物種,如家蠶、地中海實蠅、中華絨螯蟹中,Sxl在雌雄兩性中均有表達,并且在mRNA和蛋白質表達水平上并沒有明顯的差異性。由此可見,Sxl的雌雄特異性剪接并不是普遍適用于其他非果蠅昆蟲[12-13]。在甲殼動物中雖然有關于在同一物種中Sxl不同剪接異構體的報道[7-8],如在羅氏沼蝦中發現4種Sxl異構體,紅螯螯蝦中發現4種,中華絨螯蟹和日本沼蝦中發現2種,而在南美白對蝦中報道有6種不同異構體的存在,但是卻還沒有關于其存在性別特異性剪接異構體的相關報道。雖然Sxl在不同的物種中存在著不同的轉錄異構體以及不同的功能,但是Sxl家族蛋白在不同生物體中具有較高的同源性,均具有2個保守的RRM結構域[14-15]。在本研究中,我們從克氏原螯蝦的雄性性腺中一共克隆了4種PcSxlcDNA序列,預測的氨基酸序列也具有2個保守的RRM結構域。由于這4種轉錄異構體的PcSxl有部分相同的序列,所以它們的RRM結構域也是相同的。在甲殼類氨基酸序列比對中發現,盡管Sxl家族蛋白在N-端和C-端部分沒有明顯的保守性,但RRM結構域的氨基酸序列都表現出較高的保守性,這也可以說明蝦蟹類處于同一個進化水平,系統進化樹顯示聚為一支。
4種PcSxl轉錄異構體cDNA的核苷酸序列大小順序為PcSxlα 克氏原螯蝦PcSxl在成年雄性觸角腺的表達量顯著高于雌性的,表現出性別二態性表達。在東方巖石龍蝦(Sagmariasusverreauxi)的2個性別發育相關基因SvTKIR和SvDmrt1的研究中發現,這2個基因在雌雄未成年蝦的觸角腺中表達水平均較高,而在成年蝦的觸角腺中的表達則表現出性二態性,雌性中的表達水平顯著高于雄性[16]。蝦蟹類的觸角腺的作用類似于哺乳動物的腎臟,具有排泄和調節滲透壓及離子濃度的功能[17]。有研究表明龍蝦的尿液中具有一些特殊的物質,可以傳達交配、聚合退敵、劃分領地及其他社會行為的化學信號[18-20]。如果觸角腺在克氏原螯蝦中參與了這些信號的調節過程,那么也就可以解釋Sxl基因在觸角腺中表現出性二態性表達的現象,但目前尚未見相關報道,還需進一步深入研究。 在成年雌雄克氏原螯蝦的眼柄中PcSxl的表達量均較低,這與中華絨螯蟹的EsSxl在眼柄中的表達情況相似,但是在摘除中華絨螯蟹的眼柄之后,EsSxl在雌性卵巢中的表達量下調,在雄性中出現上調的情況[7];除此之外,PcSxl在雄性精巢中的表達量要明顯低于雌性的卵巢,而在紅螯螯蝦中CqSxls的精巢表達量要顯著高于雌性卵巢,但其在紅螯螯蝦中并未表現出性別特異性[8]。PcSxl在無節幼體期表達量達到頂峰,但出膜后其表達量逐漸下降;出現性別分化之后,更是表現出性別表達差異。調控雄性性別分化的PcIAG基因則是恰恰相反,在出現性別分化前表達量都較低,但是在出膜第23天,出現性別分化時,其在雄性中的表達量達到最高[20]。由此推測,在早期性別發育中,PcSxl可能直接或間接正調控下游的性別分化基因PcIAG,從而影響克氏原螯蝦的性別分化。這些都可以說明克氏原螯蝦中PcSxl與其性別分化相關,但其具體作用機制仍有待進一步的探究與驗證。此外,本研究中各轉錄異構體的表達情況是否存在差異和存在不同的功能亦需要進一步的研究。

