磁弛豫生物傳感器在食品安全快速檢測中的應用研究進展
董永貞,吳紫荊,王知龍,陳翊平
華中農業大學食品科學技術學院,武漢 430070
傳統的檢測方法大多依賴于精密儀器,雖然測定準確、靈敏度高,但儀器價格高、難以便攜、操作復雜,從而限制了其在現場檢測中的應用[1-2]。因此,越來越多的科研工作者致力于研究快速、便捷、簡單的檢測手段,以期能夠有效監測食品安全問題以及實現臨床早期診斷,快速檢測技術應運而生。
近年來,各種快速檢測技術被報道,其中生物傳感器備受關注。生物傳感器是一種由物理、化學、生物等多學科交叉融合而發展起來的高新檢測技術,主要通過生物分子識別元件(如抗體、酶、核酸等)識別目標物,然后利用信號轉換器將其轉換為光、電、磁等易于捕獲識別的信號,進而實現目標物簡易高效分析的方法。因其檢測快速、自動化程度高、易于操作,生物傳感器已經在生物化學分析、食品安全檢測、環境監測等領域得到了廣泛應用,主要包括電化學生物傳感器、光學生物傳感器等[3-5],但這些生物傳感器大多仍然受到精密儀器、檢測經濟性、樣品基質干擾等方面的影響,其性能在快速檢測方面尚需進一步提高。磁弛豫(magnetic relaxation switching,MRS)生物傳感器是近年來多次被報道的生物傳感技術之一。MRS傳感器是以磁弛豫時間作為讀出信號,進行目標物定性定量的快速檢測技術,具有檢測快速、操作簡單、信噪比高、易于實現現場檢測等優點,是快速檢測領域最受關注的研究方向之一。本研究圍繞MRS傳感器的傳感機制、研究進展、應用領域等方面進行了介紹,并對MRS傳感器的發展進行了展望,以期能夠促進快速檢測技術的進一步發展。
1 磁弛豫生物傳感器介紹
磁弛豫生物傳感器(MRS)的發展開始于磁納米顆粒介導的水分子弛豫時間縮短現象的發現。在物理學上,弛豫指的是某種平衡狀態被破壞后,又恢復到平衡態的過程,用弛豫時間來衡量弛豫過程的快慢。在核磁共振中,弛豫過程分為縱向弛豫(又稱為自旋-晶格弛豫)和橫向弛豫(又稱為自旋-自旋弛豫),分別用縱向弛豫時間(longitudinal relaxation time,T1)和橫向弛豫時間(transverse relaxation time,T2)進行衡量。2002年, Weissleder課題組[6]首次報道了磁弛豫現象,當超順磁納米顆粒(superparamagnetic nanoparticles,MNPs,簡稱為磁顆粒)在水溶液中的狀態(分散或聚集)發生變化時,能夠引起其局部磁場均勻性發生改變,形成非均勻局部磁場,而不均勻磁場可加快周圍水分子質子的橫向弛豫速度,進而縮短橫向弛豫時間[7-11]。目前,磁弛豫時間傳感現象以及相應傳感器的開發仍是研究的熱點之一。基于對磁弛豫傳感現象的深入研究,各式各樣的MRS傳感器被開發和完善并廣泛應用于食品安全檢測、臨床診斷分析、環境監測等領域[12-16](圖1),配合便攜式的微型核磁共振儀,可實現現場快速檢測。
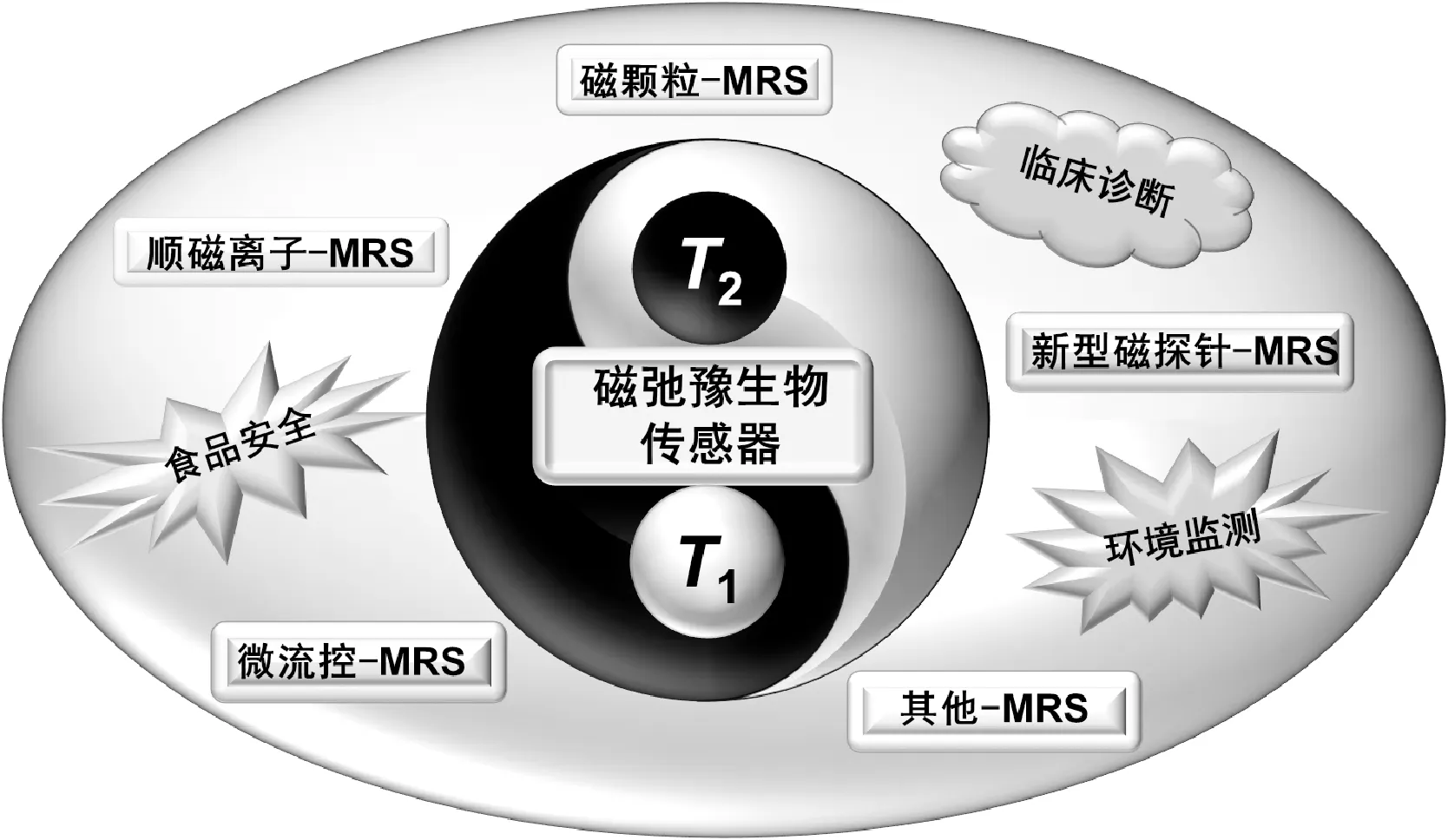
圖1 磁弛豫生物傳感器分類及其應用
2 磁弛豫生物傳感器分類
2.1 磁顆粒介導的MRS
1)基于磁顆粒狀態改變的MRS。基于磁顆粒狀態改變的MRS的基本原理是將磁顆粒進行表面修飾,在其表面偶聯上給體/受體(例如抗原/抗體、生物素/鏈霉親和素、適配體等),從而制備成特異性磁信號探針,在檢測分析過程中通過給體-受體的特異性識別作用導致其狀態由分散變成聚集,從而產生磁弛豫傳感現象(狀態的改變會影響局部磁場的均勻性,周圍水分子擴散經過這些不均勻磁場時導致質子橫向弛豫加速,縮短橫向弛豫時間(T2)[17-21],其中,磁探針狀態改變的程度、T2的改變量均與樣品中目標物含量成正相關,從而達到定量定性檢測的目的。
Perez等[22]率先構建了基于磁顆粒狀態改變的MRS免疫傳感器并用于與人類疾病密切相關的血清中皰疹病毒和腺病毒的快速靈敏檢測(圖2A)。該方法檢出限為5個病毒/10 μL血清(25%的蛋白),并且由于無需PCR擴增過程,有效提高了檢測效率,具有快速、高靈敏等優點。Kaittanis等[23]基于同樣的原理建立了檢測血清和牛奶中副結核鳥分枝桿菌(Mycobacteriumaviumspp.paratuberculosis,MAP)的磁免疫傳感方法,檢出限可達到15.5 CFUs(colony forming units,CFUs),遠遠低于其他傳統方法。MRS免疫傳感器有以下幾個優點:(a)分析速度快,因為磁顆粒的存在,檢測中可以通過磁分離而縮短分析時間;(b) 信噪比高,將磁顆粒作為磁信號探針,大多數樣品中的磁信號可以忽略不計,是一種均相免疫分析方法;(c) 特異性強,基于抗原與抗體的特異性結合,該方法具有良好的特異性;(d) 所需樣品量少。但傳統的MRS免疫傳感器由于是基于磁顆粒狀態的改變,磁信號只在一定范圍內和目標物的濃度成正相關,檢測的線性范圍較窄。此外,由于磁顆粒的狀態改變容易受到樣品基質等多因素的干擾,產生非特異性聚集,導致方法的穩定性較差。
為解決傳統基于磁顆粒狀態MRS的局限性,科研工作者開展了大量的工作。其中,采用新型的磁顆粒聚集介導信號放大策略能夠有效提高生物傳感器性能。Chen等[24]構建了一種基于磁/銀納米粒子自組裝的磁弛豫生物感應分析方法,并用于氯霉素(chloramphenicol,CAP)的高靈敏檢測。氯霉素是一種可以人工合成的廣譜性抗生素,濫用的CAP能夠通過食物鏈在人體富集,并產生細菌耐藥性、降低免疫力等嚴重危害[25]。我國農業農村部早在2003年第235號公告中就將CAP及其鹽、酯類列入禁用藥物,并明確規定在所有動物性食品中不得檢出CAP。該方法的原理是基于競爭性免疫反應,不同濃度的氯霉素競爭結合不同量的堿性磷酸酶(alkaline phosphatase,ALP)標記的單克隆抗體(alkaline phosphatase-antibody,ALP-Ab),ALP-Ab中的ALP能夠催化抗壞血酸酯去磷酸化,產生具有還原性的抗壞血酸鹽,進而將銀離子還原為銀納米顆粒,磁納米顆粒進一步在其表面組裝形成磁/銀納米粒子,使磁顆粒由原先的單分散狀態變為聚集狀態,導致T2信號的變化,從而對目標物進行定量分析。在本方法中ALP的催化放大作用及銀顆粒引導的信號產生和讀出機制,有效提高了磁弛豫傳感器的靈敏度。與傳統MRS免疫傳感器相比,此傳感器的靈敏度提高了50倍,分析性能良好,在有害小分子檢測方面具有良好的潛力。
2)基于磁顆粒數量變化的MRS。基于磁顆粒數量變化的MRS是一種新型的磁弛豫生物傳感分析方法。其基本原理是基于大小不同的磁顆粒在同一磁場中的分離速度的差異,將大粒徑的磁顆粒作為免疫磁分離的載體,小粒徑的磁顆粒作為磁信號探針,通過修飾有給體/受體的載體特異性識別修飾有受體/給體的磁顆粒,經磁分離等操作后,使磁探針數量發生變化,從而實現生物傳感。相對于基于磁顆粒狀態改變MRS,該類型傳感器不需要誘導磁顆粒的聚集,有效提高了MRS的穩定性。此外,T2信號對磁探針的濃度的改變更為敏感,具有更高的響應,有效提高了MRS傳感器的靈敏度。
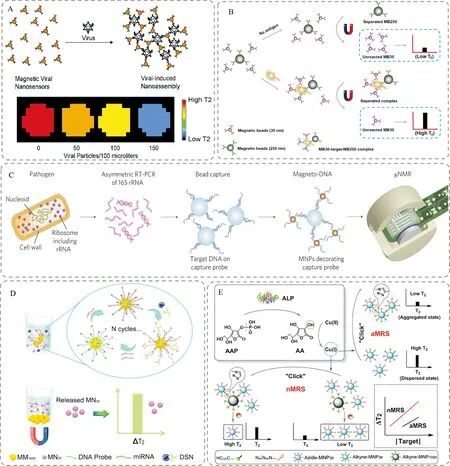
圖2 磁顆粒介導的MRS生物傳感器
關于磁顆粒數量變化介導的MRS生物傳感器的研發,國內外均有此方面的報道。Chen等[26]將磁分離(magnetic separation,MS)與MRS相結合,構建了一種基于磁顆粒數量變化的MRS生物傳感平臺,并成功應用于致病菌與病毒的快速檢測(圖2B)。該方法主要基于大粒徑磁顆粒(250 nm磁顆粒,MNP250)與小粒徑磁顆粒(30 nm磁顆粒,MNP30)在小磁場(0.01 T)中具有不同的分離速度,MNP250由于具有高飽和磁化強度,能夠在1 min內被0.01 T磁場快速分離,而MNP30由于飽和磁化強度較低,在相同條件下,60 min尚不能磁分離完全。Chen等[26]將MNP250作為磁分離的載體并偶聯捕獲抗體,將MNP30作為磁信號探針并偶聯檢測抗體,當目標物存在時,經過特異性免疫反應能夠形成MNP250-目標物-MNP30雙抗夾心結構。由于磁分離速度的不同,可以輕易地將MNP250-目標物-MNP30與反應體系中未反應的MNP30分離,從而獲得未反應的MNP30,對其進行T2信號測定,實現定量分析。該方法集樣品富集、提取、檢測一步完成,整個免疫分析過程能夠在30 min內完成,操作簡單,靈敏度高,具有良好的快速檢測的潛力。此外,2013年,Chung等課題組[27]基于磁顆粒-DNA探針,結合分子雜交實驗,構建了臨床樣品中致病菌的生物傳感器分析系統(圖2C)。此工作通過RT-PCR技術對所提取RNA的目標區域進行特異性擴增,得到大量的單鏈DNA,此DNA能夠被偶聯有寡核苷酸捕獲探針的聚合微球所捕獲,得到聚合微球-DNA,聚合微球-DNA進而與偶聯有檢測探針的磁顆粒(MNP)結合,得到聚合微球-DNA-MNP,由于大量MNP結合到聚合微球上,可顯著降低周圍水分子的T2值。該方法實現了三步信號擴增:(1)PCR擴增;(2) 聚合微球對目標核酸分子的捕獲與富集;(3) 磁信號擴增。該方法穩定快速,能夠在2 h內同時診斷臨床標本中的13種細菌。更重要的是,其課題組所使用的微型核磁共振儀為快速檢測提供了有力的工具。Lu等[28]構建了一種基于磁顆粒數量變化的MRS生物傳感方法,并將其用于微小RNA(MicroRNA,miRNA)的高靈敏定量分析(圖2D)。miRNA是一種小的、非編碼的RNA分子,由大約22個核苷酸組成,參與基因表達的轉錄和調控。miRNA的異常表達可能導致DNA擴增或易位,導致腫瘤增生或轉移,其快速準確檢測能夠為臨床診斷及癌癥治療提供重要的參考依據[29]。此工作組裝了一種“大磁顆粒-DNA-小磁顆粒”(MM1000-DNA-MN30)磁探針,當目標miRNA存在時,雙鏈特異性核酸酶(DSN)能夠特異性切割通過雜交生成的DNA-RNA異源雙鏈核酸分子,從而引導miRNA和MN30的釋放,釋放的MN30通過不同粒徑磁顆粒分離速度的不同與磁探針進行分離,最后對上清液中MN30的進行定量分析。與傳統MRS相比,此方法能夠在目標物存在的情況下,直接釋放MN30,并將其作為信號源進行信號讀出,是一種信號打開的方式,穩定性良好。此外,釋放的miRNA又可以作為目標物進行新一輪的雜交反應,釋放MN30,使得信號放大,顯著提高傳感方法的靈敏度,能夠實現尿液樣品中miR-21高靈敏的一步檢測(5 fM),在臨床即時診斷方向具有良好的應用前景。
3)磁顆粒狀態與數量同時變化的MRS。在檢測農獸藥殘留等小分子有害物質時,農獸藥小分子通常只有1個可以和抗體特異性結合的位點,引起的磁信號改變微弱,導致傳統MRS靈敏度無法對小分子目標物實現痕量檢測。為了解決此問題, Zheng等[30]構建了一種基于生物正交反應進行信號級聯放大,集磁顆粒狀態與數量變化于一體的MRS傳感平臺,并將其用于農藥殘留毒死蜱的痕量分析。毒死蜱因其廣譜性,已成為農業生產中廣泛使用的有機磷殺蟲劑。然而,長期接觸有機磷農藥會對人體神經系統、生殖系統和免疫系統造成損害,對人體健康構成嚴重威脅[31]。在本方法中,毒死蜱分子會與MNP1000-BSA-毒死蜱競爭性結合二苯并環辛炔(DBCO)修飾的單克隆抗體(Ab-DBCO),得到的“MNP1000-BSA-毒死蜱-Ab-DBCO”復合物上具有多個DBCO位點,能夠捕獲大量的azide-MNP30(DBCO能夠與疊氮化物(azide)發生生物正交反應),通過磁分離效率的不同可得到未反應的azide-MNP30(磁顆粒數量變化),通過加入生物交聯劑DBCO-PEG4-DBCO進一步誘導DBCO和疊氮化物基團之間的生物正交反應使分散的azide-MNP30聚集(磁顆粒狀態變化)。試驗結果表明,該傳感器能夠實現對毒死蜱0.1~1 000 ng/mL的定量檢測,檢出限為0.05 ng/mL。該傳感器的高效與高靈敏主要得益于:(1) 疊氮化物與DBCO的生物正交反應具有快速、高選擇性的特點,是實現信號放大而不引入交叉反應的重要手段,特別是在復雜樣品中;(2) 單一抗體對azide-MNP30顯示出多個DBCO位點,這將增大由單個靶標誘導MNP30的結合量,從而使信號放大;(3) 生物交聯劑DBCO-PEG4-DBCO誘導的azide-MNP30聚集,使傳感信號進一步放大。該傳感器通過生物正交反應將MNPs數量變化引起的信號放大與MNPs狀態變化引起的信號放大有機結合起來,實現磁信號的級聯放大,有效提高了生物傳感器的靈敏度和檢測范圍。
Wu等[32]利用堿性磷酸酶介導的點擊化學反應作為信號轉化與放大系統,構建了雙重模式的MRS生物傳感器。該工作通過Cu+催化疊氮化物和炔的1,3-偶極環加成的點擊化學反應(CuAAC)誘導磁顆粒的狀態變化或調節磁探針數量變化。如圖2E所示,當小分子目標物存在時,包被在96孔板上的目標物-BSA能夠與目標物競爭性結合單克隆抗體(Ab),洗滌并加入堿性磷酸酶(ALP)標記的羊抗小鼠IgG,可得到與目標物成反比的“BSA-目標物-Ab-IgG (ALP)”。ALP能夠將磷酸化抗壞血酸(AAP)去磷酸化,生成具有還原性的抗壞血酸(AA),能夠將Cu2+還原為Cu+,進而用于CuAAC點擊化學反應,使修飾有疊氮分子(azide)的磁顆粒與修飾有炔分子(alkyne)的磁顆粒聚集。該MRS生物傳感器分為2種模式(aMRS和nMRS):aMRS模式是基于MNP30-azide與MNP30- alkyne經CuAAC催化變為聚集狀態,產生T2信號變化;nMRS是基于MNP30-azide與MNP1000-alkyne經CuAAC催化變為聚集狀態,進而通過磁分離得到未反應的MNP30-azide(磁分離速度不同),并對其進行T2信號讀出,此模式是基于磁顆粒數量的變化。研究結果表明,該傳感器能夠實現食品基質中獸藥殘留的快速高靈敏檢測,其線性檢測范圍為0.1~500 ng/mL,檢出限為0.02 ng/mL,并且所提供的雙模式分析有效拓寬了該生物傳感器的適用性與實用性,為食品安全領域中農獸藥殘留及其他領域中有害小分子的快速檢測提供了有力的工具。
2.2 順磁離子介導的MRS
在順磁離子溶液中,順磁離子含有的多個不成對電子能夠與氫質子發生空間偶極-偶極相互作用,從而改變水分子的縱向弛豫時間(T1)[10,33-35]。在此方面,筆者所在團隊進行了開創性的工作。不同價態的順磁離子通常具有不同的T1信號。以Fe2+/Fe3+為例,與Fe3+相比,Fe2+未成對電子較少,電子弛豫時間較短,具有較低的T1弛豫效率[36]。基于此性質, Chen等[37]首次將順磁離子(Fe2+/Fe3+) 作為磁信號探針,開發了一種通過氧化還原反應實現Fe2+/Fe3+價態轉換和改變T1信號的分析方法,并用于生化分析和免疫檢測(圖3A)。為了進一步提高該傳感器的靈敏度, Dong等[38]將Fe3+與SCN-之間的絡合反應引入Fe2+/Fe3+介導的MRS傳感器中,將Fe2+轉化為Fe3+引起的磁信號改變進一步放大,實現了對牛奶中四環素的準確分析和快速檢測(圖3B)。此外, Dong等[39]也將Cu2+/Cu+作為磁信號探針,基于 Cu2+和Cu+的轉換引起磁信號改變,并用水蘇二磺酸二鈉水合物(BCS)螯合Cu+,形成Cu+-BCS配合物,有效地解決了Cu+在水溶液中不穩定的問題,實現了對牛奶中磺胺類抗生素的檢測(圖3C)。但Fe2+/Fe3+和Cu2+/Cu+體系中,順磁離子本身都具有磁信號,導致背景值較高,靈敏度有待進一步提高。研究發現,Mn2+具有特別強的磁信號,而Mn7+沒有磁信號,因此 Mn2+/Mn7+是一個零背景的磁信號探針,同樣可以通過氧化還原反應實現 Mn2+和Mn7+的轉化。Wang等[40]以Mn2+/Mn7+磁信號探針構建了MRS免疫傳感器,并將其用于小分子目標物及致病菌的高靈敏檢測(圖3D)。其主要原理是將ALP標記到識別目標物的抗體上,基于競爭性免疫反應或雙抗夾心免疫反應,實現ALP與目標物的相關性關聯,該ALP可以將抗壞血酸酯去磷酸化,進而轉化為具有還原性的抗壞血酸,而抗壞血酸可以將Mn7+轉變為Mn2+,進而引起磁信號從無到有的改變,從而實現目標物的定量分析。試驗結果發現,相比于Fe2+/Fe3+-MRS和Cu2+/Cu+-MRS傳感器,Mn2+/Mn7+介導的MRS免疫傳感器靈敏度提高了兩個數量級。因為許多物質本身是氧化還原劑(例如,H2O2、抗壞血酸等)或經過酶促反應等生物化學反應轉化為氧化還原劑(例如,葡萄糖經葡萄糖氧化酶催化后產生H2O2)都能夠實現順磁離子的價態轉換,因此該類傳感器可以檢測一系列的目標物,并且可以結合免疫反應等方法對目標物進行分析,極大地拓寬了磁生物傳感器的應用范圍。此外,與基于磁顆粒的MRS相比,以順磁離子為磁信號探針的MRS傳感器具有良好的穩定性,順磁離子在水溶液中穩定性良好,避免了超順磁納米顆粒在復雜基質中易發生聚集的問題,抗干擾能力更強,且反應簡單快速,對環境要求低,是快速檢測領域一個新的開發點。
2.3 基于新型磁探針的MRS
構建新型的磁探針是提升MRS生物傳感器分析性能的有效方式。近年來,已有多篇關于新型磁探針的合成、表面修飾、可控組裝及相應MRS構建的報道[19,41-45]。Xianyu等[46]制備了不同磁信號強度的新型磁探針,實現了食品基質中不同限量標準(pg/mL~μg/mL) 抗生素的線性可調檢測(圖4A)。利用點擊化學反應將30 nm小磁顆粒組裝在不同粒徑聚苯乙烯微球(polystyrene beads,PS)表面,因為不同粒徑的PS微球表面偶聯的納米磁顆粒的數量不同,因此可以制備不同磁信號強度的磁探針。當目標抗生素存在時,能夠與“MNP-BSA-目標抗生素”競爭性結合偶聯單克隆抗體的磁探針(可調),經磁分離后可得到捕獲目標抗生素的磁探針,并對其進行T2信號測定。可根據目標抗生素的限量標準,選擇不同信號強度的磁探針,從而實現不同限量標準抗生素的線性可調檢測。該MRS免疫傳感方法最大的優點是采用不同粒徑的聚苯乙烯微球實現了整個方法線性范圍的可調(pg/mL~μg/mL),可以實現質量濃度范圍不同的多個目標物的檢測,具有檢測范圍寬、快速、靈敏等特點,在食品安全檢測、生物醫學診斷等方面具有廣闊的應用前景。
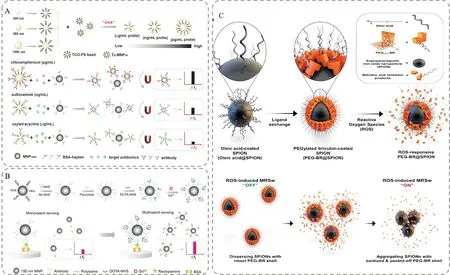
圖4 新型磁探針介導的MRS生物傳感器
為了實現高靈敏和快速檢測的有機統一, Xianyu等[47]近期構建了一種集磁分離與磁傳感于一體新型磁信號探針的MRS免疫傳感器(圖4B)。該工作首先將多聚賴氨酸和單克隆抗體(Ab)可控地組裝到納米磁顆粒(MNP150)的表面,得到具有多維空間網狀樹枝結構的“Ab-MNP150-多聚賴氨酸”偶聯物,然后將對Gd3+離子具有很好螯合性能的DOTA偶聯在多聚賴氨酸的表面,通過DOTA捕獲Gd3+,最終將大量的Gd3+離子螯合在MNP150表面,得到“Ab-MNP150-多聚賴氨酸-DOTA-Gd3+”多重信號放大的納米免疫磁探針。其中,Gd3+是具有強的磁信號的順磁離子[48],通過多聚賴氨酸可增加Gd3+的偶聯量為一重信號放大過程,磁顆粒與Gd3+磁信號的協同效應為多重信號放大過程。將該磁探針與競爭性免疫反應相結合,可實現小分子目標物的高靈敏檢測。與傳統的MRS免疫傳感器相比,靈敏度提高了25倍,在實際樣品的檢測中,和經典的高效液相色譜-質譜方法具有很好的吻合性。更為重要的是該磁信號探針同時可以作為免疫磁分離的載體,實現目標物的有效富集和快速檢測的一步完成,大大簡化了整個方法的操作步驟,提高了檢測效率,在快速檢測方面具有良好的潛力。
除上述可控組裝策略外,對磁顆粒進行表面修飾也是構建新型磁探針、提升傳感器性能的有效方式。Lee等[49]通過金屬配位將聚乙二醇改性的膽紅素(poly(ethylene glycol)-modified bilirubin (PEG-BR),PEG-BR)包被于超順磁性氧化鐵納米顆粒(SPIONs)表面,制備了PEG-BR@SPIONs磁探針,并用于活性氧(ROS)的檢測(圖4C)。其基本原理是:當ROS存在時,PEG-BR包覆層能夠被氧化為水溶性的PEG-膽綠素,并進一步被氧化為終產物,進而從SPIONs表面脫落。在生物環境中,由于吸引力和不穩定性,脫落包覆層的SPIONs相互聚集,產生狀態變化,從而實現ROS的定量分析。研究結果表明,PEG-BR@SPIONs磁探針具有高膠體穩定性,能夠實現生理學環境下ROS的高靈敏分析,在臨床診斷領域具有良好的應用前景。隨著納米材料及納米科技的發展,新型納米磁探針將是磁弛豫生物傳感分析方向具有代表性的突破點之一。
2.4 微流控芯片MRS
微流控芯片技術又被稱為芯片上的實驗室(lab-on-a-chip),具有分析速度快、樣品用量少、自動化程度高、檢測成本低等優點,在生化分析、臨床診斷、公共衛生監測等方面應用廣泛[19,50-54]。Lee等[55]將微流控芯片技術、磁生物傳感技術與微型核磁共振儀結合開發了一種小型診斷磁共振(DMR)系統(圖5)。
該DMR系統主要包括四部分:用于核磁共振測量的微線圈陣列、用于樣品處理和混合的微流體網絡、微型核磁共振電子器件和用于產生極化磁場的永磁體。該系統將多個平面微線圈排列在一個陣列中,可實現多通道檢測,并能較好地適應器件的小型化;微流體系統便于控制小體積液體和實現目標物的分離富集。此外,該系統引入基于磁顆粒狀態改變的MRS,實現信號的放大與讀出。整個DMR系統可被設計為獨立便攜的設備,能夠實現細菌、蛋白生物標志物等目標物的快速檢測。此工作所開發的微型核磁共振儀為第一代產品(DMR-1),該課題組還對其進行了升級,例如第二代DMR系統(DMR-2)[56]、第三代DMR系統[57]等,在進樣體積、射頻磁場均勻性、溫度控制、便攜性等多方面進行了優化,拓寬了其應用范圍,在快速檢測方向具有良好的推動作用[58-59]。
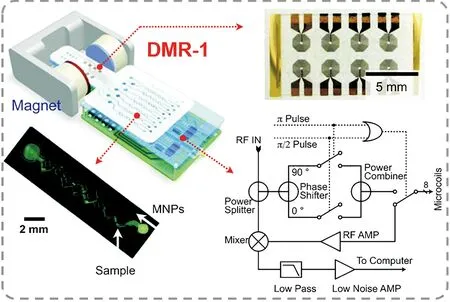
圖5 微流控芯片介導的小型診斷磁共振(DMR)系統
3 討論與展望
磁弛豫生物傳感器作為一種集物理、化學、生物等多學科交叉的新型分析技術,具有分析速度快、信噪比高、操作簡單等優點,基于不同原理的磁弛豫生物傳感器(例如基于磁顆粒狀態/數量變化的磁弛豫傳感器、基于順磁離子的磁弛豫傳感器等)已經應用于食品安全和臨床診斷等多個領域,對快速檢測技術的發展具有重要的推動作用。我們相信未來在以下幾個方面開展深入研究將會推動磁弛豫生物傳感器得到更廣泛的應用:
(1)開發新型磁納米探針。隨著納米科學技術的發展,各種納米材料層出不窮,為尋找和可控組裝性能優良的磁納米探針提供了有利的條件。此外,新型磁納米探針的開發能夠有效提高磁弛豫生物傳感器的信號讀出性能,拓寬磁弛豫生物傳感器在快速檢測領域的應用。
(2)多重目標物同時檢測及高通量檢測進一步發展。在臨床診斷、食品安全、環境監測等領域中均存在大量種類和數量的目標物需要快速檢測,開發多重目標物同時檢測和高通量的磁弛豫生物傳感器或基于磁弛豫生物傳感器的快速檢測平臺具有重要的現實意義。
(3)磁弛豫傳感器的自動化、智能化和便攜化。雖然已有基于微流控芯片的DMR系統的報道,但目前大部分磁弛豫生物傳感器在智能化、自動化、便攜化方面仍存在一定的不足,需要不斷與其他學科交叉融合,提高磁弛豫生物傳感器在此方面的性能。
(4)新型磁弛豫傳感機制的探索。新型的磁弛豫傳感機制是構建新型磁弛豫生物傳感器的基礎,能夠從根本上推動磁弛豫傳感技術的進一步發展,也是本領域研究人員需要持續關注的重點。

