西雙版納原始森林土壤中分離的兩株纖維素分解細菌的鑒定
余 萍,姚 斌,羅紅梅,李樹紅,張紹松*
(1.云南省農業科學院生物技術與種質資源研究所/農業部西南作物基因資源與種質創制重點實驗室/云南省農業生物技術重點實驗室,云南 昆明 650205;2.中國農業科學院飼料研究所,北京 100081)
【研究意義】農業生產中的生物質主要由纖維素、半纖維素、木質素等組成[1]。將農林廢棄物中木質纖維素作為原材料的生物質資源化利用越來越受到關注[2]。中國農作物秸稈種類多、總量大,是世界第一大秸稈產出國[3]。農作物秸稈中主要構成成分是纖維素、半纖維素等。目前,國內外對農作物秸稈生物質的資源化利用途徑主要包括:作為能源的熱裂解技術[1]和水熱液化技術[4];肥料化技術和飼料化技術。其中,肥料化技術是農作物秸稈生物質資源化利用的核心[5]。纖維素、半纖維素是農作物秸稈廢棄物生物質的主要成分,將其發酵腐解、肥料化利用,需構建高效分解生物質纖維素的微生物株系及其發酵工藝,因而,發掘高效降解的微生物株系是肥料化利用核心的關鍵。纖維素是構成植物體重要成分之一,農林牧生產過程中的林木、草和農作物的秸稈中含有大量的纖維素、半纖維素、木質素等。中國可開發的生物質資源總量約為7億t左右標準煤,其中農作物秸稈約占50%以上[6]。木質纖維素是地球上可再生有機質和廉價的重要能源[7]。農業生產中每年產生大量的作物秸稈,2006年中國生產的糧食作物秸稈約4.89億t,且總體上呈現逐年增加的趨勢[8]。這些秸稈中含有豐富的纖維素資源,約占生物質資源總量的38.9%[9],然而大部分卻沒有充分的利用,直接以焚燒、廢棄的方式進行處理,這不僅給環境造成了嚴重的污染,也是一種資源浪費。傳統的降解木質纖維素方法易產生有害化學物,故常用酶法或與酶結合的方法進行降解[10]。利用微生物產生的纖維素酶來催化降解秸稈是最經濟環保的生物降解方法。微生物降解過程中無二次污染,加快秸稈的腐熟進程,腐熟秸稈可作為肥料施用,不僅排除了因施用化學肥料引發的環境污染,也可間接增加農民收入。【前人研究進展】降解纖維素的微生物,目前報道較多的是真菌,常具有較高的胞外纖維素酶活性,如木霉屬(Trichoderma)[11]、曲霉屬(Aspergillus)[12]和青霉屬(Penicillium)[13-15]等。據統計,國際纖維素酶市場上有20%的纖維素酶來自木霉屬和曲霉屬[16]。近年來,有關細菌產生纖維素酶方面的報道也較多,如高效降解纖維素的枯草芽孢桿菌(Bacillussubtilis)[17-19]、解淀粉芽孢桿菌(B.amyloliquefaciens)與貝萊斯芽孢桿菌(B.velezensis)[20]、短小芽孢桿菌(B.pumilus)[21]以及纖維單胞菌(Cellulomonassp.)[22]等細菌。可見,有關微生物降解木質纖維素方面的研究是該領域的研究熱點之一。農作物秸稈中除了含有纖維素主要成分外,同時含有其它的化學成分。通過多種微生物菌系組合,產生多種酶系,可提高微生物對秸稈的降解效果[23-24]。然而,發掘具有高效降解能力的單一菌株是基礎,通過高效降解菌株之間的組合,才能研發更高效的降解組合。【本研究切入點】孟侖石灰山國家級自然保護區位于云南省西雙版納傣族自治州,森林資源豐富,長期積累覆蓋大量枯枝落葉,在自然環境中受微生物作用被分解,這種環境有利于纖維素分解菌的自然富集,更易獲得具有纖維素酶高活力的微生物。【擬解決的關鍵問題】本研究從海拔584 m的孟侖石灰山(21°54′8.1″N,101°16′59.3″E)附近的原始森林腐殖土壤中分離微生物,并篩選高效分解纖維素的菌株,旨在挖掘產生纖維素酶的微生物資源,為農作物秸稈等廢棄生物質纖維素的降解提供潛在生產菌,對廢棄物的資源化利用具有重要意義。
1 材料與方法
1.1 試驗材料
1.1.1 樣品的采集 選擇西雙版納孟侖石灰山國家級自然保護區內腐木及枯枝落葉腐爛程度高的地區為采集地點,采集5 cm以下的表層土壤樣品,采集的樣品處置方法同文獻[25],放入自封袋中。然后放入低溫冰盒運回實驗室,置于4 °C冰箱保存備用。
1.1.2 培養基 篩選培養基:CMC-Na 5.0 g,NH4NO31.0 g,酵母粉 1.0 g,MgSO4·7H2O 0.5 g,KH2PO41.0 g,瓊脂15.0 g,加H2O溶解,定容至1 L。
LB培養基:制備LB培養基的各組分比例與方法同文獻[25],固體培養基中加入2%的瓊脂粉。
1.1.3 主要儀器和試劑 PCR 擴增儀、恒溫培養箱DHP-600、恒溫振蕩器TL-C、超凈工作臺SW-CJ-1F、紫外凝膠成像系統Genegenius、顯微鏡SZH10、分光光度計DU730等儀器的生產產家參見文獻[25];合成引物的公司同文獻[25](細菌16S rDNA的通用引物27f:5’-AGAGTTTGATCCTGGCTCAG-3’和1492r:5’-GGTTACCTTGTTACGA CTT-3’);提取細菌基因組DNA的試劑盒、TaqDNA聚合酶、dNTP、瓊脂糖等試劑;以及酵母膏、蛋白胨、NaCl等試劑的來源與文獻[25]中同種試劑的來源相同。
1.2 試驗方法
1.2.1 菌株的分離純化 本試驗采用稀釋平板法分離和純化:在超凈工作臺上稱取10 g土樣,加入盛有100 mL無菌水、并裝有玻璃珠的三角瓶中,置于30 ℃搖床150 r/min震蕩30 min,吸取1 mL菌懸液,用無菌水進行濃度梯度稀釋,從稀釋倍數為10-3、10-4、10-5、10-6的菌懸液中分別吸取200 μL,依次涂布在平皿中LB固體培養基上,方法同文獻[25],然后將培養皿置于恒溫培養箱中,30 ℃培養3 d。挑選出在培養基上生長良好的單菌落,進一步在LB固體培養基上劃線培養與純化。
1.2.2 分解纖維素菌株的篩選 采用剛果紅染色法篩選具有分解纖維素活性的菌株。將上述分離純化的菌株接種至CMC-Na固體培養基平板上,30 ℃恒溫培養3 d后,用0.1%的剛果紅水溶液浸染30 min,棄染液,再用1 mol/L的NaCl水溶液脫色1 h,棄脫色液,用游標卡尺測量菌落直徑(用d表示,單位cm)和水解圈直徑(用D表示,單位:cm),以Dp表示水解能力:Dp=D/d。
1.2.3 菌株的細胞形態及生理生化特性鑒定 挑取每個具有水解圈菌株的單菌落,在載玻片上涂片,置于光學顯微鏡下觀察菌株的細胞形態,并按照《伯杰細菌鑒定手冊》[26]和《常見細菌系統鑒定手冊》[27],進行生理生化反應方面的鑒定。
1.2.4 具有分解纖維素活性菌株的16S rDNA分子鑒定 采用細菌基因組DNA提取試劑盒,分別對具有分解纖維素活性的菌株進行基因組DNA的提取,并對提取的DNA樣品進行瓊脂糖凝膠(1%)電泳檢測和凝膠成像系統檢測,拍照。采用細菌16S rDNA 的2個通用引物,以提取的各菌株基因組DNA樣品分別作為模板,進行PCR擴增反應與檢測。PCR反應體系、反應條件、電泳檢測和膠回收等方法參見文獻[25]。反應體系為 50 μL,其中2 μL模板DNA,1 μLTaqDNA聚合酶,4 μL dNTP,1 μL引物27f,1 μL引物1492r,5 μL的10×Buffer,36 μL ddH2O。擴增反應條件為: 95 ℃預變性 5 min;95 ℃變性50 s,59 ℃退火50 s,72 ℃延伸1 min;38個循環,72 ℃最終延伸10 min,4 ℃保存。經檢測和拍照后,膠回收的DNA片段送至上海立菲生物技術公司進行測序。
經測序獲得的16S rDNA序列,進一步與NCBI數據庫中已有的16S rDNA核酸序列進行BLAST同源性分析,方法與文獻[25]相同。在比對結果中,尋找16S rDNA基因序列高度同源的近緣種,采用MEGA 5.0軟件,進行多重序列比對分析,通過Neighbour-Joining法構建系統發育樹,采用 Bootstrap對進化樹進行 1000 次可信度分析。
2 結果與分析
2.1 纖維素分解菌的分離與篩選
對西雙版納原始森林5個不同地方采集的樣品經LB培養基分離純化后共獲得34株細菌,依次編號為BN-1~BN-34。將這些菌株轉接到纖維素篩選培養基上培養3 d,經剛果紅染色與脫色后,共有5株細菌產生較為清晰的透明圈(圖1),分別為:BN-6、BN-9、 BN-17、 BN-22和BN-33菌株。從圖1和表1可以看出,BN-22菌株的纖維素分解能力最強,其次為BN-9菌株,BN-33菌株的降解纖維素能力最弱。采用游標卡尺進一步測量各菌株的透明圈直徑(D)與菌落直徑(d),并計算兩者比值,結果見表 1。可見,BN-22菌株的D/d值最大。
2.2 具有分解纖維素活性菌株的形態特征及生理生化特性
光學顯微鏡下觀察5個菌株在LB培養基上的菌落形態如圖2所示。BN-6菌株的菌落中央部位凹陷,表面粗糙,邊緣不規則。BN-9菌株的菌落中央凸起,邊緣光滑整齊。BN-17菌株的菌落邊緣不規則。BN-22菌株的菌落表明光滑,有不規則凸起形狀,邊緣光滑整齊。BN-33菌株的菌落中央部位凹陷,表面粗糙,邊緣不規則。將具有分解纖維素活性的5個株菌進行革蘭氏染色觀察,5個菌株均呈陽性,并且均產芽孢(圖3),表明具有分解纖維素活性的5株細菌分離物均為芽孢桿菌屬(Bacillus)的種。5個菌株的甲基紅、V-P實驗和苯丙氨酸脫氨酶均為陰性,接觸酶、明膠液化實驗和精氨酸雙水解均為陽性。BN-33菌株的脲酶為陽性外,其余4個菌株均為陰性。BN-9和BN-17菌株的葡萄糖發酵為陰性,BN-6、BN-22和BN-33菌株為陽性。5個株菌的各項生理生化特征見表2。
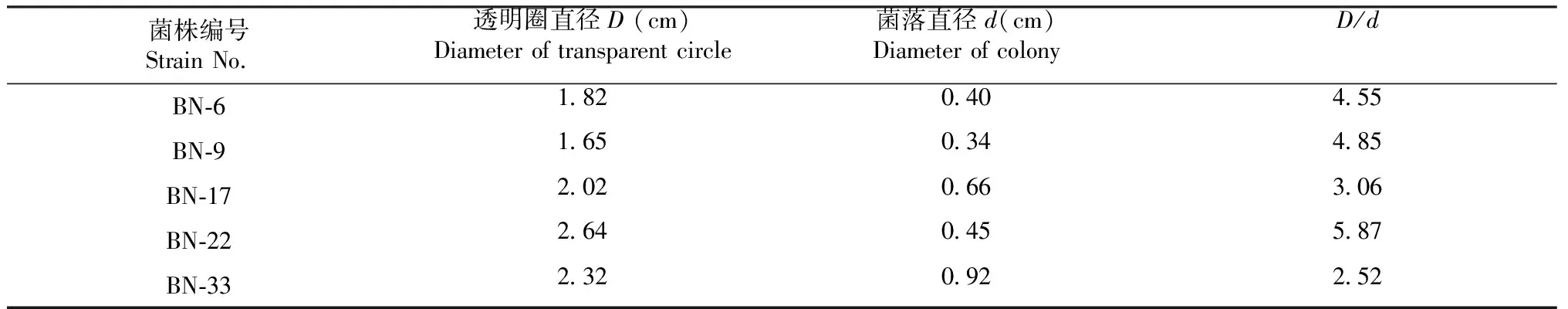
表1 纖維素降解菌株的水解圈與菌落直徑比值
2.3 具有分解纖維素活性菌株的16S rDNA鑒定
分別以5個菌株的基因組DNA為模板,采用16S rDNA的通用引物進行PCR 擴增反應,獲得長度約為1500 bp的片段(圖4),進一步回收5個菌株的PCR擴增片段DNA,測定每個菌株約1500 bp擴增片段的DNA序列,并將獲得的5個菌株的16S rDNA基因序列分別在NCBI 數據庫中BLAST 比對,發現菌株BN-6菌株、BN-9菌株、BN-17菌株和BN-33菌株與數據庫中的多種芽孢桿菌屬(Bacillus)的序列相似性均為99%,BN-22菌株與沙福芽孢桿菌(B.safensis)和短小芽胞桿菌(B.pumilus)序列相似性均為100%。每個菌株與對應親緣關系較近的3株細菌的16S rDNA基因序列,與文獻[25]
中方法相同,采用MEGA 5.0軟件進行多重序列比對分析,用Neighbour-Joining法構建系統發育樹(圖5)。結果顯示,5個菌株可分在2個不同的進化分支上,BN-6、BN-9、BN-17和BN-33菌株為一個分支,BN-22菌株另為一個分支。結合生理生化VP實驗陰性結果,說明BN-22菌株為沙福芽孢桿菌。BN-6、BN-9、BN-17和BN-33菌株不屬于枯草芽孢桿菌(B.subtilis)或蠟狀芽孢桿菌(B.cereus)。BN-9菌株的菌落為黃色,結合其它試驗結果和16S rDNA的系統發育樹分析,該菌株為吉氏芽孢桿菌(B.gibsonii)。根據培養特征、生理生化特征及16S rDNA序列的分析結果,推測BN-6、BN-17和BN-33菌株為嗜熱脂肪芽孢桿菌(B.stearothermophilus)、解淀粉芽孢桿菌(B.amyloliquefaciens),特基拉芽孢桿菌(B.tequilensis),甲基營養型芽孢桿菌(B.methylotrophicus)等幾種菌中的屬種,有關這幾株細菌在分類上的屬種尚需進一步研究和鑒定。
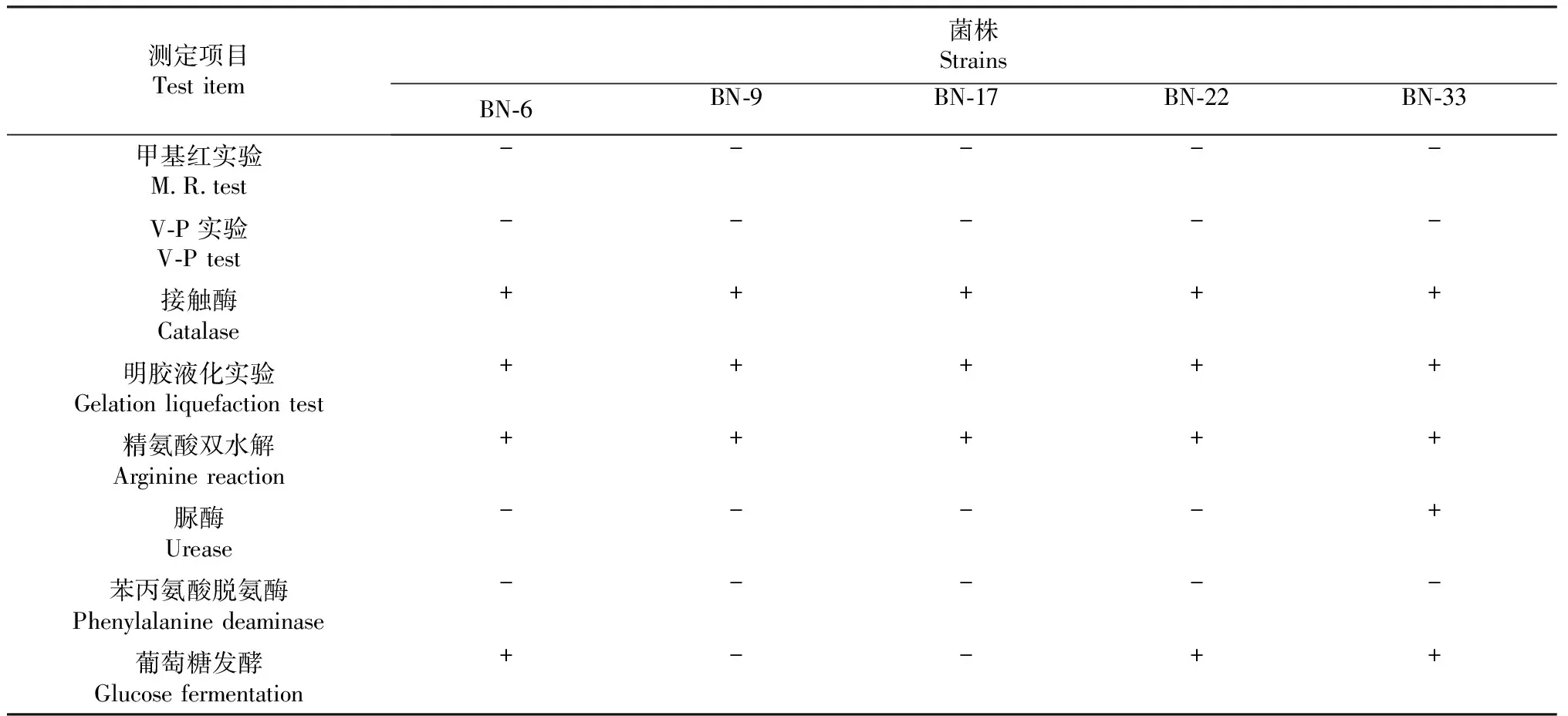
表2 具有分解纖維素活性菌株的生理生化特征
3 討 論
不同類型的生態環境中分布有相應的微生物類群,如:邱秀文等[14]從秸稈還田環境中分離篩選到纖維素分解菌;張喜慶等[19]從自然發酵的牛糞分離獲得高效分解纖維素的分解菌;Varghes等[28]從白蟻腸道和蟻穴分離到分解纖維素的格蘭氏陽性菌株等。本研究在云南省西雙版納州的孟納石灰山原始森林區域,分離獲得的具有分解纖維素活性的菌株,與已報道的同屬種菌株的功能存在差異。如:張知曉等[29]報道的沙福芽孢桿菌(B.safensis),所關注的是抑菌特性,尚未報道菌株的分解纖維素活性;本研究中分離獲得具有分解纖維素高活性的吉氏芽孢桿菌(B.gibsonii),陳錚等[30]報道了該菌的發酵液中含有來氟米特,未報道其所分離菌株對纖維素的分解特性。本研究分離獲得的5株細菌,其中2株已鑒定其屬種,3株細菌初步鑒定其為芽孢桿菌類群,但明確的屬種分類尚待進一步研究,便于發掘利用其功能。
同時,通過篩選、分離獲得的微生物菌株,需進一步明確微生物產生的分解酶類別。本研究中采用的CMC-Na纖維素作為底物,篩選和檢測所分離菌株的纖維素酶活性,是纖維素酶活檢測的常用方法。通過分離與篩選獲得的5株芽孢桿菌,需進一步對其產生的纖維素酶類別和濾紙酶活性進行定性與定量的檢測,以便發掘和利用菌株的生物學功能,更好地應用于生產。
生態環境不同,其分布的微生物類群亦存在差異。在腐解生物質的角度,不同林木、草、或秸稈的生物質類別,雖都含有纖維素,但因不同材質與來源的成分、種類及含量的差別,以及腐解菌株組成與反應環境條件的差異,對纖維素分解的效果也會千差萬別。因而,需對菌株的最適反應條件、分解效果最好的秸稈類型、分解菌株的最佳組合等條件進行探索,可望獲得最佳的腐解秸稈木質纖維素的工藝條件。同時,原始生林土壤中也會富集了多樣性的微生物區系,有待于進一步地挖掘。
4 結 論
原始森林長期累積枯枝落葉于林地土壤,富集有豐富的微生物類群。由于枝落葉中含有大量的木質纖維素,林地土壤可有效富集纖維素分解細菌.通過分離純化,經鑒定獲得兩株細菌對纖維素具有良好的分解效果,有待進一步發掘利用。

