海洋細菌THN1發酵產右旋糖酐酶的條件優化及酶學性質研究*
張 巖,吳 丹,徐海洋,徐淋香,3**
(1.江蘇海洋大學,江蘇連云港 222005;2.江蘇省海洋生物資源與環境重點實驗室,江蘇連云港 222005;3.江蘇省海洋生物產業技術協同創新中心,江蘇連云港 222005)
0 引言
右旋糖酐酶是一類特異性水解右旋糖酐中α-1,6糖苷鍵的葡聚糖酶,在醫藥及食品領域應用廣泛[1,2]。在醫藥領域,利用右旋糖酐酶制備低分子量的右旋糖酐可用于治療腦梗死、改善病患機體的凝血性能,也可作為代血漿或光學相干斷層掃描的造影劑[3-5];右旋糖酐酶還可以水解牙菌斑生物膜中的右旋糖酐,破壞生物膜的網狀結構,讓細菌無法黏附,從而防治齲齒[6]。在食品領域,利用右旋糖酐酶可以清除制糖過程中所產生的高分子量右旋糖酐,防止機器堵塞并提高得糖率和生產效率[7,8];也可利用右旋糖酐酶制備低聚異麥芽糖,并作為益生元添加到食品中。
目前已報道產右旋糖酐酶的菌株大多是真菌,雖然酶活較高,但其發酵周期長,作用條件偏酸性,且部分真菌發酵液中含有抗生素或有毒代謝產物,使得該類酶很難應用于口腔護理類產品中。得益于海洋的特殊環境,海洋來源的右旋糖酐酶通常具有生產周期短、最適反應溫度低、在中性或偏堿性條件下有很好的活性、無有毒次級代謝產物等特點,因而這類酶在口腔護理方面的研究價值較高[9-11]。
目前有關提升右旋糖酐酶產酶能力的報道已有很多,例如朱慧霞等[12]利用正交試驗法將繩狀青霉菌產的右旋糖酐酶的酶活力提高約4.4倍;黃瑞杰等[13]通過響應面法提高圓弧青霉的產酶能力,相較于優化前提高30.1%;楊齊等[14]亦是通過響應面法使得腐皮鐮刀菌產的右旋糖酐酶酶活力提高1.3倍。單因素法是通過對單一目標因素進行實驗安排,找到最優或者近似最優條件。響應面法不僅計算簡單,而且可以在尋求最佳發酵條件時對試驗中的各個因素進行連續分析,同時還考慮了試驗的隨機誤差。本研究利用單因素法結合響應面法對一株產右旋糖酐酶的海洋細菌THN1進行發酵條件優化,并初步研究該酶的酶學性質,旨在為該酶的進一步研究及應用提供數據支撐。
1 材料與方法
1.1 材料
1.1.1 試劑及樣品來源
胰蛋白胨和酵母粉購自Oxoid公司,其他試劑購自國藥集團化學試劑有限公司。
產右旋糖酐酶的海洋纖維化纖維菌(Cellulosimicrobiumcellulans)THN1為本實驗室從連云港田灣核電站附近海泥中篩選得到,已保藏于中國典型培養物保藏中心,保藏號為CCTCC M2020430。
1.1.2 培養基
2216E固體培養基:胰蛋白胨5 g/L,酵母粉1 g/L,瓊脂15 g/L,pH自然,陳海水配置。
LB培養基:胰蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,pH自然,去離子水配置。
初始產酶培養基:胰蛋白胨5 g/L,酵母粉1 g/L,右旋糖酐T20 10 g/L,pH自然,陳海水配置。
1.2 儀器與設備
超凈工作臺(SW-CJ-1D)購自蘇州凈化設備有限公司;高壓滅菌鍋(GI54DWS)和生化培養箱(SPX-250B-Z)購自上海博迅實業有限公司醫療設備廠;恒溫搖床(Innova 44R)購自美國Eppendorf公司;酶標儀(1510)和臺式離心機(Legend Micro 17R)購自美國Thermo Fisher公司。
1.3 方法
1.3.1 菌株的活化、發酵及粗酶液制備
在2216E固體培養基上使用三區劃線法對保藏于-80℃冰箱的菌株THN1進行劃線,置于37℃培養箱培養48-72 h。挑取單菌落于LB培養基中,30℃培養20 h后,以4%的接種量接種于初始產酶培養基中,30℃培養24 h。將發酵液于10 000 r/min、4℃條件下離心15 min,收集上清液,即為粗酶液。
1.3.2 酶活力測定
取50 μL粗酶液,加入150 μL 3%右旋糖酐T20溶液(20 mol/L pH值為7.5的Tris-HCl緩沖液配置),40℃水浴15 min后加入200 μL 3,5-二硝基水楊酸(DNS)終止反應,沸水浴5 min后迅速冷卻,加入3 mL去離子水,震蕩搖勻,吸取100 μL反應液于540 nm處測定吸光值[15]。對照組為先加DNS再加底物,其他操作同實驗組。
酶活力定義:每分鐘產生1 μmol還原糖所需要的酶量為一個酶活力單位(U)。
1.3.3 單因素實驗
將初始產酶培養基中的酵母粉改為1 g/L其他碳源(乳糖、蔗糖、玉米淀粉、麩皮、葡萄糖、糊精、馬鈴薯淀粉、大麥粉、麥芽糖),其他條件不變,按照1.3.1節方法提取粗酶液并按照1.3.2節方法測定酶活力,確定最佳碳源。
在最佳碳源的基礎上,用5 g/L的其他氮源(酵母粉、魚粉蛋白胨、豆粕、氯化銨、硫酸銨、花生粕、尿素、干酪素、硝酸鈉)代替胰蛋白胨,其他條件同上,測定酶活力,確定最佳氮源。
在最優碳源、氮源基礎上,分別改變碳源的添加量(1,5,10,15,20 g/L)、氮源添加量(5,8,10,15,20 g/L)、培養溫度(15,20,25,30,37,40,45℃)、右旋糖酐T20的添加量(0,1,2,3,4,5,8,10,15 g/L)、初始pH值 (5.0,6.0,7.0,7.5,8.0,9.0,10.0)以及NaCl的添加量(0,5,10,15,20,30,40,50 g/L),研究這些因素對菌株THN1產酶的影響。
1.3.4 數據處理
每個實驗組均做3組平行,每組平行測3組數據,計算酶活力平均值及誤差。采用Origin 2018進行統計分析和繪圖。
1.3.5 響應面Box-Behnken (BB)實驗設計
基于單因素實驗結果,選取胰蛋白胨添加量(A)、NaCl添加量(B)、初始pH值 (C)3個因素,以右旋糖酐酶酶活力(R1)作為響應值,通過Design-Expert 12軟件設計實驗組合優化發酵條件(表1)。

表1 Box-Behnken實驗設計各因素和水平值
1.3.6 菌株THN1生長曲線及產右旋糖酐酶時間進程
根據響應面實驗,獲得產右旋糖酐酶的最優發酵條件,在此條件下培養菌株THN1。期間每2 h取一次發酵液樣品,測定樣品在波長600 nm處的吸光值,根據1.3.2節的方法測定酶活力。
1.3.7 酶學性質測定
最適反應溫度及溫度穩定性:將粗酶液與底物混合后置于不同溫度下(20,25,30,35,40,45,50,55,60℃)反應15 min,測定酶活力,確定該酶的最適反應溫度;將粗酶液分別置于30,40,50℃水浴中孵育,每隔1 h取出適量粗酶液,在最適反應溫度下測定殘余酶活力。
最適pH值及pH穩定性:配置終濃度為50 mmol/L不同pH值(3.0,4.0,5.0,6.0,7.0,7.5,8.0,8.5,9.0)的3%右旋糖酐T20底物,將粗酶液與上述底物混合后,在最適反應溫度下測定酶活力,確定該酶的最適反應pH值;在粗酶液中加入終濃度為50 mmol/L的不同pH值(3.0,4.0,5.0,6.0,7.0,7.5,8.0,8.5,9.0)緩沖液放置于4℃冰箱24 h后,在最適反應溫度和pH條件下測定殘余酶活力。
2 結果與分析
2.1 單因素試驗篩選結果
由圖1a-h可知,在碳源為麩皮、氮源為胰蛋白胨、麩皮添加量為5 g/L、胰蛋白胨添加量為15 g/L、培養溫度為30℃、誘導劑右旋糖酐T20添加量為5 g/L、培養基初始pH值為7.5、NaCl添加量為15 g/L等單因素條件下,菌株THN1產右旋糖酐酶的能力分別達到最優。其中,當改變氮源添加量(5→15 g/L)和NaCl添加量(0→15 g/L),發酵液測得的酶活力分別從0.28 U/mL提升到1.17 U/mL以及從1.79 U/mL提升到2.33 U/mL,菌株THN1產右旋糖酐酶能力均顯著提升。
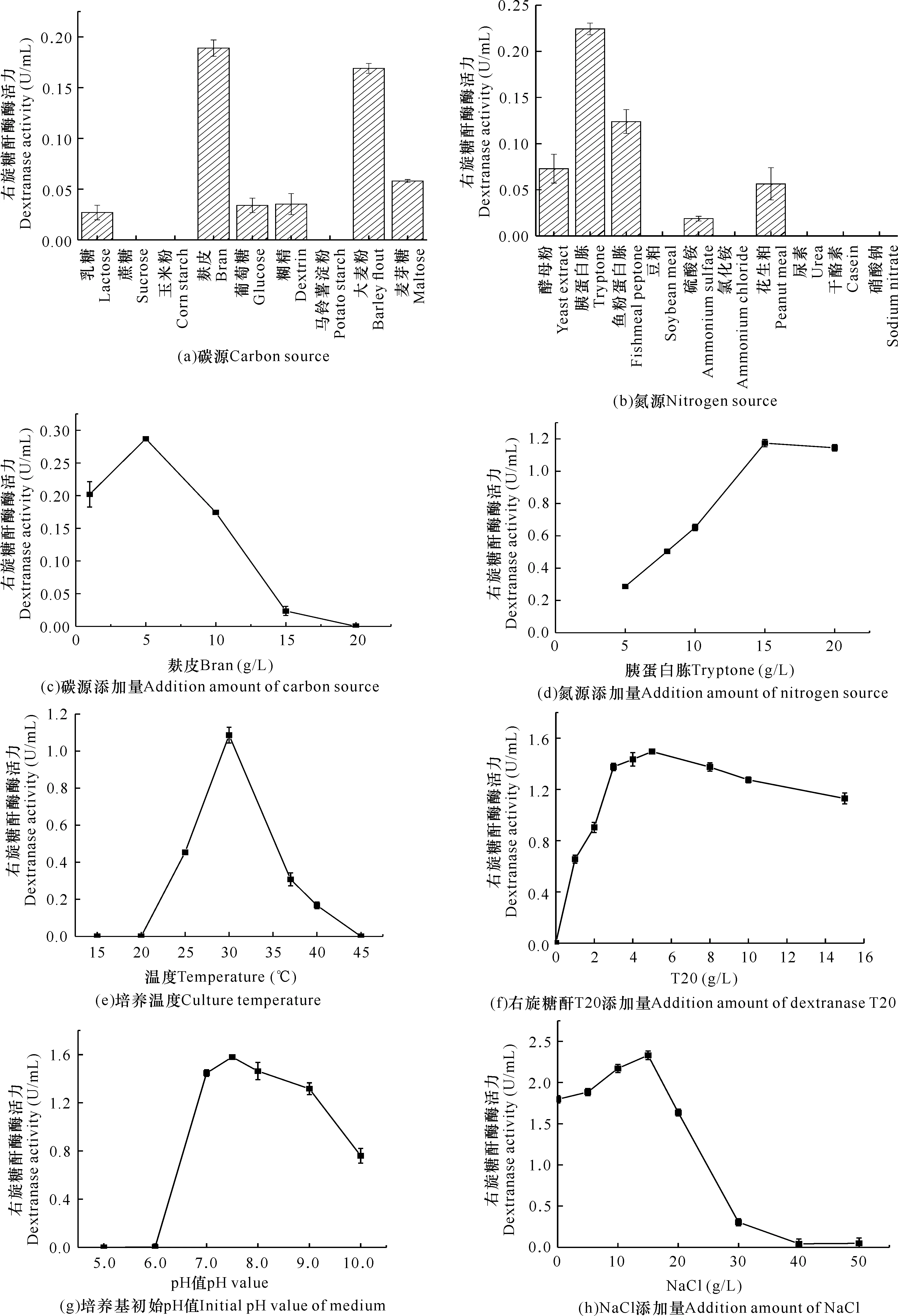
圖1 各因素對菌株THN1產右旋糖酐酶的影響
氮源是構成生物體蛋白質、酶、核酸及其他氮素化合物的重要基礎物質,因而氮源添加量的選擇對微生物生長尤為重要。在本研究中,當氮源添加到一定濃度后,繼續添加反而使酶活力降低(圖1d),這與張彥君等[16]以及侯殿志等[17]的研究結果相似。本研究中的右旋糖酐酶產自一株海洋細菌THN1,該菌株有一定的嗜鹽性,因此在一定范圍內該菌產右旋糖酐酶能力會隨著NaCl濃度的增加而增強,但超過峰值后產酶能力急劇下降(圖1h),這與Lai等[15]的研究結果相似。此外,初始pH值會直接影響到微生物的營養吸收以及代謝過程中酶的活性(圖1g)。因此,后續選擇胰蛋白胨添加量、NaCl添加量和初始pH值進行響應面實驗的優化因素。
2.2 Box-Behnken試驗結果
根據單因素實驗結果,選取胰蛋白胨添加量(A)、NaCl添加量(B)、初始pH值 (C) 3個主要影響因素,以右旋糖酐酶酶活力(R1)作為響應值,進行發酵條件響應面優化。試驗結果見表2,建立回歸模型如下:
R1=3.21+0.4713A-0.67B+0.9178C-
0.293AB+0.292AC+0.0905BC-0.7493A2-
0.8463B2-1.06C2。
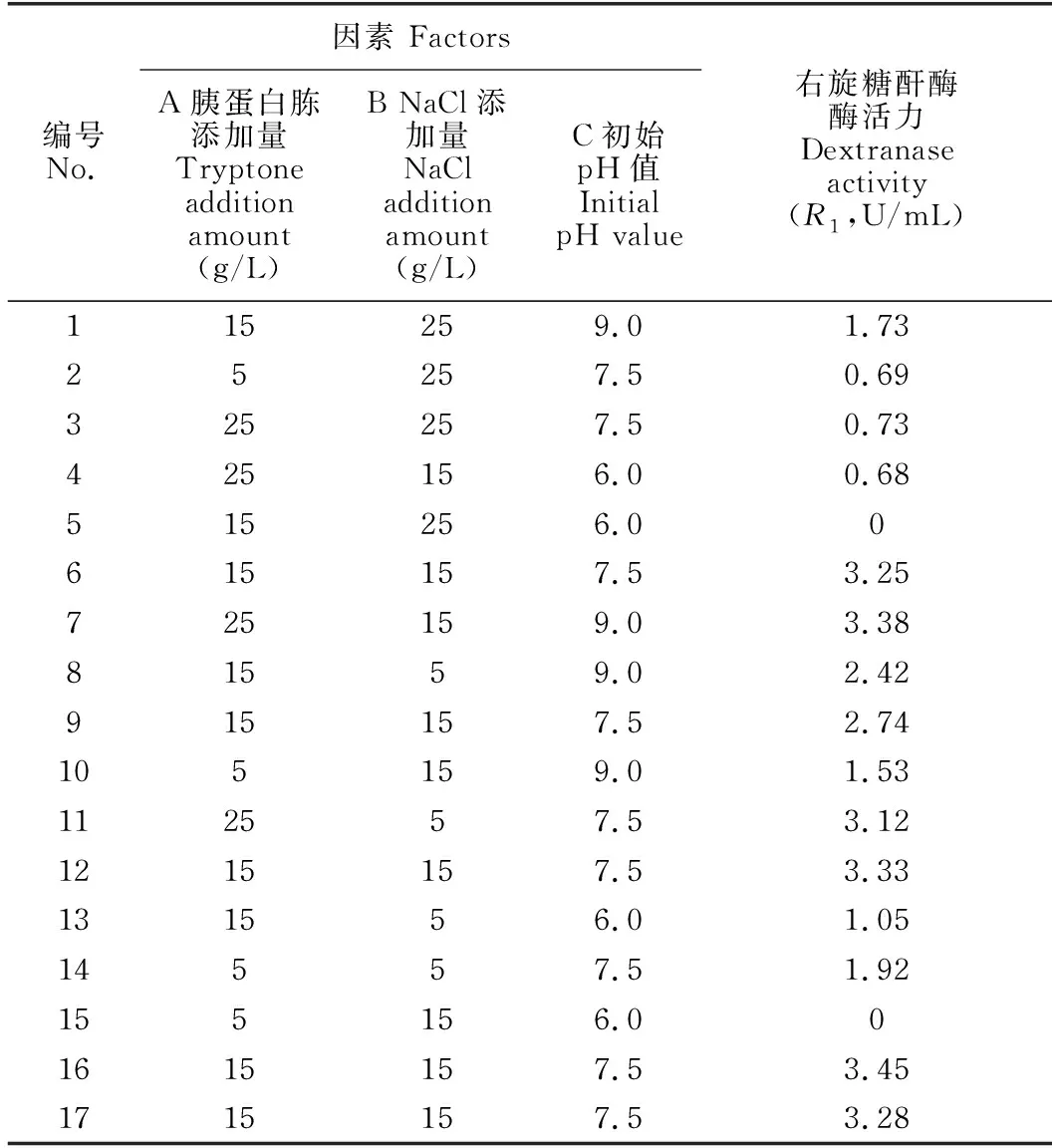
表2 Box-Behnken試驗設計及結果
方差分析(表3)顯示,所建立模型具有極顯著性(P=0.000 6),決定系數R2=0.956,失擬項不顯著(P=0.125 4),說明試驗模型擬合度較好。各因素對產右旋糖酐酶的影響由大到小排序為初始pH值(C)>NaCl添加量(B)>胰蛋白胨添加量(A)。
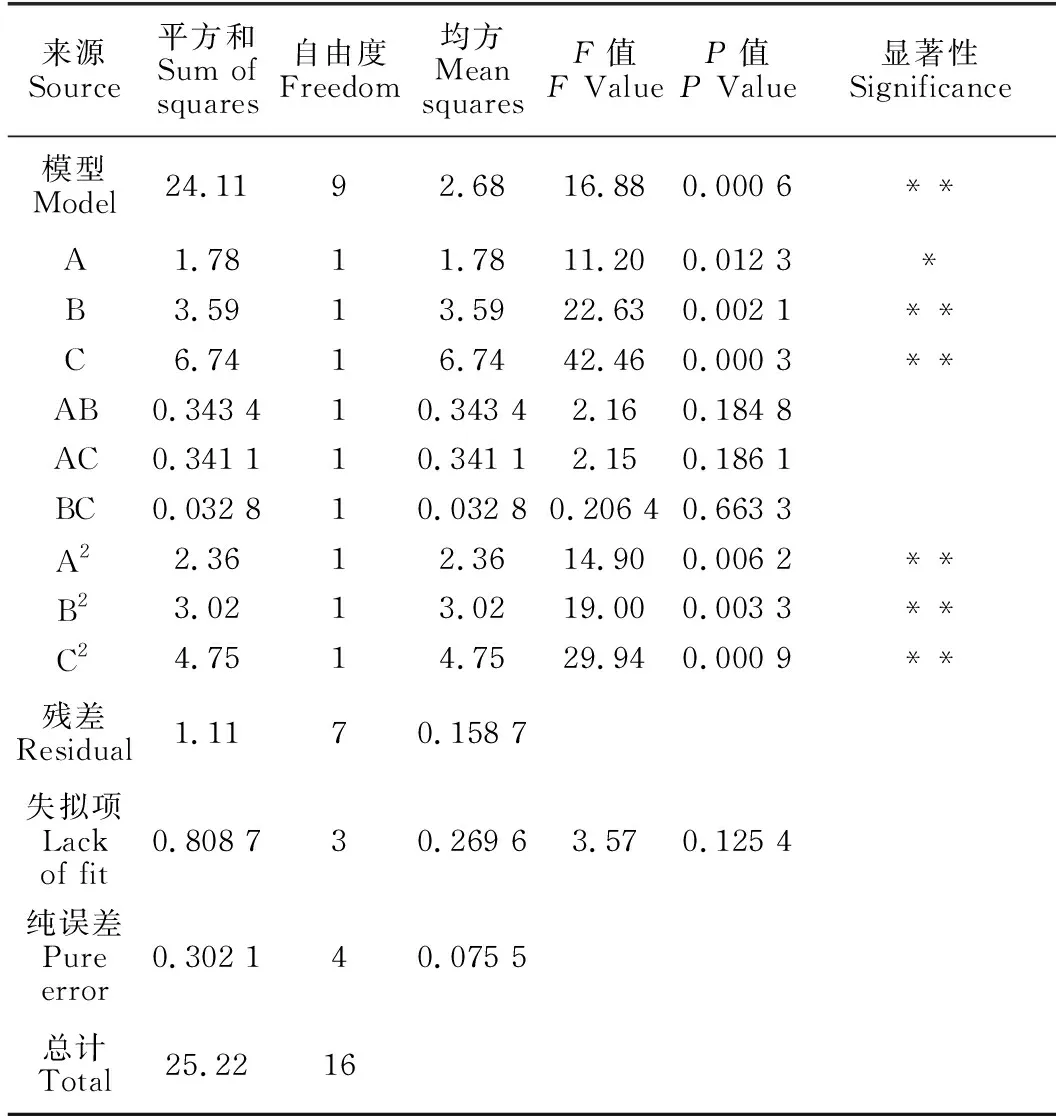
表3 回歸模型方差分析
圖2是各影響因素與右旋糖酐酶酶活力關系的三維響應面圖。通過分析得到菌株THN1的最佳產酶條件為胰蛋白胨19.97 g/L,NaCl 10.43 g/L,pH值為8.22,結合回歸模型計算得出最大酶活力為3.70 U/mL。為方便實際研究,選取胰蛋白胨20 g/L,NaCl 10 g/L,pH值為8.2進行驗證實驗,獲得右旋糖酐酶酶活力為(3.71 ± 0.01) U/mL,是初始酶活力(0.12 U/mL)的31倍,并且與預測值無顯著差異(P>0.05),說明該模型能較好地預測實際發酵情況。
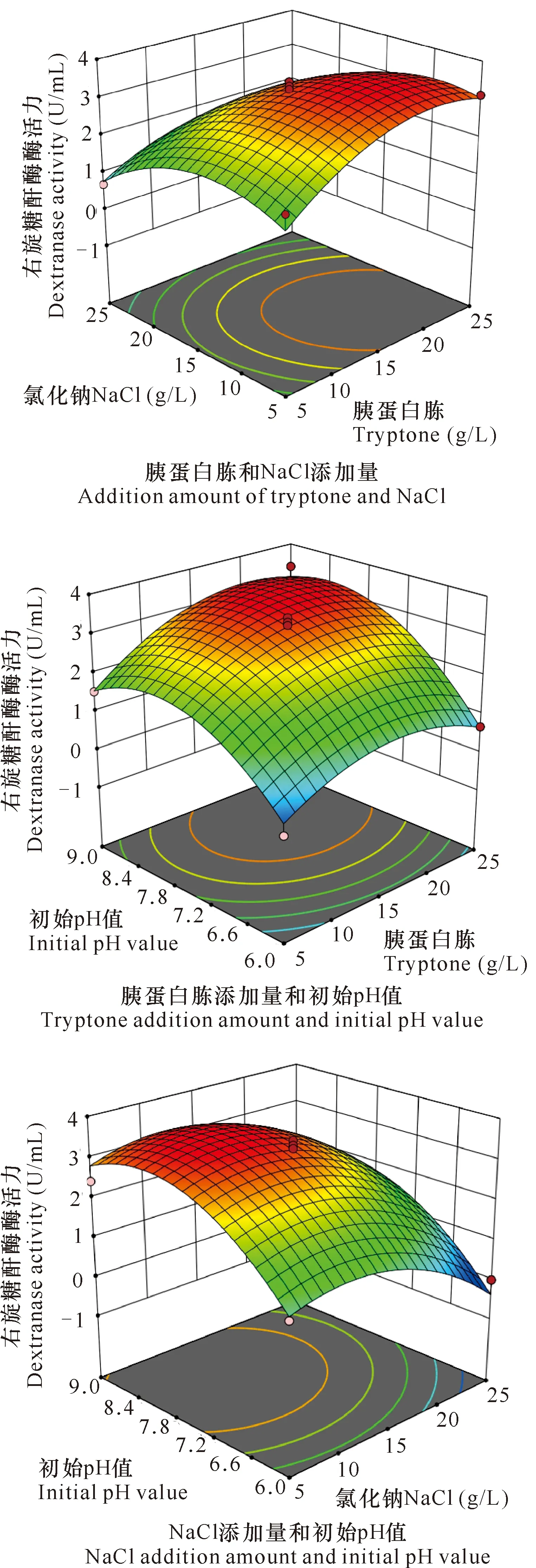
圖2 胰蛋白胨、NaCl和pH值對菌株THN1產酶影響的響應面
2.3 菌株THN1細胞生產和產酶時間關系
圖3是菌株THN1在最佳產右旋糖酐酶條件下的生長曲線及產酶時間進程。菌株THN1在發酵12 h后生長進入對數期,在30 h后進入穩定期。在12 h前,右旋糖酐酶酶活力幾乎為0;在12-26 h期間,右旋糖酐酶酶活力隨著菌體量的增長而提高,并在25 h左右達到最高;在26 h后,右旋糖酐酶酶活力隨著發酵時間的增長而呈下降趨勢。以上結果表明菌株THN1在培養24 h左右達到最高產酶水平。
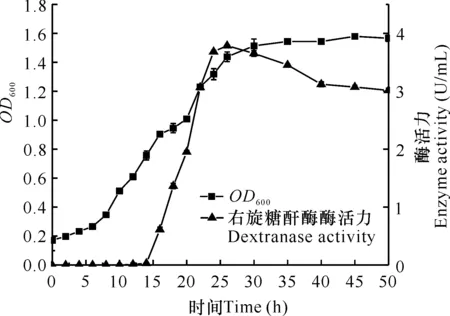
圖3 菌株THN1細胞生長及產右旋糖酐酶的時間進程曲線
2.4 酶學性質
如圖4a和4b所示,菌株THN1產右旋糖酐酶的最適反應溫度為40℃,在25-50℃時相對酶活力超過70%,在30℃時有較好的溫度穩定性,放置5 h基本沒有活力損失,這與張宇琪等[18]有關細菌來源右旋糖酐酶的報道一致。菌株THN1產右旋糖酐酶的最適pH值為7.5,在pH值為7.0-9.0條件下能保持60%以上的相對酶活力(圖4c)。此外,右旋糖酐酶在pH值為5.0-9.0條件下放置24 h (4℃),相對酶活力仍能保持50%以上,其中,pH值為5.5的乙酸鈉緩沖液、pH值為7.0的磷酸鹽緩沖液和pH值為9.0的Tris-HCl緩沖液中均能保持80%以上的相對酶活力(圖4d),表明該酶在中性以及弱堿性條件下穩定性較好。
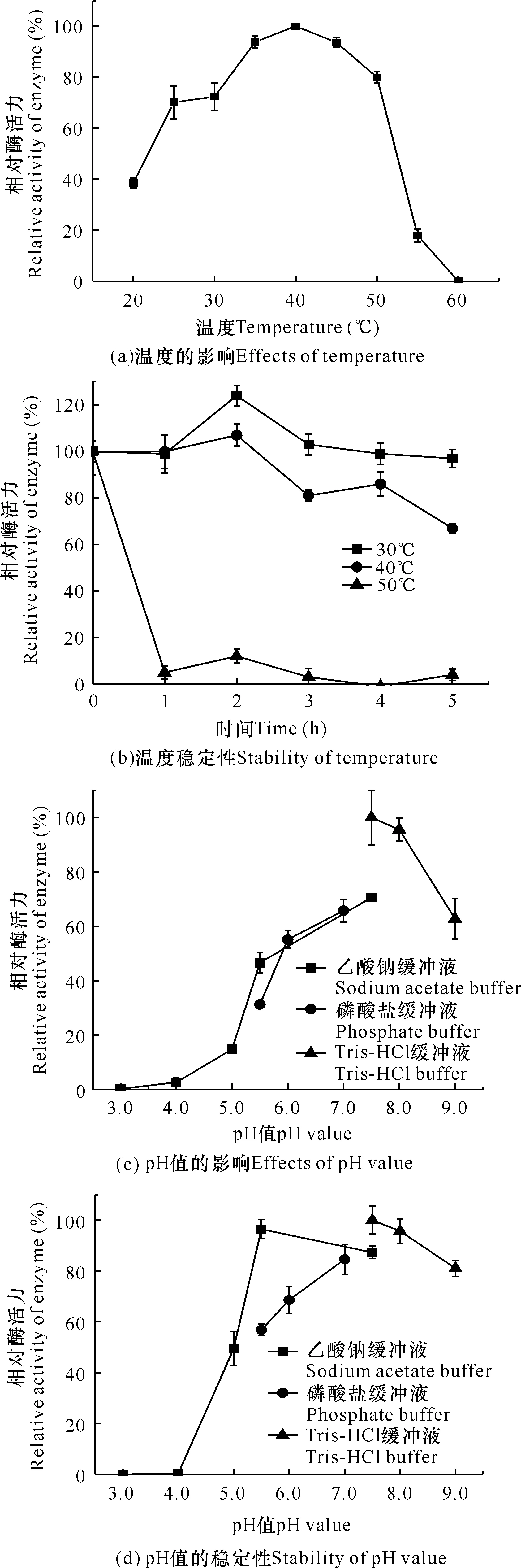
圖4 菌株THN1右旋糖酐酶酶學性質
菌株THN1產右旋糖酐酶的最適溫度、pH值分別是40℃和7.5,這與Ren等[10]以及Deng等[19]發現的海洋來源的右旋糖酐酶性質相似。上述文獻中均有右旋糖酐酶對牙菌斑生物膜的清除和抑制作用的相關實驗。因此,為拓展右旋糖酐酶在口腔護理方面的應用,后續研究可探索THN1右旋糖酐酶對牙菌斑生物膜的抑制和清除效果,以及研究市售口腔護理產品中化學試劑之間對該酶的功效是否存在協同或拮抗作用。
3 結論
菌株THN1產右旋糖酐酶的最佳條件為麩皮5 g/L,胰蛋白胨20 g/L,右旋糖酐T20 5 g/L,NaCl 10 g/L,pH值為8.2,陳海水配置,30℃培養24 h,在此條件下右旋糖酐酶的酶活力為(3.71±0.01) U/mL,是初始產酶培養基酶活力的31倍左右,這將有利于右旋糖酐酶生產周期的縮短和生產成本降低。該酶的最適反應溫度為40℃,在25-50℃條件下有較好的活性;最適反應pH值為7.5,在30℃和40℃條件下有很好的穩定性,對口腔牙菌斑生物膜的清理具有良好的應用潛能。