轉化生長因子β1和α平滑肌肌動蛋白在肝內膽管癌血管形成中的作用
李羿興,艾麥提·牙森,馬文梅,馬明福*
(1新疆醫科大學第一附屬醫院病理科,烏魯木齊 830054;2新疆醫科大學第一臨床學院;*通訊作者,E-mail:63319431@qq.com)
膽管癌是一種起源于膽管上皮的惡性腫瘤,約占消化道腫瘤的3%,根據解剖學部位可分為肝內膽管癌和肝外膽管癌[1]。膽管癌起病隱匿,早期癥狀不明顯,就診時多已屬晚期。手術切除仍然是最有效的治療方法,但目前根治性切除率相對較低,對放化療均不敏感,預后較差,故早發現和早診治已成為臨床面臨的難題[2]。
膽管癌是一個多因素、多階段的演變過程,其發生、發展不僅僅取決于多種癌基因的激活及抑癌基因的失活,腫瘤的微環境包括成纖維細胞等間質細胞、細胞外基質和細胞因子在腫瘤新生血管形成過程中起關鍵作用[3,4]。轉化生長因子β1(transforming growth factor β1, TGF-β1)作為一種多功能的細胞因子,可調節細胞的增殖、凋亡、分化及細胞外基質的產生,與腫瘤微環境中信號傳導通路異常密切相關[5]。此外,腫瘤間質中的成纖維細胞在腫瘤分泌的多種因子刺激下被激活并表達α平滑肌肌動蛋白(α smooth muscle actin,α-SMA)促進腫瘤新生血管形成[6,7]。目前尚無TGF-β1、α-SMA與肝內膽管癌血管形成相關的研究,故本研究通過免疫組化和qRT-PCR檢測肝內膽管癌組織中α-SMA、CK19、TGF-β1及CD31的表達,初步探討TGF-β1和α-SMA在肝內膽管癌血管形成中的作用,為肝內膽管癌的診治開拓新靶點。
1 材料與方法
1.1 臨床標本
收集2018年12月至2020年5月新疆醫科大學第一附屬醫院肝膽包蟲科經手術切除且病理證實的50例肝內膽管癌患者癌組織和遠端正常肝組織(離病灶中心5 cm以上)。所有患者均未接受放療、化療,臨床資料完整,術后病理分型均為腺癌。按照國際抗癌協會(UICC)提出TNM分期標準,Ⅰ期25例,Ⅱ期14例,Ⅲ期11例;有淋巴結轉移11例(22%),無淋巴結轉移39例(78%)。男性32例(64%),女性18例(36%),年齡41-77歲,平均61歲。本研究獲得我院倫理委員會批準,所有患者均已簽署知情同意書。將上述組織標本置于4%的多聚甲醛溶液固定48 h,常規脫水,經石蠟包埋后,切厚為4 μm薄片備用。
1.2 主要試劑
兔多克隆抗體α-SMA、CD31、CK19、TGF-β1,辣根過氧化物酶(HRP)標記的山羊抗兔IgG二抗及DAB顯色液(購自英國Abcam公司);天狼星紅染色試劑盒(購自中國Solarbio公司);PBS緩沖液、山羊血清封閉液、檸檬酸鈉抗原修復液及中性樹膠(購自中國中杉金橋生物技術有限公司);Trizole、RNA逆轉錄試劑盒、SYBR(購自大連TaKaRa公司)。
1.3 蘇木素&伊紅(HE)染色
將薄片放入62 ℃烤箱烤烘60 min后常規脫蠟,放入蒸餾水浸洗3次×5 min,隨后浸泡蘇木素溶液1.5-2 min,立即蒸餾水沖洗至泛色,用鹽酸乙醇分化2-5 s,再放入蒸餾水反藍40-60 s后浸泡伊紅溶液1-1.5 min,蒸餾水反復沖洗至泛色,常規脫水,透明并晾干,中性樹膠封片后光學顯微鏡下觀察并收集圖像。
1.4 天狼猩紅染色
將薄片放入62 ℃烤箱烤烘60 min后常規脫蠟;滴加天狼星紅染液置于37 ℃ 30 min,用無水乙醇分化2-3 s后常規脫水,透明,中性樹膠封固,在顯微鏡下觀察并采圖。使用ImageJ軟件計算陽性區域面積進行統計分析。
1.5 免疫組化染色
將薄片放入62 ℃烤箱烤烘60 min后常規脫蠟,用蒸餾水沖洗3次×5 min,泡在枸櫞酸抗原修復液高溫(90-100 ℃)修復15 min,自然冷卻至室溫。PBS緩沖液沖洗3次×5 min,置于3% H2O2溶液室溫孵育10 min,PBS緩沖液沖洗3次×5 min,滴加山羊血清室溫封閉1 h后滴加一抗(α-SMA 1∶500;CD31 1∶50;CK19 1∶200;TGF-β1 1∶80)置于4 ℃冰箱孵育過夜。次日復溫1 h后,PBS緩沖液洗3次×5 min,滴加二抗(1∶1 000)室溫孵育90 min;PBS緩沖溶液沖洗3次×5 min后滴加適量DAB顯色液于光學顯微鏡下觀察顯色。蘇木精復染10-30 s,反復沖洗至泛色,浸泡鹽酸乙醇分化2-3 s后,用蒸餾水反藍40-60 s。最后常規脫水,透明,自然晾干后封固。顯微鏡下觀察并采圖,使用ImageJ軟件計算陽性區域面積進行統計分析。
1.6 qRT-PCR檢測mRNA水平
用Trizole試劑提取肝內膽管癌患者癌組織和遠端正常肝組織的總mRNA。按照反轉錄試劑盒說明書操作反轉錄為cDNA,反轉錄條件:25 ℃ 10 min,42 ℃ 50 min,85 ℃ 5 min。引物序列見表1。按照熒光定量PCR擴增試劑盒說明書操作,擴增條件設置:94 ℃預變性4 min,94 ℃變性30 s,60 ℃退火30 s,72 ℃延伸30 s,循環40次,72 ℃檢測信號。使用2-ΔΔCt法來計算相對mRNA含量,ΔCt=Ct目的基因-CtGAPDH,ΔΔCt=ΔCt癌組織-ΔCt遠端正常肝組織,2-ΔΔCt表示癌組織目的基因mRNA的相對含量較遠端正常肝組織所改變的倍數。
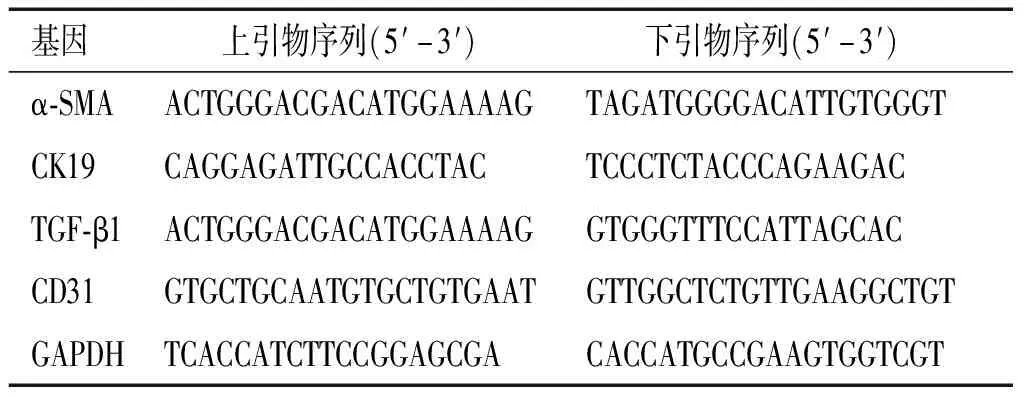
表1 qRT-PCR引物序列
1.7 統計學分析

2 結果
2.1 HE染色的基本病理變化
H&E染色結果顯示,在癌組織中可見明顯異形性的癌細胞,細胞核大而不規則,細胞排列紊亂,伴不同程度淋巴細胞浸潤;而遠端肝組織形態正常,可見正常肝小葉的結構(見圖1)。其中高、中分化38例(76%),低分化12(24%)例,伴有淋巴結轉移11例(22%)。
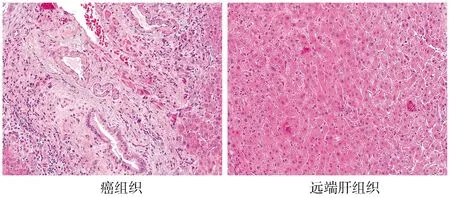
圖1 HE染色觀察基本病理變化(×200)
2.2 纖維化相關指標在肝內膽管癌組織中的表達
天狼猩紅染色結果顯示,在癌組織中,膠原主要沉積在間質細胞、血管或膽管周圍,而在遠端肝組織中僅少量沉積(見圖2);定量結果顯示,癌組織與遠端肝組織中膠原沉積的差異具有統計學意義(P<0.01,見圖2)。此外,α-SMA陽性細胞主要位于癌組織的膽管和血管周圍,在細胞質或間質中高表達,呈淡黃色或棕黃色;定量結果顯示,癌組織與遠端肝組織中α-SMA陽性細胞比例的差異具有統計學意義(P<0.01,見圖3)。qRT-PCR結果提示,癌組織中α-SMA mRNA表達量較遠端正常肝組織明顯增加,差異具有統計學意義(P<0.01,見圖3)。

圖2 天狼星紅染色檢測膠原在肝內膽管癌組織中的表達

圖3 α-SMA在肝內膽管癌組織中的表達
2.3 CK19標在肝內膽管癌組織中的表達
免疫組化結果顯示,CK19陽性細胞主要定位于癌組織的膽管細胞質中,形成部分或完整的膽管結構,呈棕褐色(見圖4);定量結果提示,在肝內膽管癌組織中CK19陽性細胞的表達量明顯高于遠端正常肝組織,差異有統計學意義(P<0.01,見圖4)。qRT-PCR結果提示,癌組織中CK19 mRNA表達量較遠端正常肝組織明顯增加,差異具有統計學意義(P<0.01,見圖4)。
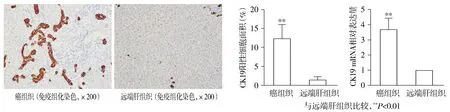
圖4 CK19在肝內膽管癌組織中的表達
2.4 TGF-β1標在肝內膽管癌組織中的表達
免疫組化結果顯示,TGF-β1陽性細胞主要定位于癌組織的細胞質或間質中,偶見于胞膜或胞核著色,在膽管和血管周圍中高表達,呈淡黃色或棕黃色;定量結果提示,在肝內膽管癌組織中TGF-β1陽性細胞的表達量明顯高于遠端正常肝組織,差異有統計學意義(P<0.01,見圖5)。qRT-PCR結果提示,癌組織中TGF-β1 mRNA表達量較遠端正常肝組織明顯增加,差異具有統計學意義(P<0.01,見圖5)。

圖5 TGF-β1在肝內膽管癌組織中的表達
2.5 CD31標在肝內膽管癌組織中的表達
免疫組化結果顯示,CD31陽性細胞主要定位于癌組織的細胞質中,在血管周圍中高表達,呈淡黃色或棕黃色;定量結果提示,在肝內膽管癌組織中CD31陽性細胞的表達量明顯高于遠端正常肝組織,差異有統計學意義(P<0.01,見圖6)。qRT-PCR結果提示,癌組織中CD31 mRNA表達量較遠端正常肝組織明顯增加,差異具有統計學意義(P<0.01,見圖6)。

圖6 CD31在肝內膽管癌組織中的表達
2.6 在肝內膽管癌組織中所表達指標的相關性分析結果
Pearson相關性分析結果顯示,α-SMA與CK19、TGF-β1、CD31,CK19與TGF-β1、CD31,TGF-β1與CD31在肝內膽管癌組織中的表達呈明顯正相關(均P<0.01,見表2)。
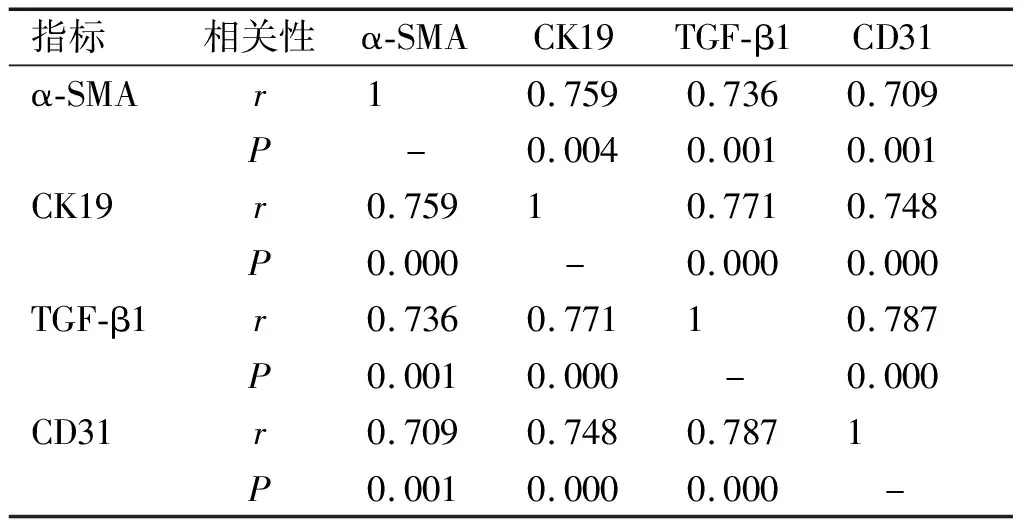
表2 肝內膽管癌組織中所表達的各個指標之間的相關性分析
3 討論
肝內膽管癌是一種原發于肝臟的常見惡性腫瘤,其發病率僅次于肝細胞性肝癌并逐年升高[8]。膽管癌的發生在膽管細胞增殖、分化和正常凋亡異常等遺傳因素和表觀遺傳因素的共同作用下導致原癌基因和抑癌基因之間失衡[9]。大多數患者未及時發現,病情發展迅速,嚴重威脅患者生命。因此,研究肝內膽管癌發生、發展的生物學機制顯得尤為重要。
研究表明,新生血管的形成不僅為腫瘤細胞的異常生長提供必要的氧氣,而且促進癌細胞通過血液循環遠處轉移至其他組織器官[10]。癌組織微環境中的成纖維細胞等間質細胞、生長因子、細胞外基質在腫瘤細胞新生血管形成、增殖和轉移過程中起了至關重要的作用[11]。TGF-β1作為在腫瘤信號轉導通路中發揮多種關鍵作用的生物學效應分子,在多種惡性腫瘤組織均有高表達,其表達水平與惡性腫瘤的演進、血管的形成、轉移密切相關[12,13]。成纖維細胞是腫瘤微環境中的關鍵細胞,在TGF-β1的作用下可激活。激活的成纖維細胞表達α-SMA并發生表型的改變,可以表達多種細胞因子,從而改善腫瘤細胞的微環境,促進腫瘤血管生成[14]。此外,膽管癌晚期高表達的TGF-β1能抑制免疫系統的正常功能,刺激新生血管的形成或通過旁分泌抑制癌細胞周圍組織的過度增殖,減少癌細胞增殖、生長的空間限制,為癌細胞的快速生長創造良好的環境[15,16]。
本研究結果表明,在肝內膽管癌患者癌組織中可見明顯異形性的癌細胞,細胞核大,細胞排列紊亂,伴有不同程度淋巴細胞浸潤,提示淋巴細胞參與肝內膽管癌腫瘤微環境的構成[17]。天狼猩紅染色觀察組織中的膠原沉積情況,結果顯示,膠原主要沉積在肝內膽管癌組織的血管、膽管周圍,表明膠原沉積對肝內膽管癌血管的形成至關重要,這與近期研究結果一致[18]。本研究觀察到50例肝內膽管癌患者癌組織中高表達α-SMA、CK19、TGF-β1、CD31,而遠端正常肝組織中僅有少量表達。上述指標在肝內膽管癌組織中的表達呈正相關,提示α-SMA和TGF-β1在肝內膽管癌血管形成中發揮至關重要的作用。
總之,TGF-β1和α-SMA是肝內膽管癌發生發展的促進因素,直接或間接參與肝內膽管癌血管的形成。隨著對TGF-β1、腫瘤微環境中間質細胞及所分泌細胞因子的深入研究,將對探討肝內膽管癌血管形成、發病機制及診治產生深遠意義,靶向抑制腫瘤微環境中的血管形成有望成為肝內膽管癌診治的新策略。

