miR-10a-5p靶向ITSN1對宮頸癌細胞增殖和順鉑化療敏感性的影響
李 妘,王 靜
(1陜西省漢中市中心醫院婦科,漢中 723000;2陜西省腫瘤醫院婦瘤科;*通訊作者,E-mail:yanghua422196@163.com)
宮頸癌(cervical cancer,CC)是一種常見的婦科惡性腫瘤,在女性癌癥相關死亡疾病中,排名第4位[1]。相關數據顯示,2018年全世界診斷宮頸癌新發病例569 847例,死亡病例311 365例[2]。目前,臨床上宮頸癌的主要治療手段包括手術、放療及化療,順鉑是臨床上治療宮頸癌的一線化療藥物,然而由于耐藥性的產生,大多數患者預后仍不樂觀[3,4]。微小RNA(microRNAs,miRNA)是一類小的非編碼RNA,其通過結合抑制靶信使RNA(mRNAs)的3'非翻譯區(UTR)在轉錄后基因調控中發揮重要作用[5]。目前,已有研究表明,miR-218、miR-501、miR-1284可通過調節其下游基因在多種腫瘤發生發展及耐藥中發揮重要功能[6-10]。但是,miR-10a-5p在宮頸癌中的功能及作用機制是怎樣的目前研究甚少。基于此,本研究對miR-10a-5p在宮頸癌細胞的增殖及對順鉑化療敏感性的影響進行了研究,研究假設miR-10a-5p參與宮頸癌細胞的增殖及對順鉑化療敏感性的影響,其作用機制可能與靶向交叉蛋白1(intersectin 1,ITSN1)相關。本研究對此假設進行驗證,以期為宮頸癌的發生發展提供更深入的了解。
1 材料與方法
1.1 研究對象
本研究所用到的23對宮頸癌組織及配對的癌旁正常組織標本均收集于2019年1月至2019年12月入住我院婦科經病理確診為宮頸癌的患者。
1.2 材料和主要試劑
人宮頸癌細胞株Caski購自中國科學院細胞研究所(中國上海);實時熒光定量PCR(real-time quantitative PCR,qRT-PCR)試劑盒購自廣州銳博生物有限公司;雙熒光素酶報告基因檢測試劑盒購自美國賽默飛世爾科技公司;順鉑(凍干型)購自齊魯制藥(海南)有限公司;CCK-8試劑盒購自日本同仁公司;GAPDH、ITSN1抗體及山羊抗兔IgG購自美國Cell Signaling Technology(CST)公司;ECL發光液購自上海翊圣生物科技有限公司;過表達miR-10a-5p慢病毒及試劑盒購自上海吉凱基因科技有限公司;空載質粒、ITSN1野生型3′-UTR實驗質粒、突變型3′-UTR實驗質粒、miR-10a-5p-mimics及miR-10a-5p-NC購自長沙博楚生物科技有限公司。
1.3 細胞培養
使用含有10%胎牛血清的RPMI-1640培養基(其中包含1%的青霉素+鏈霉素)培養人宮頸癌Caski細胞株,將細胞置于恒溫培養箱中培養,溫度設定為37 ℃,CO2濃度設置為5%。取對數生長期的細胞進行后續實驗。
1.4 細胞感染及分組
按密度為5×104個/ml將Caski細胞株重懸于感染增強液中,接種于24孔板中(每種細胞株均設置3個副孔),每孔體積為1 ml,在其中兩孔中,按MOI=10,分別加入空載體病毒(陰性對照組)或miR-10a-5p過表達慢病毒(miR-10a-5p過表達組)混合液各2.5 μl,另一孔不做處理(空白對照組)。將24孔板放置于細胞培養箱中培養8-16 h,進行培養基更換,后將細胞株轉移至培養瓶中進行培養及傳代,以2 μg/ml濃度的嘌呤霉素篩選得到過表達及空載體病毒轉染的宮頸癌細胞株,用于后續研究。
1.5 qRT-PCR檢測患者組織及宮頸癌細胞中miR-10a-5p的表達
采用RNA抽提試劑盒提取患者腫瘤組織、配對的癌旁正常組織總RNA及空白對照組、陰性對照組、過表達組宮頸癌細胞總RNA,采用qRT-PCR檢測組織、細胞中miR-10a-5p和三組細胞中ITSN1 mRNA表達水平,對于miR-10a-5p和RNA基因ITSN1,分別按照miDETECT A TrackTM、miRNA qRT-PCR、Starter Kit和riboSCRIPTTM mRNA/lncRNA qRT-PCR Starter Kit說明書要求加入各組分試劑,按照說明書設置反應條件,先進行逆轉錄制備cDNA文庫,后進行PCR擴增,引物序列見表1。結果采用2-ΔΔCt法進行統計分析。

表1 引物序列
1.6 Western blot檢測ITSN1蛋白表達水平
取1.4中三組處于對數生長期的細胞,棄去培養基,收集細胞,加入蛋白裂解液和PMSF,離心后上清液即為所需蛋白,利用BCA蛋白定量試劑盒,采用BCA法進行細胞蛋白濃度定量。然后,使用10%的十二烷基硫酸鈉聚烯酰胺凝膠電泳(sodium dodecylsulfatepolyacrylamide gel electrophoresis,SDS-PAGE)進行電泳反應,隨后進行轉膜反應,轉膜后使用脫脂牛奶室溫進行封閉1 h,隨后加入1∶1 000稀釋的一抗兔ITSN1抗體,于4 ℃孵育過夜,以洗膜緩沖液(Tris buffered saline tween,TBST)清洗3遍,每遍10 min,于室溫孵育二抗-山羊抗兔IgG(1∶5 000稀釋)1.5 h;以TBST清洗3遍,每遍10 min。進行曝光顯影。
1.7 CCK-8檢測miR-10a-5p對細胞增殖及對順鉑藥物敏感性的影響
取1.4中三組處于對數生長期的細胞,接種于96孔板,接種濃度為5×103個/孔,每種細胞設置3個復孔,每種細胞共接種于5塊板中,接種后第0,1,2,3,4天,于每孔加入10 μl的CCK-8溶液,細胞培養箱內繼續孵育3 h后,使用吸光分度儀,設置參數波長為450 nm,測定吸光度;取上述三組處于對數生長期的細胞,接種于96孔板,接種濃度為5×104個/孔,每種細胞設置3個復孔,每種細胞共接種于5塊板中,每塊板分別加入配置好的順鉑溶液,使其濃度為0.4,0.8,1.2,1.6,2 μg/L,培養48 h后,于每孔加入10 μl的CCK-8溶液,細胞培養箱內繼續孵育3h后,使用吸光分度儀,設置參數波長為450 nm,測定吸光度后進行計算。
1.8 miRNA靶基因預測及核心基因篩選
基于TargetScan數據庫(http://www.targetscan.org/)對miRNA進行靶基因預測,得到miRNA對應的所有靶基因,然后根據miRNA與基因的靶向調控關系構建miRNA調控基因的網絡圖,并通過網絡分析,篩選出miRNA調控的核心基因。
1.9 雙熒光素酶活性檢測
宮頸癌細胞株Caski質粒共轉染48 h后,檢測螢火蟲熒光素酶活性。向各孔中加入75 μl Dual-Glo@螢火蟲熒光素酶試劑,混合均勻。10 min后,使用雙熒光素酶報告分析系統檢測讀數,檢測螢火蟲熒光素酶反應強度RLU1;之后每孔添加75 μl Dual-Glo@Stop&Glo檢測試劑,10 min后用雙熒光素酶報告分析系統檢測讀數,檢測內參海腎熒光素酶反應強度RLU2。計算兩組數據比值(RLU1/RLU2),RLU1/RLU2比值可反映質粒熒光素酶的相對表達活性即細胞的轉染效率。
1.10 統計學處理
2 結果
2.1 miR-10a-5p在宮頸癌組織中低表達
通過qRT-PCR檢測23對宮頸癌及配對的癌旁正常組織發現,癌旁組織中miR-10a-5p表達量顯著高于癌組織(14.38±0.237 2vs9.973±0.560 2,P=0.000 2,見圖1)。
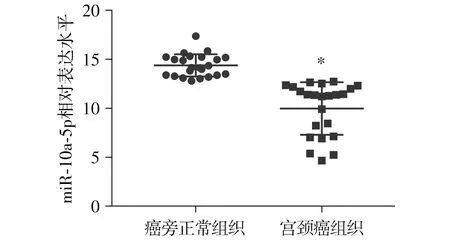
與癌旁正常組織相比,*P<0.05
2.2 穩定高表達miR-10a-5p Caski細胞系篩選
研究通過慢病毒感染Caski細胞,嘌呤霉素篩選后成功獲得穩定高表達miR-10a-5p的Caski細胞系。qRT-PCR檢測發現,與空白對照組相比,過表達組細胞中miR-10a-5p表達顯著增高(1±0vs2.548±0.014),差異有統計學意義(P<0.000 1),與陰性對照組相比,過表達組細胞中miR-10a-5p表達顯著增高(0.96±0.011vs2.548±0.014,P<0.000 1),而陰性對照組與空白對照組相比,細胞miR-10a-5p表達水平差異無統計學意義(P=0.912,見圖2)。
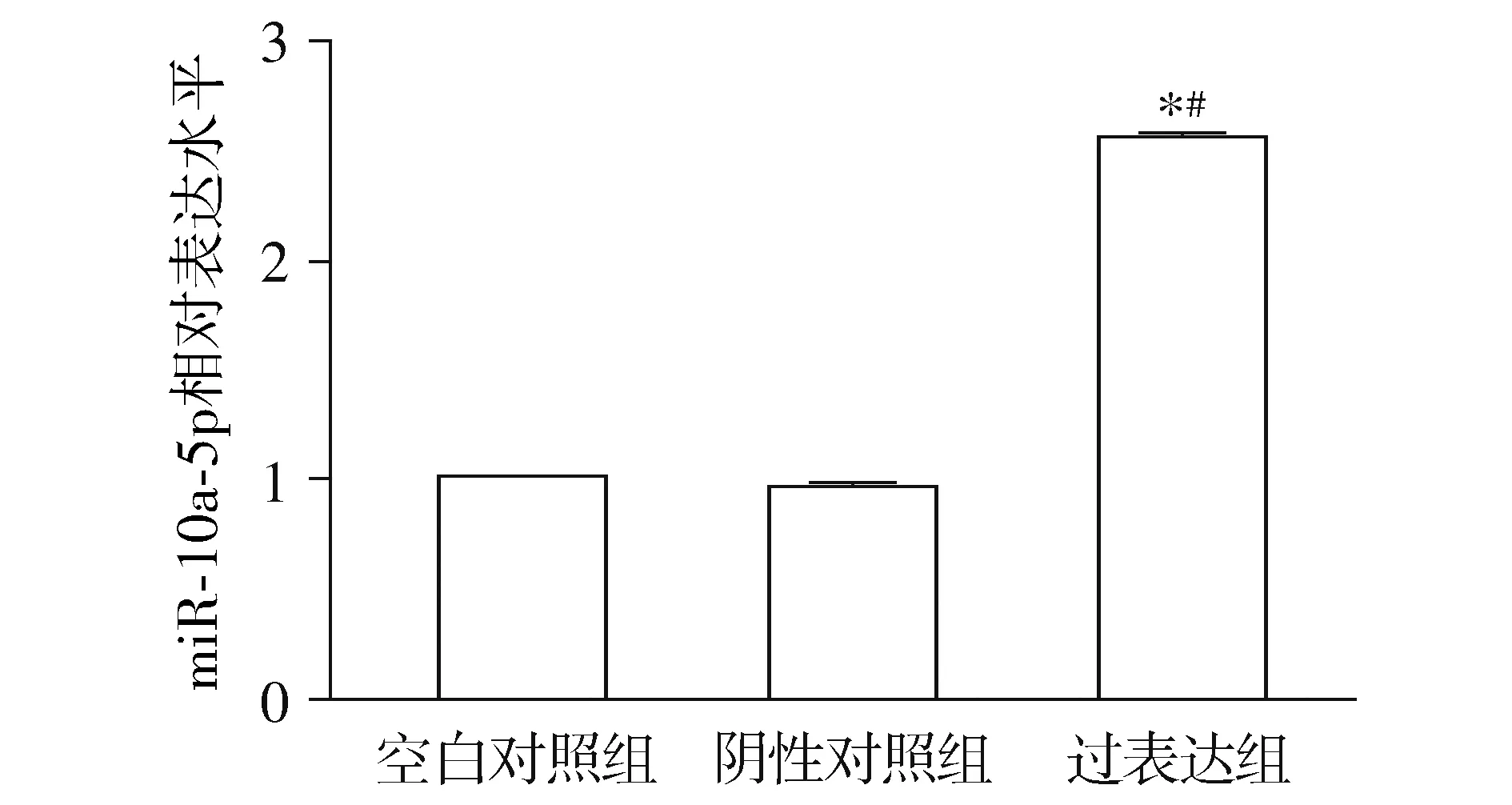
與空白對照組相比,*P<0.05;與陰性對照組相比,#P<0.05
2.3 過表達miR-10a-5p對宮頸癌細胞增殖的影響
CCK-8法檢測發現,在第4天,與空白對照組相比,miR-10a-5p過表達組吸光度明顯降低,差異有統計學意義(P<0.000 1),與陰性對照組相比,miR-10a-5p過表達組吸光度明顯降低,差異有統計學意義(P=0.002 6),而陰性對照組與空白對照組相比細胞吸光度差異無統計學意義(P=0.2,見圖3)。通過以上數據可以得出miR-10a-5p能夠明顯抑制宮頸癌細胞的增殖。
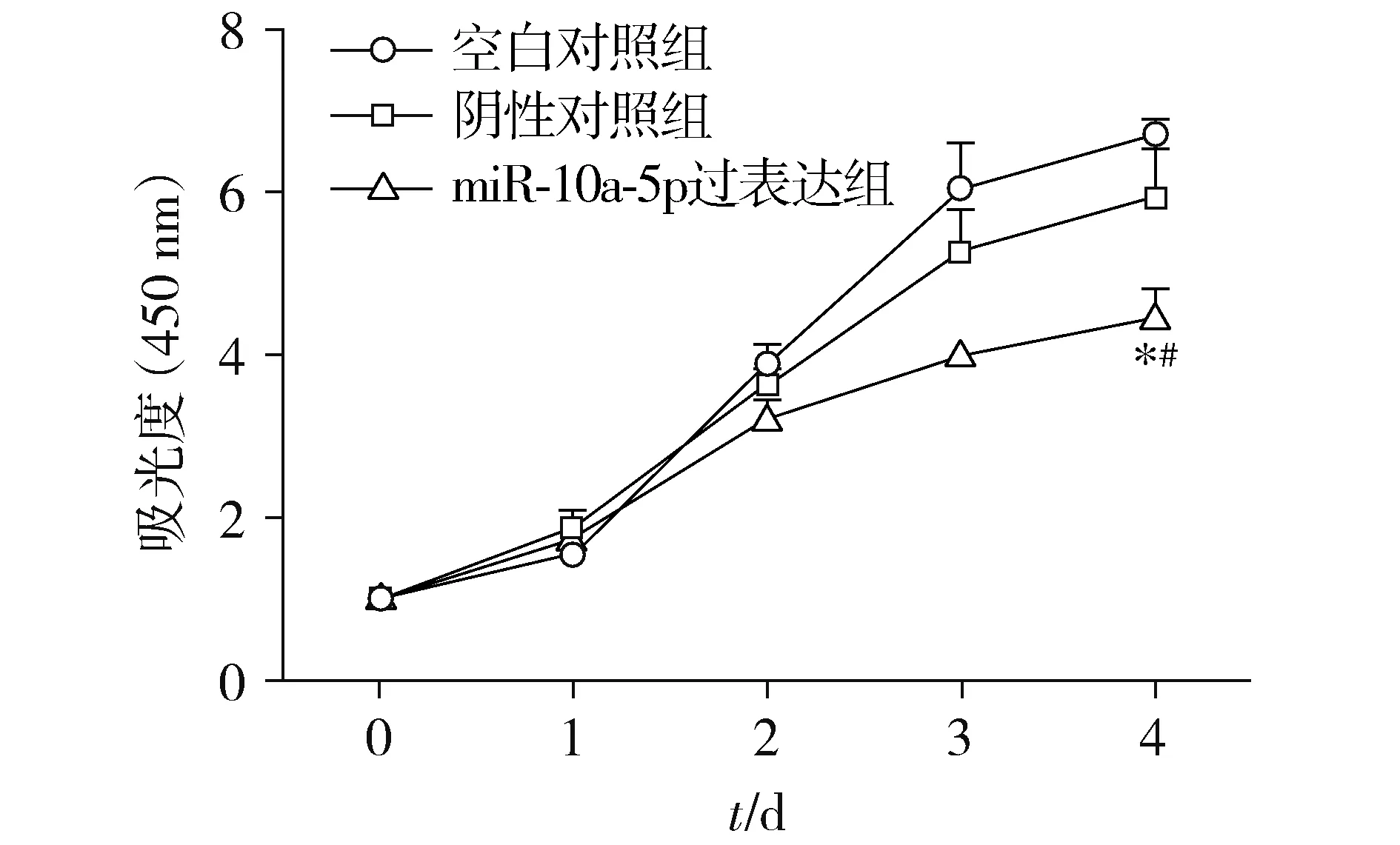
與空白對照組相比,*P<0.05;與陰性對照組相比,#P<0.05
2.4 過表達miR-10a-5p對宮頸癌細胞化療藥物敏感性影響
與空白對照組相比,miR-10a-5p過表達組細胞在順鉑濃度為2.0 μg/L時處理后的生長抑制率明顯升高,差異具有統計學意義(P<0.05),與陰性對照組相比,miR-10a-5p過表達組細胞在順鉑濃度為2.0 μg/L時處理后的生長抑制率明顯升高,差異具有統計學意義(P<0.05),而陰性對照組與空白對照組相比,細胞生長抑制率差異無統計學意義(見圖4),提示過表達miR-10a-5p能夠增強宮頸癌細胞對順鉑的化療敏感性。
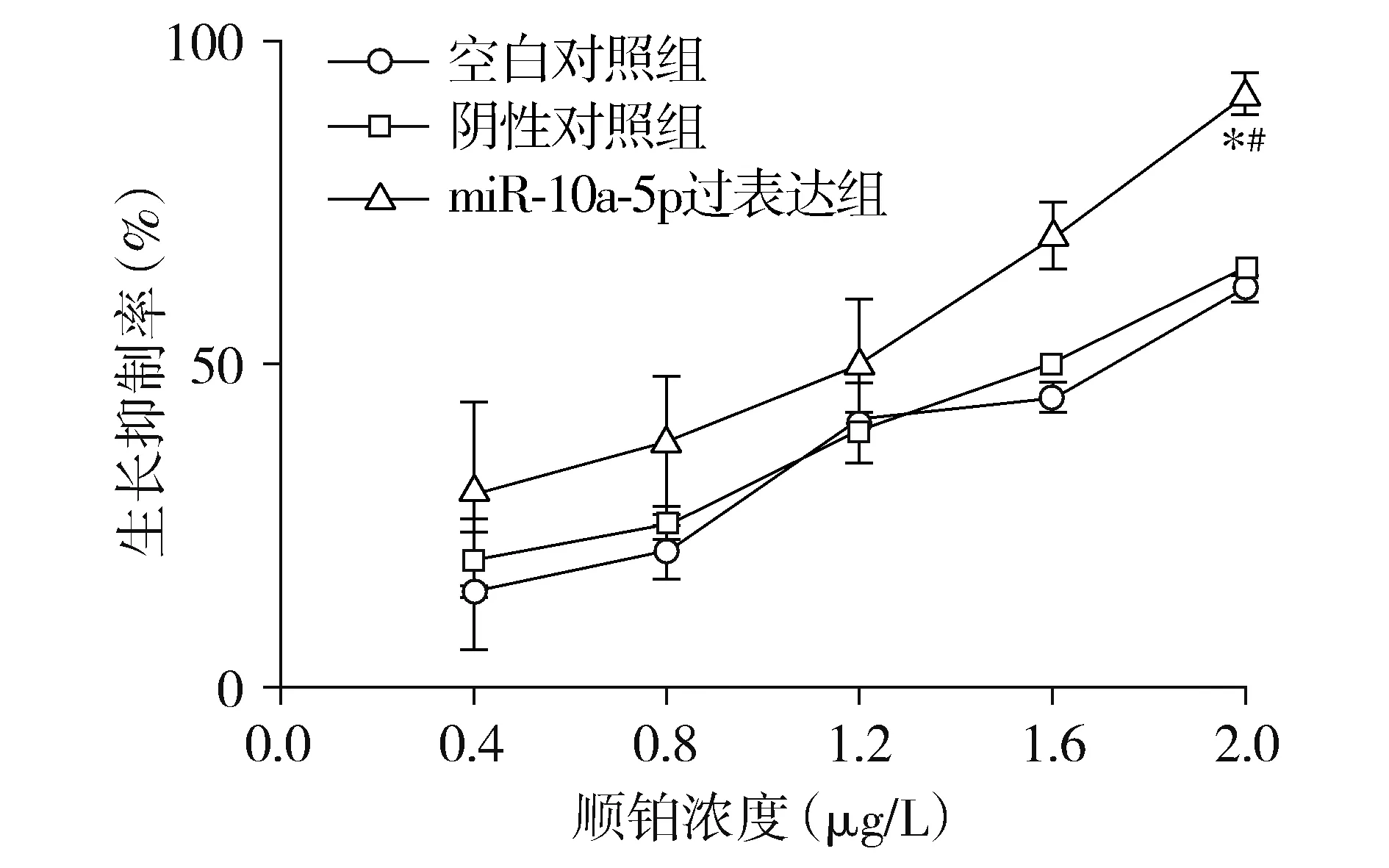
與空白對照組相比,*P<0.05;與陰性對照組相比,#P<0.05
2.5 三組間ITSN1的mRNA及蛋白表達水平比較
相對于空白對照組及陰性對照組,miR-10a-5p過表達組細胞ITSN1蛋白表達水平明顯降低(見圖5A)。相對于空白對照組,miR-10a-5p過表達組細胞ITSN1mRNA表達水平明顯降低(P<0.05),相對于陰性對照組,miR-10a-5p過表達組細胞ITSN1mRNA表達水平明顯降低(P<0.05),而陰性對照組細胞ITSN1 mRNA表達水平無明顯差異(P=0.2,見圖5B)。通過以上數據可以得出miR-10a-5p能夠明顯抑制宮頸癌細胞的增殖。
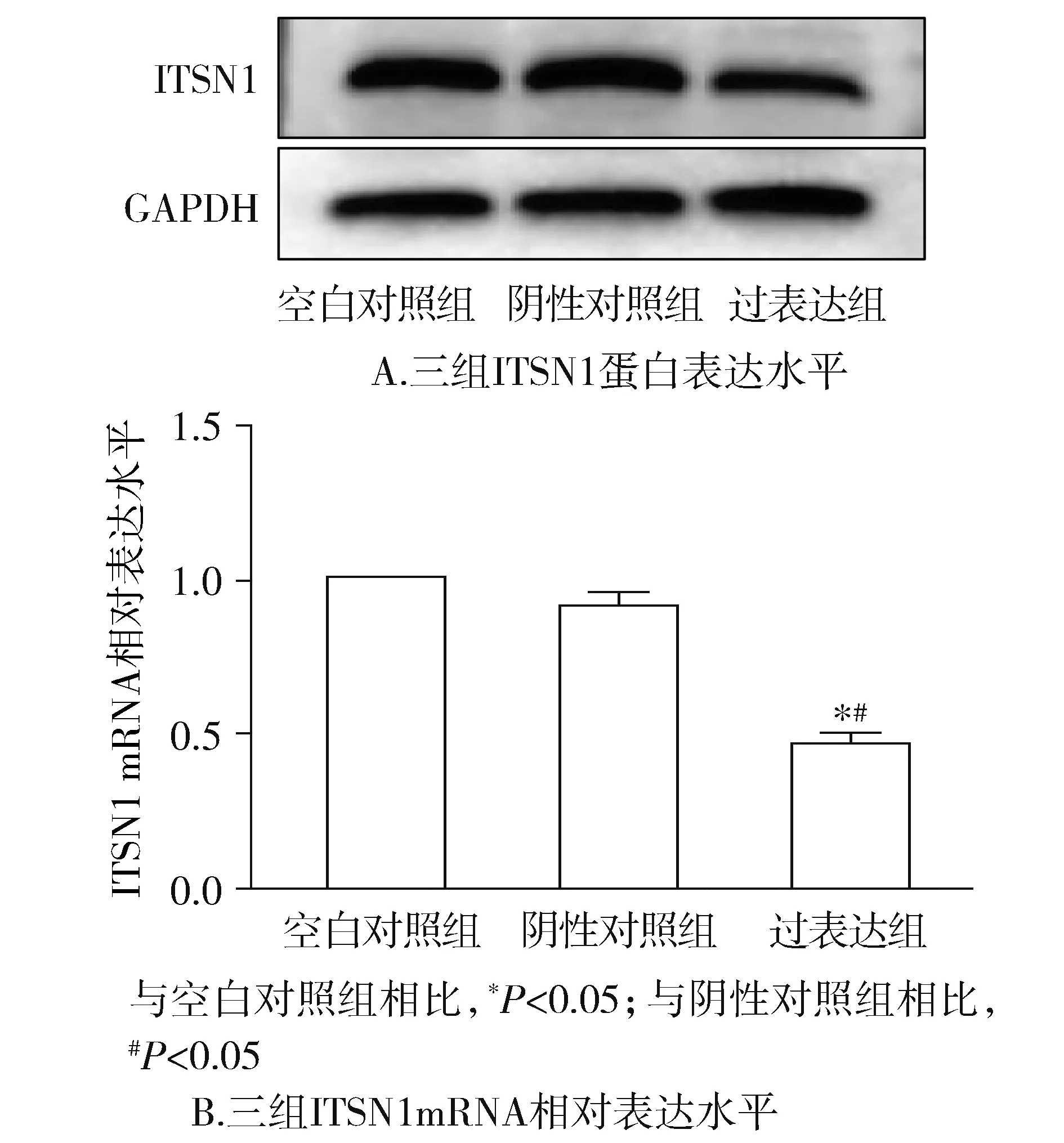
圖5 Western blot和qRT-PCR檢測三組細胞中ITSN1蛋白和mRNA水平
2.6 miR-10a-5p通過靶向作用ITSN1 3′-UTR抑制ITSN1表達
TargetScan軟件預測到miR-10a-5p與其靶基因ITSN1 3′-UTR的結合位點(見圖6A)。通過構建ITSN1 3′-UTR雙熒光素酶報告質粒與突變質粒,雙熒光素酶報告基因實驗驗證miR-10a-5p是目的基因ITSN1啟動子區DNA的作用位點(見圖6B)。

圖6 miR-10a-5p通過靶向ITSN1 3′UTR抑制ITSN1的表達
3 討論
宮頸癌為常見的婦科腫瘤,每年有數十萬的新增病例,嚴重損害了患者的身心健康[2]。同步放化療是針對晚期宮頸癌患者的標準治療策略[11]。但是,耐藥性的產生使臨床治療效果并不理想。因此,闡明耐藥的潛在機制,尋求宮頸癌的潛在治療靶標至關重要。眾所周知,miRNA與包括宮頸癌、乳腺癌和膀胱癌在內的多種疾病的進展和耐藥性相關[12]。有研究表明,miR-218可以通過直接下調IDO1進而抑制宮頸癌細胞的免疫逃逸反應[8]。miR-501可以通過靶向CYLD來促進宮頸癌細胞的增殖、遷移和侵襲能力[9]。miR-1284可通過靶向HMGB1增強宮頸癌細胞對順鉑的敏感性[10]。此外,miRNA也被認為是腫瘤的治療靶點[13]。文獻報道,在非小細胞肺癌中,miR-10a-5p可以調節腫瘤細胞的增殖和侵襲性并且可用于臨床診斷[14]。通過抑制miR-10a-5p靶向TFAP2C可以降低人類胰腺導管腺癌(PDAC)的遷移和侵襲能力,在腫瘤的發生和耐藥中起重要作用[15]。本研究通過對宮頸癌及配對的癌旁組織檢測,發現miR-10a-5p在宮頸癌組織中的表達低于癌旁配對正常組織,這提示miR-10a-5p可能參與調控宮頸癌的發生。本研究通過慢病毒感染的方法構建miR-10a-5p過表達細胞株,進一步發現在宮頸癌細胞株中,具有抑制腫瘤增殖及增加順鉑化療敏感性的影響。文獻報道,miRNA可以通過特異性調控靶基因ITSN1,在多種腫瘤中發揮抗腫瘤作用[16,17]。ITSN1是一種細胞銜接蛋白,主要參與網格蛋白介導的胞吞胞吐、細胞骨架重排和細胞信號傳導等生物學過程[18]。在乳腺癌中,過表達ITSN1可通過調節Ki67和Caspase-3的表達水平來抑制細胞增殖并促進細胞凋亡[19]。ITSN1-L可通過FAK/整合素β3途徑減弱細胞與基底的黏附抑制神經膠質瘤腫瘤進展[20]。根據靶基因預測分析,我們發現ITSN1為miR-10a-5p的靶基因,并且進一步通過熒光素酶報告基因實驗確定ITSN1可以與miR-10a-5p結合。
綜上所述,miR-10a-5p在宮頸癌組織中的表達水平明顯高于癌旁正常組織,過表達miR-10a-5p可以明顯降低宮頸癌細胞的增殖能力,并且增強了對化療藥物順鉑的藥物敏感性,其作用機制可能是通過靶向ITSN1發揮作用的。以上研究提示miR-10a-5p可能為宮頸癌的潛在治療靶點,但仍需進一步實驗證明。

