iTRAQ蛋白質組學分析揭示西瓜響應CGMMV脅迫的蛋白質
張慧青 孫玉燕 那冬晨 范 敏
(1山西師范大學生命科學學院,山西 臨汾 041000;2浙江省農業科學院蔬菜研究所,浙江 杭州 310021)
黃瓜綠斑駁花葉病毒(Cucumber green mottle mosaic virus,CGMMV)屬于蕪菁花葉病毒科煙草花葉病毒屬。自1935年在英國首次被報道以來[1],已有30 多個國家和地區在葫蘆科作物生產中發現CGMMV,對葫蘆科作物的品質及產量造成嚴重威脅[2-7]。西瓜感染CGMMV 后,葉片出現濃綠色凹凸斑,莖部出現褐色病斑,果實發生畸形,果肉出現空洞、腐爛且呈暗紅色[8]。近年來,CGMMV 傳播速度迅速加快,對葫蘆科作物尤其是西瓜產業的商業育種、育苗培育、種子貿易、產品生產和零售等帶來全球性危害[8]。因此,研究西瓜對CGMMV 的響應,將為闡明其分子機理及后續提高西瓜對CGMMV 的抗性奠定基礎。
關于西瓜感染CGMMV 轉錄和轉錄后調控的研究已取得一定進展[9-13]。通過對CGMMV 侵染前后的西瓜果實進行轉錄組分析,發現一些與細胞壁成分和光合作用相關的差異表達基因(differentially expressed genes, DEGs)可能參與CGMMV 病害癥狀的產生[9]。對CGMMV 侵染前后的西瓜葉片進行轉錄組分析,共鑒定到1 641 個DEGs,這些DEGs 主要參與光合作用、植物-病原菌互作、次生代謝和植物激素信號轉導等代謝途徑[10]。對CGMMV 侵染前后的西瓜葉片進行DNA 甲基化分析,發現RdDM(RNA-directed DNA methylation)介導的CHH 甲基化水平降低在西瓜抗病毒防御中發揮重要作用[11]。通過對感染CGMMV 前后的西瓜葉片進行小RNA(micro RNAs,miRNAs)測序,獲得多個參與CGMMV 脅迫應答的miRNAs,包括miR164、 miR319 和miR393[12]。對西瓜葉片中CGMMV衍生的短干涉RNA(short intering RNAs,siRNAs)進行研究,發現這些siRNAs 的長度多為21 或22 nt,主要來源于病毒正義鏈,siRNAs 作用的宿主轉錄本包括MYB、WD40、bHLH、真核翻譯起始因子、細胞色素P450 和纖維素合酶等,表明siRNAs 在病毒-宿主相互作用過程中發揮重要作用[13]。在蛋白質水平上研究西瓜對CGMMV 的脅迫應答,可進一步挖掘CGMMV 脅迫應答的蛋白質并明確其蛋白互作網路。蛋白質組學是研究植物-病毒相互作用和病毒侵染過程中蛋白質功能特征的有力工具,它可以提供比基因組研究更準確的數據。近年來,利用同位素標記相對和絕對定量(isobaric tags for relative and absolute quantitation,iTRAQ)研究病毒誘導的蛋白質變化在植株中已有報道[14-16]。對煙草花葉病毒(tobacco mosaic virus,TMV)侵染的煙草進行iTRAQ 蛋白質組分析,表明煙草中保持D1 蛋白的穩定性和能量的合理利用對抵抗TMV 的侵染至關重要[14]。對煙草葉片進行iTRAQ 蛋白質組學分析,表明RNA 誘導的DNA 甲基化在防御雙生病毒衛星DNAgeminivirus-betasatellite 感染中發揮重要作用[15]。利用iTRAQ 技術結合液相二級質譜 ( liquid chromatography-tandem mass spectrometry,LC-MS/MS),在黃瓜葉片中鑒定到38 個參與CGMMV 脅迫應答的差異表達蛋白,其中23 個蛋白質呈現上調表達,15 個蛋白質呈現下調表達[16]。對CGMMV 接種前后的西瓜果實進行iTRAQ 蛋白質組學分析,共鑒定到595 個差異表達蛋白,包括404 個上調蛋白和191 個下調蛋白,其中與葉綠素代謝、丙酮酸代謝、TCA 循環、熱休克蛋白、硫氧還蛋白、核糖體蛋白、翻譯起始因子和延伸因子相關蛋白的積累水平受到CGMMV 侵染的強烈影響;功能注釋表明這些差異表達蛋白主要參與光合作用、碳水化合物代謝、次生代謝物質合成、植物與病原體互作、蛋白質合成與轉化等[17]。本研究以iTRAQ 技術為基礎,結合LC-MS/MS技術,對CGMMV 侵染前后的西瓜葉片進行蛋白質組學分析,以期揭示參與西瓜葉片響應CGMMV 脅迫的蛋白質。
1 材料與方法
1.1 前處理試驗
將易感CGMMV 的西瓜自交系材料JJZ-M(保存于浙江省農業科學院蔬菜研究所西瓜研究室)種植于溫度25℃,光照/黑暗(16 h/8 h),濕度60%的光照培養箱中,待兩片真葉期進行接種。取人工接種CGMMV 的發病本氏煙草葉片和10 mmol.L-1磷酸鹽緩沖液(phosphate buffered saline,PBS,pH 值7.2)按1 ∶5(w/v)的比例混合研磨成糊狀病毒汁液。
試驗組:取兩片真葉期的植株,在葉面散上金剛砂,蘸取制作好的少量病毒汁液輕輕搓揉葉片2 ~3次,用清水沖去多余的金剛砂;對照組(CK,即0 h):植株只接種10 mmol.L-1磷酸鹽緩沖液。分別于接種后0 h、48 h 和25 d 取樣,3 個取樣階段的葉片癥狀見浙江省農業科學院蔬菜研究所西瓜組早期的報道[11]。與接種0 h 的植株相比,接種CGMMV 25 d 的葉片癥狀明顯,包括葉片形成綠色凹凸病斑及葉脈萎縮,而接種48 h 的植株無明顯病癥[11]。每個處理設置2 個生物學重復,用于iTRAQ 測序及分析。
1.2 蛋白質提取、定量、酶解和肽段標記
將接種CGMMV 0 h、48 h 和25 d 的西瓜葉片加入5 倍體積的放射免疫沉淀裂解液,超聲破碎處理5 min,于4℃、10 000×g條件下離心10 min;取上層清液,配置標準品溶液,在酶標儀上測定蛋白質的濃度。
每個處理樣品中吸取100 μg 蛋白質于EP 管,并用 100 mmol.L-1三乙胺- 碳酸緩沖溶液(triethylammonium bicarbonate,TEAB,pH 值8.5)將體積調整為100 μL;隨后加入5 μL 200 mmol.L-1三羧基乙基膦溶液[Tris(2-carboxyethyl) phosphine buffer,TCEP,pH 值8.5],將樣品置于55℃條件下孵育1 h;取5 μL 375 mmol.L-1碘乙酰胺溶液(使用前,將9 mg碘乙酸酰胺溶于132 μL 100 mmol.L-1TEAB 溶液中,配制成375 mmol.L-1碘乙酸酰胺)加入樣品中,室溫下避光孵育30 min;在樣品中加入600 μL 預冷丙酮,于-20℃放置不少于4 h;之后,于4℃、8 000×g條件下離心10 min,保留白色沉淀,室溫干燥2 ~3 min;取100 μL 50 mmol.L-1TEAB 溶液重溶蛋白質沉淀,添加2.5 μg 胰蛋白酶后在37℃下酶切蛋白過夜。
肽鏈利用串聯質譜標簽(tandem mass tag,TMT)試劑標記,標記在室溫下進行1 h。標記的肽在分餾前使用TMTsixples 等壓質量標記試劑盒(美國賽默飛世爾科技公司)進行操作和干燥。
1.3 肽分離與LC-MS/MS 分析
利用 Pierce High pH Reversed-Phase Peptide Fractionation Kit(美國賽默飛世爾科技公司)分餾已標記的肽,孵育后的樣品溶于300 μL 0.1% 三氯乙酸溶液中。在樣品中加入300 μL 的5% 乙腈-0.1% 三乙胺去除未反應的TMT 溶液,然后加入300 μL 洗脫液,3 000×g離心2 min,收集片段。真空離心法將每個離心管中的液體蒸發至干,分離的肽在含有0.1%甲酸和2%乙腈的緩沖液中溶解。12 000×g、4℃離心10 min 后,轉移到LC-MS 樣品瓶中。片段在Easy-nLC 1000(美國賽默飛世爾科技公司)上運行,該nLC 1000與Orbitrap Q ExactiveTMHF 質譜儀耦合(美國賽默飛世爾科技公司)。
1.4 蛋白質鑒定和定量
通過Proteome Discoverer 2.0 將原始數據文件轉換為MGF 文件。利用MASCOT v2.3(英國Matrix 科學 公司) 將數據比對到西瓜UniProtKB 數據庫(https:/ /www.uniprot.org/)進行蛋白質的鑒定及定量。母離子容差設置為10-5,MS/MS 碎片離子的質量容差設置為0.6 Da,胰蛋白酶消化過程中允許兩次缺失裂解。將甲硫氨酸氧化作為可變修飾,將半胱氨酸氨基甲酰化作為固定修飾。選擇單一同位素質量,只有在95%置信水平下具有顯著得分的多肽是可信的,并用于蛋白質鑒定。
1.5 差異表達蛋白鑒定及KEGG 功能分析
對差異表達蛋白(differentially expressed proteins,DEPs)進行篩選鑒定,將FC≥1.2(或≤1/1.2)和P<0.05 作為篩選標準。FC≥1.2 的蛋白認為是上調,FC≤1/1.2 的蛋白認為是下調。P值由t檢驗計算得出。對差異表達蛋白進行基于KEGG Pathway 的功能富集分析。
1.6 蛋白質-蛋白質相互作用網絡分析
在基于BLAST 算法的搜索數據庫(用于檢索基因/蛋白質相互作用的搜索工具)中,DEPs 用作原始序列以揭示蛋白質-蛋白質相互作用(protein-protein interaction,PPI)網絡。STRING 是收錄多個物種預測和試驗驗證的PPI 的數據庫,包括直接的物理互作和間接功能相關。每個相互作用都有一個綜合得分,代表蛋白質之間相互作用的可信度,綜合得分(0:最低置信度;1:最高置信度)大于0.4 的PPI 做進一步網絡分析,并用Cytoscape 將蛋白互作網絡圖視化。
1.7 RT-qPCR 驗證蛋白質在CGMMV 脅迫下的表達
與蛋白質組測序的取樣時間一致,分別在接種CGMMV 后0 h、48 h 和25 d 采集西瓜葉片,提取總RNA。用 TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix 試劑盒(北京全式金生物技術有限公司)將總RNA(2 μg)反轉錄成cDNA。實時熒光定量PCR(quantitative real-time PCR,RT-qPCR)使用TransStart Top Green qPCR Supermix 試劑盒(北京全式金生物技術有限公司),在StepOne Plus Real-Time PCR System(美國ABI 公司)中完成。反應程序:95℃預變性30 s,95℃變性5 s,55℃退火15 s,72℃延伸10 s;40 次循環。內參基因為Tubulin,采用2-ΔΔCT法計算基因相對表達量[18]。設置3 個重復。用于RT-qPCR分析的引物見表1。

表1 RT-qPCR 分析所用的引物Table 1 Primers used for RT-qPCR analysis
2 結果與分析
2.1 基于iTRAQ 分析的蛋白質鑒定
iTRAQ 分析共產生396 個多肽,只有不到4.3%的肽段具有≥20 個氨基酸殘基,92.4%的肽段具有7~16個氨基酸殘基(圖1)。通過比對UniProtKB 數據庫,共鑒定獲得88 個蛋白質(表2)。通過對每個處理2 個重復間蛋白質表達水平的相關系數(r2)進行分析,發現r2大于0.99,證實了測序結果的可靠性(圖2)。

表2 利用iTRAQ 在3 個文庫中鑒定到的蛋白質Table 2 Proteins identified using iTRAQ in three libraries

表2(續)

表2(續)
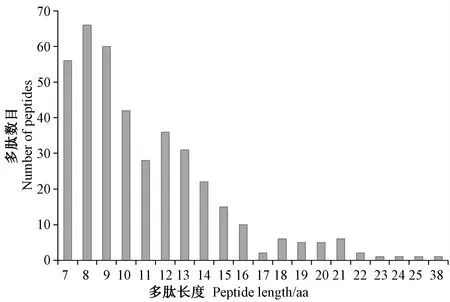
圖1 西瓜CGMMV 侵染前后的多肽長度分布Fig.1 Distribution of peptide lengths in watermelon before and post CGMMV infection
2.2 參與西瓜對CGMMV 脅迫應答的DEPs
當蛋白質的FC≥1.2 且P<0.05 時,認為其表達上調;當蛋白質的FC≤1/1.2 且P<0.05 時,認為其表達下調。根據該標準,鑒定到61 個DEPs(表3、圖3)。與接種0 h 相比,15 個蛋白質在接種后48 h 呈現差異表達(均為下調表達),37 個蛋白質在接種后25 d 呈現顯著差異表達(24 個上調,13 個下調);與接種后48 h 相比,51 個蛋白質在接種后25 d 呈現顯著差異表達(45 個上調,6 個下調)。這些DEPs 包括熱激蛋白和生物防御素類蛋白、光系統Ⅰ/Ⅱ蛋白、ATP 合成酶、ATP 合酶、NADH 脫氫酶、真核翻譯起始因子、核糖體蛋白、乙烯受體、乙烯響應因子、蔗糖合成酶和抗壞血酸過氧化物酶。例如,核糖體蛋白L22(A0A1P8LDU4)、光系統Ⅰ鐵硫中心(A0A1P8LDV7)和光系統Ⅱ反應中心蛋白H(A0A1P8LEZ9) 在48 h_0 h、 25 d_0 h 和25 d_48 h 表達下調,而核糖體蛋白S4(D5I3A5)、NADH 脫氫酶亞基9(D5I3C1)、HSP22.8(H6TB36)、真核細胞翻譯起始因子6(Q6I663)、蔗糖合酶( Q9SBL8) 和乙烯受體(V9QGW9)在25 d_0 h 和25 d_48 h 表達上調。
2.3 CGMMV 脅迫應答DEPs 的KEGG 功能分析
通過對DEPs 進行KEGG 富集分析鑒定參與CGMMV 脅迫應答的代謝途徑。由圖4 可知,48 h_0 h的DEPs 主要參與光合作用、核糖體、α-亞麻酸代謝、乙醛酸和二羧酸代謝、氧化磷酸化、光合生物中的碳固定、碳代謝作用、代謝途徑和次生代謝產物的生物合成等代謝途徑。而25 d_0 h 和25 d_48 h 的DEPs 主要參與植物激素信號轉導、類胡蘿卜素生物合成、糖酵解/糖異生、嘌呤代謝、嘧啶代謝、RNA 聚合酶、RNA 轉運和真核生物核糖體生物合成、光合生物中的碳固定、淀粉和蔗糖代謝、抗壞血酸和醛酸代謝、次生代謝產物的生物合成等代謝途徑。

表3 在3 個文庫中鑒定的差異表達蛋白Table 3 DEPs identified among three libraries

表3(續)
2.4 西瓜響應CGMMV 脅迫的DEPs 的PPI 分析
在基于BLAST 算法的搜索數據庫(用于檢索基因/蛋白質相互作用的搜索工具),DEPs 被用作原始序列,并使用綜合評分大于0.4 的PPIs 來確定互作網絡。48 h_0 h 的13 個DEPs 在CGMMV 脅迫下參與已知的蛋白互作網絡,分別是PSAA(A0A1P8LDG4)、NDHI(A0A1P8LDL8)、RPL22(A0A1P8LDU4)、PSAC( A0A1P8LDV7 )、 RPS11 ( A0A1P8LEJ1 )、 rps2(A0A1P8LEM9)、RPS7.2(A0A1P8LEV5)、AtCg00380( A0A1P8LEX7 )、 PSBH ( A0A1P8LEZ9 )、 YCF3( A0A1P8LF51 )、 PSBE ( A0A1P8LF81 )、 RBCL(A5X4H2)和LHCB6(D1MWY9)(圖5-A)。
25 d_0 h 的32 個DEPs 在CGMMV 脅迫下參與已知的蛋白互作網絡,分別是RPOB(A0A1P8LF53)、RPL22(A0A1P8LDU4)、PSBH(A0A1P8LEZ9)、NAD7( D5I3D0 )、PETD ( A0A1P8LF98 )、 YCF3( A0A1P8LF51 )、 RBCL ( A5X4H2 )、 RPOC2( A0A1P8LDN2 )、 PSAC ( A0A1P8LDV7 )、 ABA1(F8QV17)、PSBE(A0A1P8LF81)及NAD9(D5I3C1)等(圖5-B)。
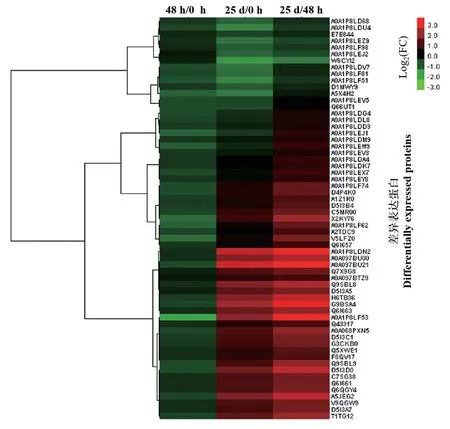
圖3 3 個文庫中DEPs 的聚類分析Fig.3 Cluster analysis of DEPs identified from three libraries
25 d_48 h 的43 個DEPs 在CGMMV 脅迫下參與已知的蛋白互作網絡,分別是RPL2.2(A0A1P8LDK7)、 RPS12A ( A0A1P8LF74)、 RPL22( A0A1P8LDU4 )、 NAD7 ( D5I3D0 )、 RPS11( A0A1P8LEJ1 )、 PSAC ( A0A1P8LDV7 )、 PSBB( A0A1P8LDA4 )、 RPOB ( A0A1P8LF53 )、 rps2(A0A1P8LEM9)、AtCg00380(A0A1P8LEX7)及PSBH(A0A1P8LEZ9)等(圖5-C)。
這些 DEPs 中, PSAC (A0A1P8LDV7)、 RPL22(A0A1P8LDU4)和PSBH(A0A1P8LEZ9)共同參與了上述互作網絡,表明它們在西瓜CGMMV 脅迫應答中起著關鍵作用。
2.5 RT-qPCR 驗證DEPs 的基因表達
選取SUS4(Q9SBL8)、RPL22(A0A1P8LDU4)、NAD7(D5I3D0)、PSBH(A0A1P8LEZ9)、Defensin-like protein 5 ( V5LFZ0)、 ATPF ( A0A1P8LD68)、 LSP1(C7SG38) 和HSP22.8(H6TB36) 蛋白質進行RTqPCR 驗證(圖6)。SUS4 ( Q9SBL8 )、RPL22(A0A1P8LDU4)、ATPF( A0A1P8LD68) 和PSBH(A0A1P8LEZ9)在接種后48 h 和25 d 呈逐漸下調表達。HSP22.8(H6TB36)在接種后48 h 和25 d 呈逐漸上調表達。NAD7(D5I3D0)在接種后48 h 的表達下調,而后在接種后25 d 維持與接種后48 h 相似的表達水平。Defensin-like protein 5(V5LFZ0)在接種后48 h 的表達上調,而在接種后25 d 的表達顯著下調。LSP1(C7SG38)在接種0 h 和接種后48 h 維持穩定的表達水平,而在接種后25 d 的表達水平顯著上調。
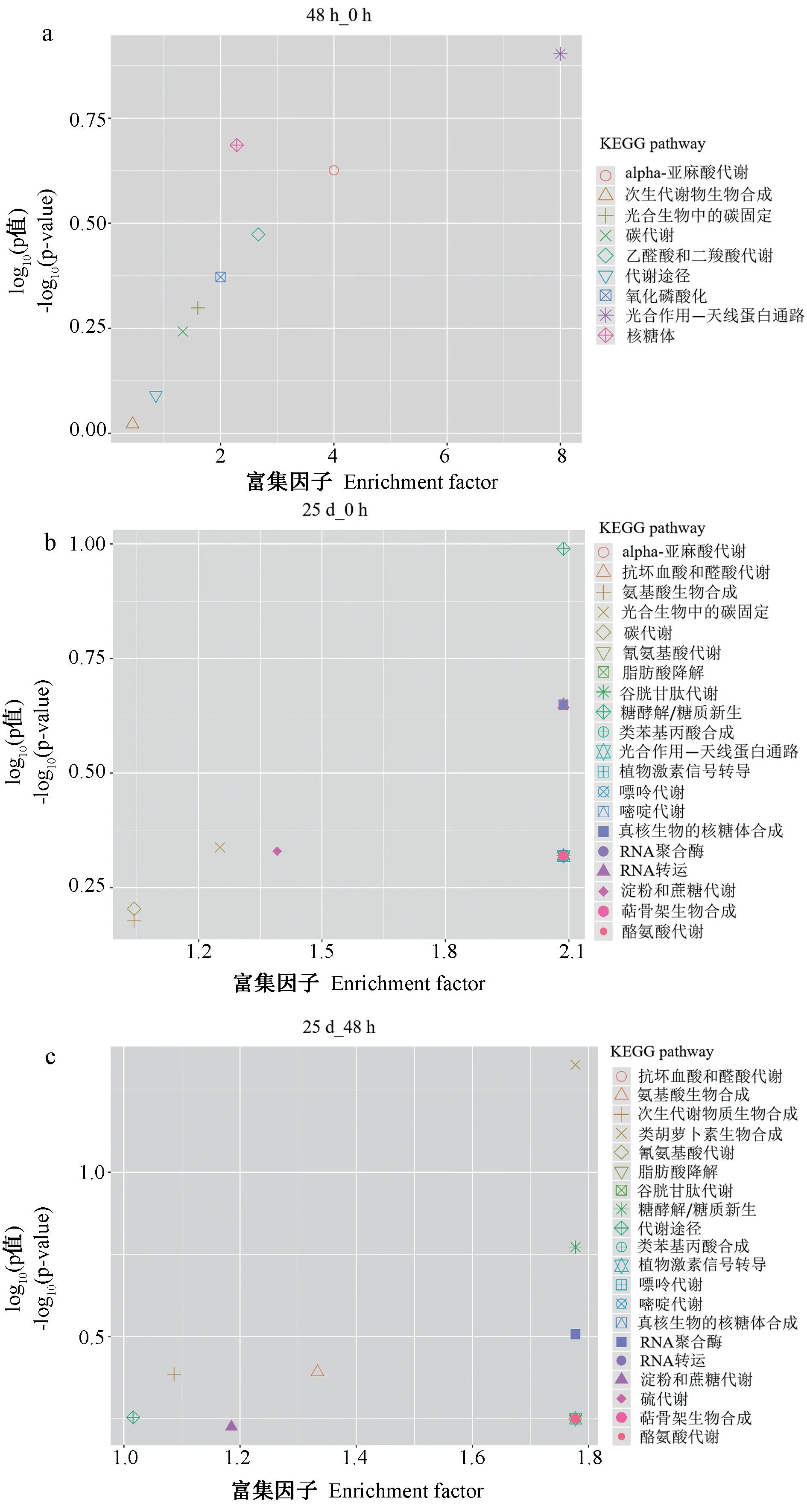
圖4 DEPs 的KEGG 功能富集分析Fig.4 KEGG pathway enrichment analysis of DEPs
3 討論
mRNA、miRNAs 和siRNAs 等諸多因子參與西瓜對CGMMV 的脅迫應答[9-13]。為了在蛋白質水平上鑒定參與CGMMV 脅迫應答的蛋白質,本研究利用iTRAQ 結合LC-MS/MS 技術共獲得61 個DEPs。與黃瓜響應CGMMV 脅迫的DEPs 相比,本研究中的部分DEPs,如細胞色素b6、核糖體蛋白、肌動蛋白及NADP(H)氧化還原酶等,參與西瓜對CGMMV 的脅迫應答。

圖5 西瓜響應CGMMV 的DEPs 的蛋白質-蛋白質相互作用網絡Fig.5 Protein-protein interaction analysis of DEPs in response to CGMMV stress in watermelon
3.1 CGMMV 脅迫影響西瓜諸多生理生化過程
受病毒感染的植物通常表現為光合速率降低,這表明光合作用是宿主抗病毒防御應答中被抑制的主要生命活動[19]。本研究中,7 個光系統Ⅰ/Ⅱ蛋白( A0A1P8LDA4、 A0A1P8LDG4、 A0A1P8LDM9、A0A1P8LDV7、 A0A1P8LEY8、 A0A1P8LEZ9 和A0A1P8LF51)被鑒定為DEPs,這與之前的報道一致。例如,轉基因番茄中與光系統Ⅰ/Ⅱ相關的蛋白質在CMV 的脅迫應答中呈現差異表達[20]。其中,光系統Ⅱ反應中心蛋白H(A0A1P8LEZ9)是光系統Ⅱ反應中心核心的重要組成部分,可將光能轉換為電化學能[21],其在CGMMV 感染后48 h 和25 d 呈下調表達。此外,光系統Ⅱ47 kDa 蛋白和光系統ⅡD1 蛋白在接種CGMMV 后25 d 呈上調表達,表明維持正常光合作用對西瓜抵御CGMMV 的侵染至關重要。
能量代謝受植物-病毒相互作用的影響。本研究中,3 個ATP 合酶 亞基(A0A1P8LD68、D5I3A7 和D5I3B4) 和2 個NADH 脫氫酶亞基(D5I3C1 和D5I3D0)參與西瓜對CGMMV 的脅迫應答,其中ATP酶(D5I3A7 和D5I3B4)和NADH 脫氫酶(D5I3C1 和D5I3D0)的表達上調。擬南芥ATP 酶CRT1 可與多種抗性蛋白相互作用,調節擬南芥對蕪菁皺縮病毒的抗病性[22]。水稻OsAAA-APTase1 在SA 介導的對稻瘟病菌(Magnapor the oryzae)的防御反應中發揮重要作用,過表達OsAAA-ATPase1 可顯著提高致病相關基因的表達和對M. oryzae的抗性;反之,RNAi 沉默該基因抑制水稻對M. oryzae的抗性[23]。
核糖體蛋白質參與rRNA 結構的產生及蛋白質合成機制的運作,同時也可保護植物免受病原菌的侵害[24-25]。核糖體蛋白編碼基因RPL12 和RPL19 在本氏煙草中被沉默后,非寄主細菌誘導的過敏反應延遲;擬南芥AtRPL12 和AtRPL19 突變體的非寄主抗性也降低,說明RPL12 和RPL19 通過同一途徑獲得非寄主抗性[24]。棉花中GaRPL18的表達受到黃萎病菌(Verticillium dahliae)侵染的誘導,GaRPL18 的表達模式與不同品種的抗病性水平一致;GaRPL18 基因沉默使抗性材料中免疫相關因子的豐度降低,抗性材料變為易感材料;GaRPL18 過表達擬南芥對黃萎病的抗性明顯提高[25]。本研究中,9個核糖體蛋白( A0A1P8LDK7、A0A1P8LDU4、A0A1P8LEJ1、A0A1P8LEJ2、A0A1P8LEM9、A0A1P8LEV3、A0A1P8LEV5、A0A1P8LEX7 和D5I3A5) 在CGMMV侵染后呈現差異表達,表明這些核糖體蛋白在CGMMV 脅迫應答中發揮重要作用。
乙烯作為重要的信號可調控植物對一系列生物和非生物脅迫的應答。研究報道煙草中EREBP/AP2 過表達可誘導多個致病相關基因的表達,提高煙草對病原體及鹽脅迫的耐受性[26]。本研究發現了2 種參與乙烯信號轉導的差異表達蛋白,分別是乙烯受體(V9QGW9)和乙烯響應因子(X2KY76)。其中,乙烯受體在25 d_0 h 和25 d_48 h 呈上調表達,乙烯響應因子在25 d_48 h 呈上調表達,表明誘導的乙烯信號蛋白與CGMMV 的防御應答有關。
3.2 CGMMV 脅迫下的重要蛋白質及調控機理
植物病毒可以在感染周期通過宿主植物的翻譯因子來翻譯其自身的病毒RNA,翻譯起始因子在植物-病毒相互作用中賦予植物抵抗病毒感染的能力[27-29]。與0 h 和48 h 相比,本研究中的2 個真核翻譯起始因子:eIF (iso) 4E (C7SG38) 和eIF6A (Q6I663), 在CGMMV 侵染后25 d 呈現顯著上調表達,參與對CGMMV 的脅迫應答。植物eIF4E 家族成員是眾所周知的宿主因子,在多種病毒感染中起關鍵作用[27-29]。植物eIF4E 的主要作用是通過結合5′cap [m7G(5′)ppp(5′)N]和其他翻譯因子,進而控制蛋白質在真核細胞中的表達[30]。大白菜eIF(iso)4E 基因(retr02)的剪接變異體在第1 個外顯子處產生一個終止密碼子,產生一個截短、無功能的蛋白質,蕪菁花葉病毒(turnip mosaic virus,TuMV)可以在2 個位點上使用eIF(iso)4E 的拷貝,使大白菜產生持久的TuMV 抗性[31]。TuMV 感染植物時,需要病毒末端結合蛋白(viral protein genome-linked,VPg)與宿主eIF4E 或eIF(iso)4E 相互作用才能啟動翻譯[32]。擬南芥eIF(iso)4E 突變導致對TEV、TuMV 產生廣譜抗性[33]。此外,TuMV VPg 僅與擬南芥eIF(iso)4E 基因(AT5G35620)相互作用,而不與擬南芥的其他eIF4E 發生互作[34]。eIF6 是60S 核糖體核仁生物合成所必需的蛋白[35],但目前鮮有報道表明其參與植物對病毒的脅迫應答。本研究中,eIF6A 與RAN3、LSP1、RPL23.2、RPS15A 等蛋白互作,參與CGMMV 的脅迫應答。
熱激蛋白(heat shock proteins,HSPs)被認為具有分子伴侶的功能,在植物中普遍存在,當機體受到不同脅迫時,HSPs 可以保護其靶蛋白不變性,不發生錯誤折疊和聚集[36-37]。sHSPs 作為HSPs 的重要成員,其分子量為15 ~42 kDa,在應答植物生物脅迫中發揮重要作用[38]。本研究中sHSPs 成員HSP22.8(H6TB36)的表達在CGMMV 接種后25 d 顯著上調。水稻HSP20 的表達受水稻條紋病毒(RSV)感染的影響,此外,發現HSP20 與RSV 蛋白(RdRp) 和運動蛋白(NSVc4)相互作用,在RSV 復制和運動中發揮重要作用[39-40]。CGMMV 侵染西瓜后,sHSP 的表達上調,進一步通過酵母雙雜、GSP pull-down 及免疫共沉淀分析發現,CGMMV 解旋酶(helicase HEL)可與西瓜sHSP互作,說明sHSP 可能調節宿主防御機制以應對CGMMV 的侵染[41]。
3.3 CGMMV 脅迫下的蛋白質組與轉錄組比較分析
浙江省農業科學院蔬菜研究所西瓜組前期對CGMMV 侵染前后(0 h 及24 h)的西瓜葉片進行轉錄組測序,共獲得1 641 個差異表達基因(DEGs),包括886 個上調和755 個下調DEGs[10]。本研究共鑒定到61 個DEPs。與DEPs 相似,KEGG 功能分析顯示這些DEGs 同樣參與光合作用、植物激素信號轉導、次生物質代謝等KEGG 代謝途徑[10]。通過DEGs 與DEPs 的比較分析,發現葉綠素a/b 結合蛋白、NADH 脫氫酶、核糖體蛋白、光系統Ⅰ/Ⅱ相關蛋白、β-葡萄糖苷酶、蔗糖合成酶、HSP22 等在蛋白水平和基因水平上均呈現差異表達。如葉綠素a/b 結合蛋白(D1MWY9)在CGMMV 侵染后48 h 和25 d 均呈現顯著下調表達;葉綠素 a/b 結合蛋白基因(Cla004746、 Cla018117、Cla022573、 Cla019105、 Cla017325、Cla022963、Cla011748、 Cla012368、 Cla019595、 Cla013826 及Cla011145)在CGMMV 侵染后24 h 均呈現顯著下調表達。與蛋白表達水平一致,核糖體蛋白、NADH 脫氫酶及光系統Ⅰ/Ⅱ相關蛋白的編碼基因在CGMMV 侵染后24 h 呈現顯著下調表達。β - 葡萄糖苷酶(G9BSA4)及蔗糖合成酶(Q9SBL8)在CGMMV 侵染后25 d 呈現顯著上調表達,而β-葡萄糖苷酶基因(Cla004804) 及蔗糖合成酶基因(Cla017392、Cla011131 及Cla009124)在CGMMV 侵染后24 h 即呈現顯著上調表達。上述結果表明,參與西瓜光合作用的蛋白和基因在CGMMV 脅迫早期即表現出響應;而參與次生物質代謝的蛋白對CGMMV 脅迫應答的響應較基因要延遲一些。
4 結論
本研究通過iTRAQ 技術鑒定到61 個參與CGMMV 脅迫應答的蛋白質,這些DEPs 參與光合作用、植物激素信號轉導、次生物質代謝等KEGG 代謝途徑。此外,本研究還明確了這些蛋白質之間的相互作用和調控網絡。本研究結果在蛋白質水平上明確了西瓜響應CGMMV 的脅迫應答,為后續提高西瓜對CGMMV 的抗性及闡明其分子機理奠定了基礎。

