甲殼素脫乙酰酶的研究進展
郭依依,蔡 俊*
(湖北工業大學 生物工程與食品學院,湖北 武漢 430068)
甲殼素(C8H13O5N)n又稱幾丁質,是存在于各類甲殼動物的外殼及真菌細胞壁中的一種難溶的N-乙酰-D-葡萄糖胺聚合物,其高度延伸的氫鍵半晶結構使其難以溶于一般的稀酸稀堿及有機溶劑,這極大限制了甲殼素的應用[1-2]。當脫乙酰度達到50%時,甲殼素的溶解性能大大增強,當脫乙酰度達到55%及以上時,則為殼聚糖。殼聚糖分子易于進行化學修飾且溶解性能好,廣泛應用于輕工業、美容業、農業及生物醫學等領域[1-3]。
目前殼聚糖的制備方法主要為化學法,物理法。化學法是在高溫條件下、利用強酸或強堿來脫去甲殼素的乙酰基,不僅能耗高,污染環境、且得到的產品不穩定(乙酰度不均勻,分子量變化大,乙酰基所在位置不固定),已逐漸被摒棄;物理法是通過輻射作用使甲殼素分子內的化學鍵發生斷裂而降解,有微波輻射和超聲輻射等,產物是分子量較寬的復雜混合物[3-4]。而利用甲殼素脫乙酰酶(chitin deacetylase,CDA)(E.C.3.5.1.41)處理甲殼素能夠獲得高品質的殼聚糖,且反應過程綠色環保,因此尋找到高質量CDA或產CDA菌株迫在眉睫。本文對CDA研究進展進行了綜述,以期為今后的研究提供參考。
1 甲殼素脫乙酰酶的概述
1.1 理化性質
不同來源的CDA在分子質量、細胞內的存在位置、最適溫度及pH值等方面存在較大差異[5-12]。部分微生物來源的CDA相關的理化性質見表1。目前自然界中發現的CDA均為糖蛋白,通常分布于細胞質、周質空間或分泌到細胞外中;分子質量為50~150 kDa;最適pH值在4.5~9.0;等電點多在2.5~5.0;最適溫度多為50 ℃;該酶對甲殼素低聚糖有活性,對結晶態的甲殼素底物沒有活性;不同種類或不同濃度的金屬離子對CDA活性的影響不同,如低濃度的Ca2+、Mn2+、K+對來源于紅球菌的CDA的酶活起促進作用,但隨著濃度的升高逐漸呈抑制作用;CDA催化脫乙酰過程中會釋放出乙酸或乙酸鹽,因此受乙酸抑制的CDA不適合應用于工業化脫乙酰。
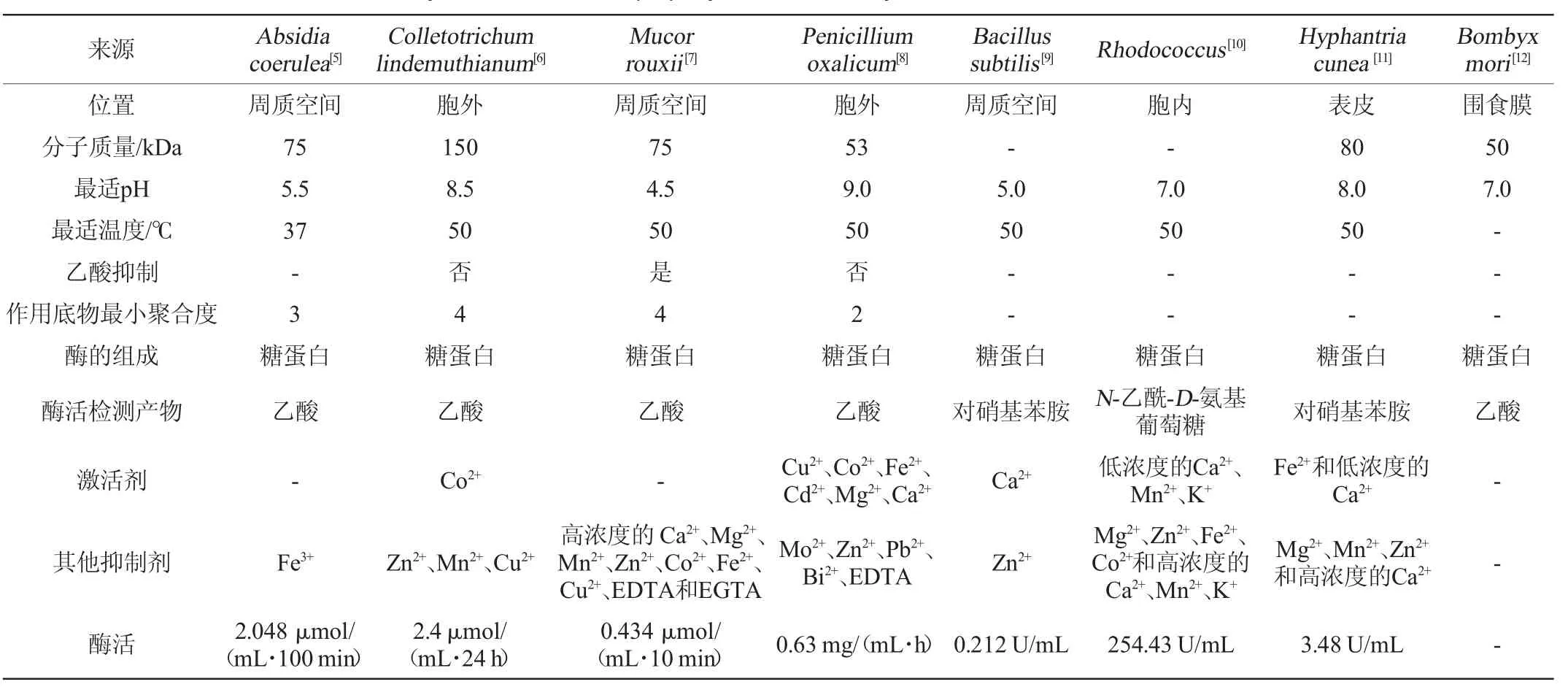
表1 部分微生物來源的甲殼素脫乙酰酶的理化性質Table 1 Physical and chemical property of chitin deacetylase from some microbial sources
1.2 分類
CDA是一種專一性的用于甲殼素脫去乙酰基的糖酯酶。它和乙酰木聚糖酯酶(EC 3.1.1.72)、殼寡糖脫乙酰酶(EC 3.5.1.-)、肽聚糖脫乙酰酶(EC 3.5.1.-)和β-1,6-葡聚糖脫乙酰酶(EC 3.5.1-)等同屬糖酯酶4家族(carbohydrate esterase family 4,CE4)[13]。CE4家族酶的特點是:它們均可攻擊糖鏈分子上的酰胺鍵(非肽鍵),但具有不同的底物偏好性;它們都具有結瘤因子脫乙酰酶蛋白(deacetylase protein of nodular factor,NodB)同源結構域(特征為(β/α)8桶折疊,即核心是7個或8個平行的β鏈,外周圍被α螺旋包圍形成扭曲的β桶。β桶裝飾的一系列環構成了大部分碳水化合物的結合口袋)[14-15]。該區域通常由五個保守的基序定義:基序1(TFDD),由兩個連續的天冬氨酸殘基組成,可結合金屬配體。基序2 H(S/T)xxH中的絲氨酸(serine,Ser)或蘇氨酸(threonine,Thr)殘基與第二個組氨酸(histidine,His)形成氫鍵以穩定活性位點的局部構象。此外,來自基序1的天冬氨酸(aspartic acid,Asp)和基序2中的兩個His殘基共同構成了His-His-Asp金屬結合三聯體。基序3(RxPY)和基序4(DxxD(W/Y))共同構成活性位點凹槽。基序5I(V/I)LxHD為底物結合口袋。圖1將不同來源的CE4酶進行序列比對驗證了這一點,此外這5個基序的空間位置通過圖2的蛋白晶體結構模型表示;都為金屬依賴性水解酶,具有Zn2+和Co2+作為最常見的金屬配體[16-17]。
CDA也屬于甲殼素酶系,甲殼素酶系是作用于甲殼素及其相關衍生物的酶的總稱,主要成員有甲殼素脫乙酰酶和甲殼素酶,CDA與甲殼素相關酶系聯用,可得到一系列具有生理活性的多糖產品[18]。如圖3所示,從作用底物聚合度n來看,甲殼二糖酶作用范圍最窄,其次為N-乙酰-β-葡萄糖胺酶、甲殼素酶,殼聚糖酶和CDA范圍最廣,n≥2的底物均可作用;從作用化學鍵來看,只有CDA可專一性脫去底物的乙酰基,得到殼聚糖及其他具有生理活性的寡聚體,其他酶則作用于糖苷鍵,使分子鏈斷裂,此功能往往可被溶菌酶、纖維素酶、蛋白酶和脂肪酶等其他非專一性酶類代替。

圖1 甲殼素脫乙酰酶催化域的多重序列比對結果Fig.1 Alignment results of multiple sequence of chitin deacetylase catalytic domains
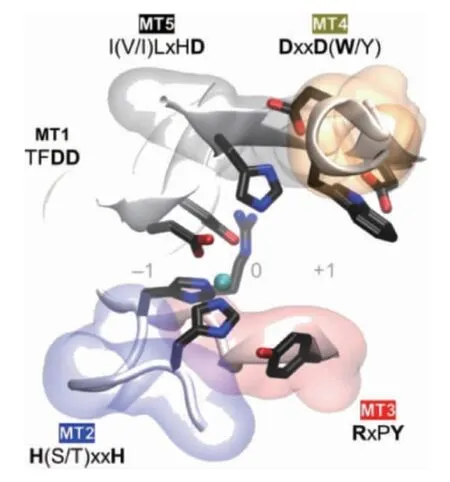
圖2 基序1~5的空間位置在蛋白晶體結構模型中的體現Fig.2 Reflection of spatial position of motif 1-5 in the crystal structure model of protein
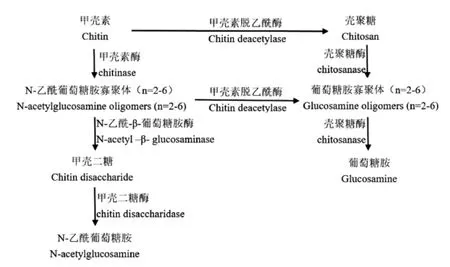
圖3 甲殼素酶系作用關系圖Fig.3 Relation diagram of action of chitin-related enzymes
1.3 來源及生理學作用
CDA在真菌(如魯氏毛霉(Mucor rouxii)、藍色犁頭霉(Absidia coerulea)、構巢曲霉(Aspergillus nidulans)、豆刺盤孢(Colletotrichumlindemuthianum)、米根霉(Rhizopusoryzae)、總狀毛霉(Mucor racemosus)、黑根霉(Rhizopus nigricans)、短柄梨孢帚霉(Scopulariopsis brevicaulis)、金龜子綠僵菌(Metarhizium anisopliae)、單胞銹菌屬(Uromyces)及啤酒酵母(Saccharomyces cerevisiae)等),細菌(如腸炎弧菌(Vibrio alginolyticus)、枯草芽孢桿菌(Bacillus subtilis)和紅球菌(Rhodococcus)等),某些節肢動物(昆蟲綱和甲殼綱,如Locusta migratoria、Hyphantria cunea、Exopalaemon carinicauda和Penaeus monodon等)中均有發現[5-12,19-21]。不同來源或相同來源不同基因編碼的CDA在作用時間、空間和效果上差異很大。CDA通過催化產生組成某些生物體的結構物質殼聚糖和與分子識別有關(如細胞信號傳導和形態發生,充當免疫應答誘導子和宿主-病原體介體)的小分子寡聚體來發揮其生理學作用。下面從不同的來源具體闡述。
真菌:某些接合菌中,CDA與甲殼素合酶結合緊密。CDA攻擊后者產生的尚未形成晶態結構的新生甲殼素,得到合成細胞壁、孢子壁和某些營養結構中的殼聚糖[22];某些分泌到胞外的CDA則在真菌自溶過程中發揮作用。它們協同甲殼素內切酶(endochintinase)E.C.3.2.1.14水解細胞壁中的甲殼素,瓦解細胞壁結構[5];真菌病原體的植物防御逃脫機制也與CDA的功能密切相關,真菌病原體在入侵植物后,其細胞壁上的甲殼素會被宿主識別作為入侵信號,并迅速觸發抗性反應產生特異性抗體,而此時真菌會分泌一種內源性CDA,通過改變細胞壁甲殼素的脫乙酰度(degree of deacetylation,DD)使之無法被特異性受體進一步識別從而逃避植物的防御機制;類似的,一些昆蟲病原真菌的CDA具有修飾昆蟲表皮甲殼素使其易于滲透以及改變自身細胞壁以抵御昆蟲甲殼素酶的侵襲的雙重作用[14,23-24]。
細菌:細菌中,CDA存在于細胞內或細胞外,分泌到胞外的CDA通常參與環境中甲殼素的降解,如某些海洋細菌[25]。某些可使昆蟲致病的細菌也會分泌出CDA作用于昆蟲外殼或營養器官,使其理化性質發生改變從而實現侵染[26];存在于細菌細胞內的CDA通常與分子識別有關,如根瘤菌和豆科植物的識別及結瘤過程中,根瘤菌吸附到寄主根毛上,然后由侵染線侵入寄主后誘發根瘤。在這個過程中,CDA與N-乙酰氨基葡萄糖轉移酶以及酰基轉移酶等共同參與了結瘤因子(nodular factor,NF)的合成,這類因子可誘導宿主植物根毛卷曲和膨脹以便于根瘤菌的入侵[27]。
節肢動物:CDA在昆蟲的整個生長發育過程中都起著重要作用,如器官的形成、表皮甲殼素的修飾、正確蛻皮、誘導幼蟲轉化成蛹等,機體通過編碼CDA來軟化組織,實現生長發育。研究發現昆蟲針對不同的組織細胞(表皮細胞、胸肌細胞、腸內壁細胞等),可以編碼不同類群的CDA蛋白,從而調節自身生長[11-12,28];同時CDA還參與某些甲殼類動物的免疫機制,推測其機理是甲殼類動物遭到侵染時,體內CDA大量合成的殼聚糖(多陽離子聚合物)可與病原菌細胞表面的生物大分子帶負電的側鏈相互作用,形成聚合物或直接進入其細胞核,與DNA結合,影響mRNA和蛋白質的合成來抑制病原菌的生長[20-21]。
1.4 作用機理
CDA為典型的金屬依賴性水解酶,其催化機制為金屬輔助的酸/堿催化[17,29]。下面以VCC CDA催化甲殼二糖為例,探討CDA催化脫乙酰的一般過程。如圖4所示,催化過程中Zn2+、Asp40的羧基和His97和His101的咪唑基是催化作用所必需的。首先,活化水分子的親核氧原子攻擊底物羰基碳原子,同時D39作為廣義堿,從Zn2+-結合水吸取一個質子,形成一個帶負電荷四面體過渡態中間物,通過Zn2+和His97、His101帶正電荷的側鏈的靜電相互作用給以穩定。然后His295的咪唑基作為通用酸提供一個質子給底物的-NH基,C-N鍵隨之斷裂得到游離胺,并釋放出乙酸鹽[30]。
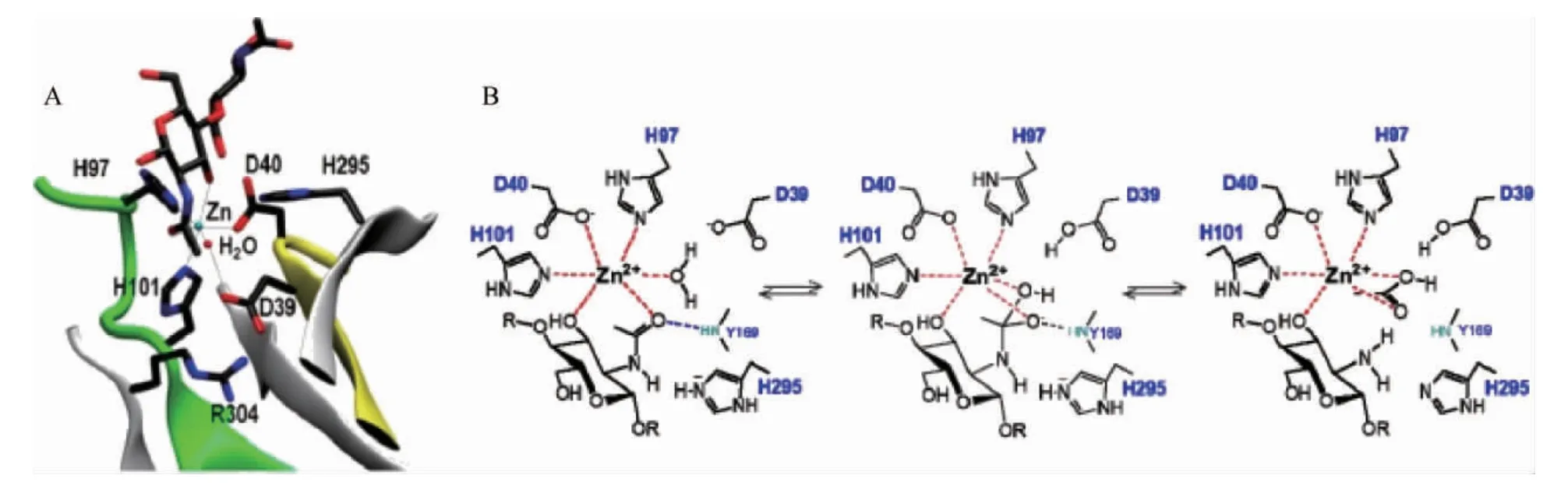
圖4 VcCDA·DP2絡合物中活性位點殘基的X射線結構圖(A)及CE4脫乙酰酶的金屬輔助通用酸堿機制作用過程(B)Fig.4 X-ray structure diagram of active site residues in VcCDA·DP2 complex (A) and metal-assisted general acid-base mechanism process of CE4 deacetylase (B)
不同來源的CDA在催化過程中表現出不同的脫乙酰模式(deacetylation pattern,PA),即多重攻擊、多鏈和單鏈機制[31]。多重攻擊在毛霉中最為常見,CDA的作用過程大致如下:首先,酶隨機結合到底物分子鏈的任一序列上,然后以結合部位的非還原端為起點,沿著該鏈脫去乙酰基,水解完畢后,與底物解離,然后結合到另一條底物分子鏈上,開始新一輪的水解[7]。多鏈機制和多重攻擊類似,CDA隨機攻擊某一序列的任意位點,但是每次只能脫去一個乙酰基便與底物解離。單鏈機制是CDA酶識別底物的某一固定位點,然后與底物結合進行連續的脫乙酰化過程。總的來說,多重攻擊和多鏈機制為多位點作用,多重攻擊和單鏈機制可連續進行乙酰化。這三種不同的脫乙酰模式往往會得到兩類產物,無擇優攻擊的多鏈機制會產生單元隨機分布的二元雜多糖,即N-乙酰氨基葡萄糖(N-acetylglucosamine,GlcNAc)和氨基葡萄糖(Glucosamine,GlcNH2)單元交替分布,而可連續脫乙酰的的多重攻擊機制和單鏈機制會產生嵌段共聚物,即以GlcNAc和GlcNH2為單元的聚合物鏈段交替分布[32]。
CDA對不同的底物其催化效果與速率有所差異。以甲殼素為例,天然甲殼素分子結構致密,由一根長鏈上的氨基與相鄰長鏈上的羰基之間形成氫鍵而聚合。其分子聚合度(degree of polymerization,DA)、脫乙酰度和結晶度都會影響CDA脫乙酰效果。通常CDA對于分子質量較小,脫乙酰度高,結晶度低的可溶性底物酶活更高[33]。
2 甲殼素脫乙酰酶菌的生產
2.1 產甲殼素脫乙酰酶菌株的選育
CDA菌株的選育主要有三種途徑:自然篩選、誘變育種和構建基因工程菌。CDA的自然來源很豐富,但天然獲得的CDA酶存在很多問題:野生型微生物產酶量低,粗酶液雜質多,且多為胞內酶,不易分離純化。并且某些物種能夠編碼的不同的CDA,其在功能和作用機制上都存在差異(如作用位點、攻擊方式、所得產物等),難以應用于高端酶市場[5-10,19]。通過誘變選育產CDA菌株,雖然可以提高酶的產量,但誘變菌株通常情況下是不穩定的[34]。目前這些不足均可以通過基因工程技術解決,首先通過基因工程手段可以將各種來源,從細菌到真核生物的CDA基因進行表達研究,通過一系列的基因改造獲得酶學特性和產量穩定的CDA,融合組氨酸標簽(histidine-tag,His-Tag)以及谷胱甘肽S轉移酶標簽(glutathione S-transferase-tag,GST-tag)便于CDA的純化,甚至將CDA與殼聚糖酶融合表達,提高其應用性能。
工程菌成功構建例子較多,目前已在多種宿主中進行表達,但多為大腸桿菌,而且用大腸桿菌表達時,常常會陷入包涵體表達的問題,所以需要挑選合適的載體,例如融合GST和麥芽糖結合蛋白(maltose binding protein,MBP)等,利于蛋白折疊;或使用分泌性表達載體[14,22,26]。同時由于CDA的來源廣,所以在跨種族進行表達時,需要注意密碼子通用性的問題。如某些生物中的編碼氨基酸的密碼子,可能在大腸桿菌中為終止密碼子,如蜜蜂螺原體Spiroplasma melliferumCH-1的CDA基因中編碼色氨基酸的密碼子在大腸桿菌中為終止子[35],所以必要時需要通過定點突變技術進行改造,同時在遇到密碼子偏好性的問題導致蛋白表達量低時,針對大腸桿菌的密碼子優化時必不可少。酵母菌也是常用的表達宿主之一,酵母菌擁有完整的分泌表達體系,能夠促使異源蛋白正確折疊,并分泌至胞外,其酵母表達系統具有糖基化的作用,不僅能提高異源蛋白的穩定性,同時對其酶活提升也會有所幫助可能提高(有研究表明CDA為糖蛋白)。昆蟲表達系統是目前新興的表達系統,具有對外源蛋白折疊修飾的功能,且能表達具有內含子的外源基因,其在表達昆蟲來源的CDA時具有天然的優勢,孫曉彤等先后利用畢赤酵母和昆蟲細胞表達甜菜夜蛾的CDA1(spodoptera exigua CDA1,SeCDA1)并在昆蟲細胞表達系統中獲得較好的表達效果,相比畢赤酵母提升了0.39倍[35],同樣的,研究人員在表達家蠶CDA1(Bombyx moriCDA1、BmCDA1)、美國白蛾CDA1(Hyphantria cuneaCDA1,HcCDA1)、HcCDA2等昆蟲的CDA基因時也發現了昆蟲細胞表達系統的優異性能[11-12]。而由于昆蟲細胞培養條件嚴苛,成本昂貴,并不適用于當下大規模生產,但卻是今后表達CDA最具潛力的表達系統。
2.2 甲殼素脫乙酰酶的分離純化
CDA的分離純化方法根據酶蛋白存在的位置和生產菌株是否為基因工程菌而有所不同。分泌到胞外的CDA酶可直接從發酵上清液中提取。若發酵上清液中無酶活,且用表面活性劑清洗菌體后仍然不顯活性,則可初步斷定該CDA為胞內酶(可采用免疫熒光技術和免疫膠體金標記法進行準確的細胞定位)[5,7,36]。由于野生型微生物中的CDA往往分布在細胞內(細胞壁、細胞周質空間等),導致CDA在純化上的困難,尋找到合理的破碎細胞方法極為關鍵,一般有機械法(搗碎、研磨、勻漿)、物理法(溫差、壓差、超聲)和生物化學法(化學試劑滲透、自溶、酶解)以及復合處理法。前處理之后,采用硫酸銨沉淀法和超濾法將粗酶液濃縮和粗分離,以除去核酸、多糖等雜質。細分級過程中,天然甲殼素脫乙酰酶蛋白多采用層析法,常用的有離子交換層析與親和層析[5-8]。而重組甲殼素脫乙酰酶蛋白,通常人為加上了融合標簽,因此分離純化步驟比天然的簡化很多。如融合了His-tag的重組酶,能夠利用鎳柱親和層析快速純化[37]。
3 展望
CDA有著豐富的生物來源和獨特的生理學作用,圍繞著CDA酶可以開發出多種功能。目前用CDA取代NaOH熱堿法生產殼聚糖已是大勢所趨,某些CDA還可以生產特定的寡糖產品。如來源于Mucor rouxii的CDA可生產還原端具有一個乙酰基的甲殼寡糖[7];Colletotrichum lindemuthianum中的CDA可催化脫乙酰反應的逆反應,在殼聚二糖的非還原端加上一個乙酰基得到β-D-GlcNAc-(1-4)-GlcN或得到具有3個乙酰基的殼聚四糖[6]。此外,CDA參與合成構成真菌細胞壁的重要結構物質殼聚糖,且在昆蟲的生長發育過程中發揮著重要作用,是理想的抗真菌藥物和昆蟲防治的作用靶點,但是CDA的工業化應用在短期內仍難以實現。自然選育的野生CDA菌株所產酶多為胞內酶,不易分離純化,基因工程手段得到的菌株則多產沒有活性的包涵體,而且目前最為迫切的一個問題就是,無論是天然CDA還是重組CDA都難以降解具有致密晶體結構的天然甲殼素。嘗試從菌株的選育、酶蛋白的修飾和底物的改造三方面著手來解決問題:①考慮到海洋中大量含天然甲殼素的蝦蟹殼等物質被微生物降解,海洋生物具備產催化難溶底物CDA的潛力;②選用昆蟲細胞作為表達系統,獲得酶活力高且直接分泌到胞外的CDA酶,并對其進行蛋白質分子的修飾與改造;③在用CDA催化底物之前,對天然甲殼素進行預處理破壞其晶態結構,對后續降解至關重要,酶法預處理將會是一個大的趨勢。如預先用多糖裂解單加氧酶(lytic polysaccharide monooxygenase,LPMO)氧化裂解甲殼素原纖維表面上的糖鏈,暴露出晶體內部的乙酰基,能大大加快CDA后續的脫乙酰進程[38]。此外,由于CDA和一些相關的CE4酶均對殼寡糖(chitosan oligosaccharide,COS)表現出催化活性,且作用機理相似,現有的以乙酰苯胺和殼寡糖等為底物的酶活測定方法可能無法區別這些酶。因此,某種新發現的具有催化脫乙酰活力的酶是否為CDA還需加以甄別,可從三方面進行:①從來源與生理學作用初步推測,如存在于細菌周質空間中與細菌細胞壁(含肽聚糖)合成相關,很可能為肽聚糖脫乙酰酶[39]。分泌到細胞外用于分解代謝植物細胞壁(含木聚糖)的極有可能為乙酰木聚糖酯酶[40]。②根據其底物偏好性,檢測其對不同底物的催化活力加以證實。③將該酶的基因序列與已報道的多種CDA基因進行序列比對,甚至結晶得到蛋白質晶體與已上傳的蛋白質數據庫(protein database,PDB)結構比較進一步驗證。CDA的應用潛能無可替代,但需要做的還有很多,如規范CDA的酶活測定方式,深入了解更多的CDA蛋白分子結構等。

