生大黃對腦出血大鼠磷脂酰肌醇-3激酶/蛋白激酶信號通路的影響及其神經保護機制
謝作常,田少斌
腦出血是一種自發性的急性腦實質出血,可導致嚴重的殘疾[1]。據報道,超過三分之一的腦出血病人在出現癥狀后1個月死亡,20%的幸存者可在6個月后獨立生活,部分可致永久殘疾[2-3]。腦出血的病理生理機制十分復雜,早期血腫生長和以炎癥為主的血腫周圍損傷被認為是其最重要的機制。此外,通過靶向轉錄因子、細胞因子、酶、小膠質細胞活化或氧化應激以降低炎癥反應和細胞死亡也被證實與腦出血的發病機制有關[4-5]。有研究表明,生大黃溶液對預防高危病人內鏡逆行胰膽管造影后胰腺炎和高淀粉酶血癥是安全有效的,并且未發現副作用[6]。有研究發現,生地大黃湯對腦出血大鼠有確切的神經保護作用,能降低神經功能缺損評分[7]。另一項研究表明,生地大黃湯能改善腦出血大鼠腦組織炎性損傷,減少細胞凋亡數[8]。但是,具體機制有待進一步探究。磷脂酰肌醇-3激酶(PI3K)/蛋白激酶(Akt)信號通路在多種細胞過程如細胞存活和增殖過程中被激活[9],這一信號通路涉及神經紊亂的減少和神經元細胞的存活[9-10]。渥漫青霉素(Wortmannin,WORT)是其相對特異性抑制劑,替普瑞酮(GGA)通過藥物作用于實驗性腦出血大鼠模型中的PI3K/Akt信號通路,發揮部分神經保護作用[11]。因此,本研究推測生大黃通過藥物作用于PI3K/Akt信號通路,從而發揮神經保護作用,并對此進行驗證。
1 材料與方法
1.1 動物及藥物 180只SPF級雄性SD大鼠,體質量220~240 g,飼養條件:室溫24.5~25.0 ℃,光照黑暗周期為12 h/12 h交替,自由進食飲水。生大黃50 g,采用100 mL沸水浸泡10 min。
1.2 動物分組 180只大鼠隨機分為9組:對照組、假手術組(給予相同劑量的生理鹽水對照)、腦出血組、腦出血加200 mg/kg生大黃湯組、腦出血加400 mg/kg生大黃湯組、腦出血加800 mg/kg生大黃湯組、腦出血+WORT組、腦出血+生大黃湯+WORT組和對照+800 mg/kg生大黃湯組,每組20只。
1.3 造模方法 參照文獻[12]方法建立實驗性腦出血大鼠模型。腹腔注射鹽酸西拉嗪(4 mg/kg)及氯胺酮(30 mg/kg),將大鼠放置在一個立體定位儀,顱骨打孔。通過離體定位儀向紋狀體注射Ⅶ型膠原酶,超過5 min制造腦出血模型,用骨蠟封住開顱。
1.4 動物給藥 對照組:不經任何處理。對照+800 mg/kg生大黃湯組:灌胃生大黃湯800 mg/kg。腦出血組:按腦出血造模方法造模。假手術組:按腦出血造模方法,但注射Ⅶ型膠原酶時給予相同劑量的生理鹽水。腦出血加200 mg/kg生大黃湯組、腦出血加400 mg/kg生大黃湯組、腦出血加800 mg/kg生大黃湯組:生大黃湯灌胃,劑量分別為200 mg/kg、400 mg/kg和800 mg /kg,48 h后,按腦出血造模方法造模。腦出血+WORT組:將PI3K的特異性抑制劑WORT(Sigma,美國,16 mg/kg)通過5 μL微量注射器注入大鼠側腦室,48 h后,按腦出血造模方法造模。腦出血+生大黃湯+WORT組:將PI3K的特異性抑制劑WORT(Sigma,美國,16 mg/kg)通過5 μL微量注射器注入大鼠側腦室,30 min后灌胃生大黃800 mg /kg,48 h后按腦出血造模方法造模。
1.5 神經功能缺損評估 術后6 h、24 h、48 h、72 h、7 d用Garcia評分量表檢測神經功能缺損情況。包括對稱性、四肢運動的自發活動、前爪伸展、身體本體感覺、攀爬和對振動的反應[13]。每項測試計0~3分,研究中6項測試共計18分。由一名對干預方法不知情觀察者進行行為評估。
1.6 大腦含水量測量 術后6 h、24 h、48 h、72 h、7 d麻醉處死大鼠,采用斬首法測定腦含水量[1]。大鼠大腦移除后用電子分析天平稱重,得到濕重,干燥后得到干重。
1.7 血腫體積評估 用5%異氟醚深度麻醉大鼠后,用30 mL磷酸緩沖鹽溶液(PBS)進行心臟灌注處理。左半球、右半球切除分離后,將大腦放入含有3 mL PBS的玻璃管中。血腫體積用光度法測定[14-15]。
1.8 免疫印跡分析 取大鼠大腦,在10% SDS-PAGE凝膠上分離蛋白,轉移到PVDF膜上,封閉液封閉后分別用一抗Akt(1∶1 000,Santa Cruz)和一抗p-AKT(1∶1 000,Santa Cruz)4 ℃孵育過夜,以抗β-actin(Santa Cruz)作為對照。在室溫下,用與HRP偶聯的二抗在TBST中處理1 h。最后使用電化學發光成像分析系統顯影,用ImageLab 6.0.0軟件分析各目的蛋白條帶的灰度值。以目的蛋白條帶與內參照β-actin蛋白條帶灰度值之比表示目的蛋白的相對表達水平。

2 結 果
2.1 大鼠腦出血模型建立 10%水合氯醛麻醉后,雙次注射自體血建立腦出血模型(15 μL)進入大腦實質(基底神經節)[16]。腦出血組大鼠造模后神經功能缺損評分明顯增加,且癥狀在48 h最明顯。詳見圖1、圖2。
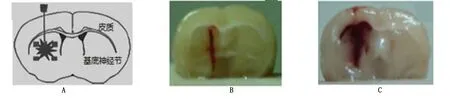
圖1 大鼠腦出血模型建立圖示(A為造模時Ⅶ型膠原酶的注射位置;B為假手術組造模后冠狀切面;C為腦出血組造模后冠狀切面)
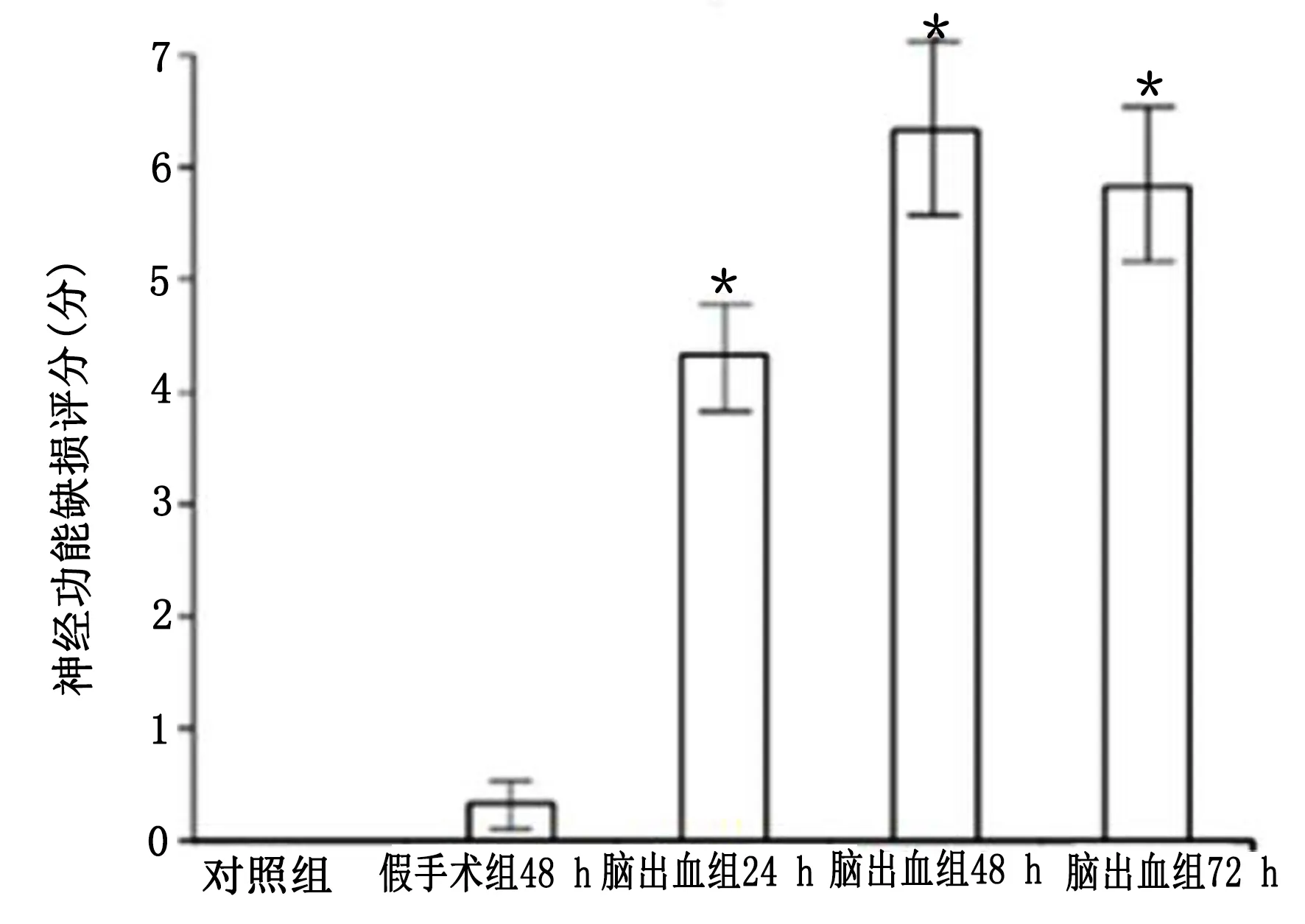
與假手術組比較,* P<0.05。圖2 各組大鼠神經功能缺損評分比較
2.2 生大黃干預對大鼠神經功能缺損評分的影響 術后6 h、24 h、48 h、72 h、7 d采用Garcia評分量表檢查神經功能缺損情況。腦出血大鼠神經功能缺損明顯增加,術后48 h神經功能嚴重程度評分最低,提示腦出血大鼠模型誘導成功。生大黃預處理顯著降低了腦出血大鼠的神經功能缺損,且呈劑量依賴性,表明了生大黃對腦出血大鼠有神經保護作用。由于神經系統嚴重程度評分最高的是800 mg/kg,因此,本研究隨后選擇該劑量進行實驗。詳見圖3。
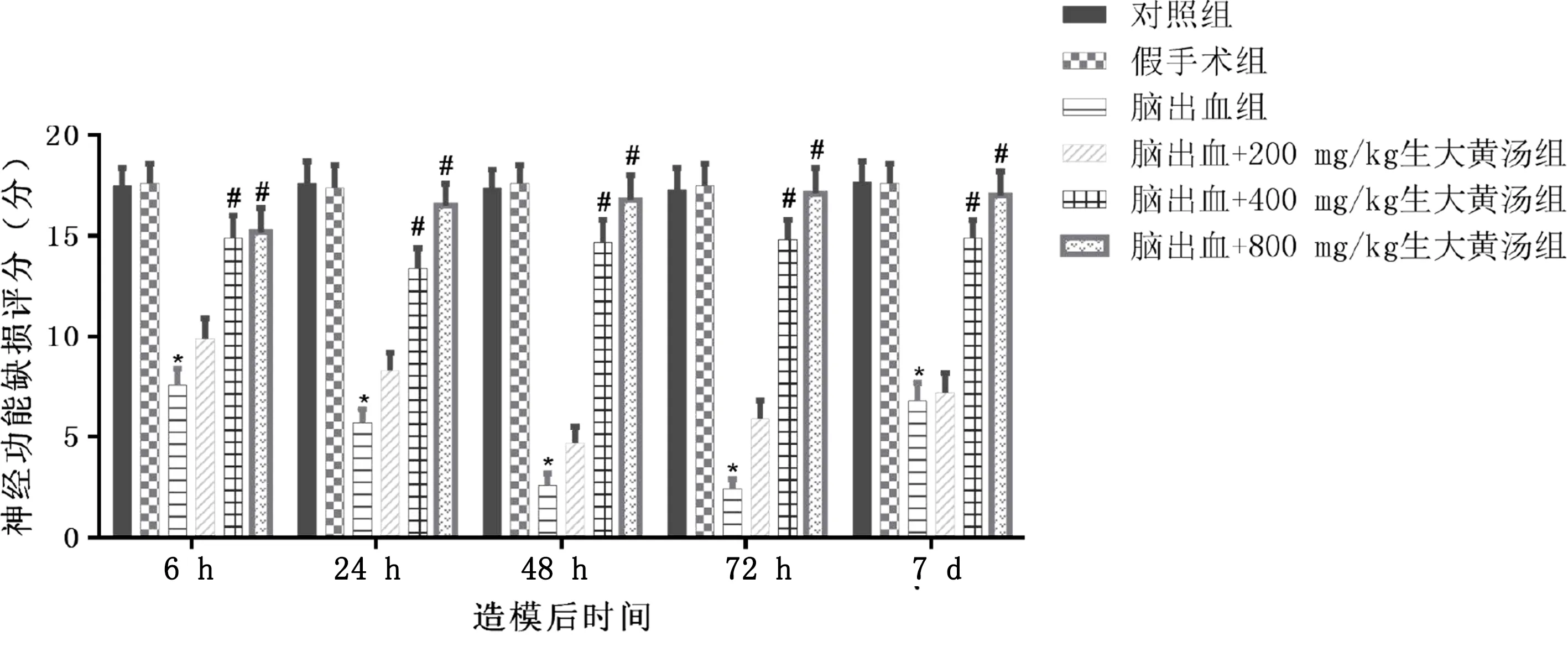
與假手術組比較,* P<0.05;與腦出血組比較,# P<0.05。圖3 各組大鼠造模后不同時間點神經功能缺損評分比較
2.3 生大黃及WORT干預對Akt表達水平的影響 為探究生大黃改善腦出血后神經功能受損的具體機制,用PI3K抑制劑WORT進行處理。與假手術組大鼠相比,腦出血模型大鼠Akt表達水平降低,生大黃預處理可明顯升高腦出血大鼠Akt表達水平,且差異有統計學意義。相反,與腦出血組相比,WORT處理(腦出血+WORT)降低Akt的表達水平。此外,生大黃湯+WORT處理可以降低生大黃誘導的腦出血大鼠Akt表達水平。詳見圖4。

與假手術組比較,* P<0.05;與腦出血組比較,# P<0.05;與腦出血+800 mg/kg生大黃湯組比較,△ P<0.05。圖4 生大黃及WORT干預對Akt水平的影響(A為免疫印跡圖;B為Akt相對表達量)
2.4 WORT及生大黃對腦出血大鼠神經功能的影響 生大黃預處理降低了腦出血大鼠神經功能缺損。與腦出血組相比,腦出血+WORT增加了神經功能障礙,雖然生大黃發揮神經保護作用,且作用呈劑量依賴性,WORT處理(腦出血+生大黃+WORT)減弱了這種保護作用,與腦出血+WORT組相比,神經系統缺損評分升高。詳見圖5。
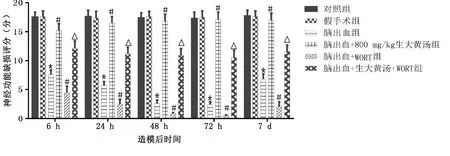
與假手術組比較,* P<0.05;與腦出血組比較,# P<0.05;與腦出血+800 mg/kg生大黃湯組比較,△ P<0.05。 圖5 WORT及生大黃干預對大鼠神經功能缺損評分的影響
2.5 WORT逆轉生大黃對腦出血大鼠腦水腫和血腫體積的影響 對大鼠腦半球含水量及血腫程度進行評定,探討生大黃對腦出血所致腦水腫和血腫體積的影響。與假手術組相比,腦出血組大鼠腦含水量明顯增加,腦出血大鼠腦含水量的增加可能反映出產前發育異常或羊水減少。但是,與腦出血組相比,在誘導腦出血之前應用生大黃明顯降低了腦含水量,WORT逆轉了生大黃對于腦水腫的影響,與生大黃組相比,WORT組腦水腫程度增加。詳見圖6。腦出血組的血腫體積增加,在誘導腦出血之前給予生大黃預處理減少了大鼠腦血腫體積,但是這一作用被WORT逆轉。詳見圖7。
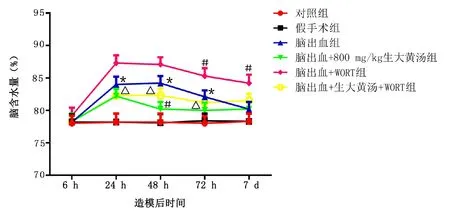
與假手術組造模后同時間比較,* P<0.05;與腦出血組比較,# P<0.05;與腦出血+800 mg/kg生大黃湯組比較,△ P<0.05。圖6 WORT逆轉生大黃對腦出血大鼠腦水腫的影響

與假手術組比較,* P<0.05;與腦出血組比較,# P<0.05。圖7 WORT逆轉生大黃對腦出血大鼠腦血腫體積的影響
3 討 論
2016年,許梅等[7]發現生地大黃湯對腦出血大鼠有神經保護作用[8],可以降低神經功能缺損、改善腦水腫以及增加神經細胞功能活性。2017年又發現HMGB1 /TLR4 /MMP-9信號通路參與生地大黃湯對腦出血大鼠神經損傷的保護作用,活化的巨噬細胞和單核細胞分泌HMGB1作為炎癥的細胞因子介質,TLR4的激活導致了細胞內信號通路核轉錄因子-κB(NF-κB)和炎性細胞因子的產生,這與體內先天免疫系統的激活有關[17-18]。
PI3K/Akt信號通路在腦發育中起著重要作用。研究發現它是許多大腦過度生長障礙的原因,然而,PI3K/Akt信號通路不僅在病理狀態下起作用,正常狀態下也起到保護大腦發育的作用。顱內體積也與Akt3內含子變異有關[19]。因此,本研究觀察生大黃是否通過PI3K/Akt信號通路發揮神經保護的作用。
本研究發現生大黃預處理可以明顯減少腦出血大鼠的神經損傷,生大黃不僅改善神經損傷,也能改善腦出血大鼠的腦水腫和減小血腫體積。這些作用都能被PI3K的抑制劑WORT阻斷,說明PI3K/Akt通路參與生大黃對腦出血大鼠的神經保護作用。缺血預處理通過誘導缺血耐受來保護大腦,缺血耐受是由一種亞致死的缺血損傷伴隨PI3K/Akt通路激活引起的[20]。PI3K/Akt信號通路是細胞生存、代謝和生長相關轉導通路的樞紐[21]。在本研究中,WORT降低了生大黃導致的Akt表達增多。Akt在Ser-196位點磷酸化Caspase-9,在體外阻斷細胞色素C介導的Caspase- 9活化[22]。Akt也可能通過叉頭框轉錄因子抑制bax依賴的凋亡通路,從而抑制細胞凋亡[23]。
生大黃在實驗性腦缺血大鼠模型中通過PI3K/Akt通路發揮神經保護作用,p-Akt基因可能被認為是腦出血干擾的一個重要因素,但是p-Akt是如何被生大黃誘導的以及是如發揮作用的,還有待進一步研究。

