尾靜脈注射AMPKα 1高表達腺病毒對抑郁癥模型大鼠線粒體損傷和代謝的調節作用①
閆海清 張 平 王桂華 王昊亮 郭振方 宋景貴
(新鄉醫學院第一附屬醫院,衛輝 453100)
抑郁癥是一種以顯著而持久的情緒低落、快感缺失和行為遲緩為主要臨床特征的精神性疾病。目前,全球抑郁癥發病率約為10%,且逐年升高,并可能上升為世界第二大疾病,自殺身亡率約為15%,嚴重威脅患者身心健康和社會團結穩定[1-2]。慢性不可預見性溫和刺激動物抑郁癥與人類抑郁癥病因相似,是一種廣泛使用和經過充分驗證、并得到國際認可的抑郁癥動物造模方法[3]。研究表明,氧化應激是抑郁癥神經細胞凋亡、神經退行性改變、神經元可塑性改變的重要原因,氧化應激損害在抑郁癥發病過程中起關鍵作用[4]。抑郁癥患者糖代謝異常發生率高達36%,已有研究證明抑郁癥與糖代謝異常存在共同的神經內分泌基礎,兩者互為誘因[5-6]。抑郁癥模型中腺苷酸活化蛋白激酶α1(AMP activated protein kinaseα1,AMPKα1)表達明顯下調,但AMPKα1高表達對抑郁癥的作用及機制尚不清楚[7]。AMPKα1是細胞能量代謝的主要感受器,在維持機體能量代謝平衡中發揮重要作用,已有研究表明其與炎癥反應、糖類代謝、脂肪分解和細胞凋亡等生命活動相關[8]。本文研究尾靜脈注射AMPKα1高表達腺病毒對抑郁癥模型大鼠線粒體損傷和代謝的調節作用,以期為抑郁癥的預防和治療提供參考。
1 材料與方法
1.1材料
1.1.1實驗動物 60只Wistar封閉群大鼠購自成都達碩實驗動物有限公司。
1.1.2試劑 AMPKα1高表達腺病毒購自上海生工;SOD、MDA和LDH試劑盒購自上海酶聯生物;BCA試劑盒購自北京天根生化有限公司。
1.2方法
1.2.1分組、造模及處理 Wistar封閉群大鼠隨機分為4組:健康對照組(Control)、模型組(CUMS)、空載體組(CUMS+Ad-NC)和AMPKα1高表達組(CUMS+Ad-AMPKα1),每組15只。除Control組外,其他各組大鼠均采用不可預見溫和應激法建立抑郁癥模型:隨機禁食或禁水 24 h、4℃冷水游泳、晝夜顛倒24 h、夾尾1 min、50 V電擊3 min、潮濕墊料 24 h、噪音 2 h,每天隨機安排1~2種刺激,同一刺激不可連續出現,孤籠飼養28 d。CUMS+Ad-NC組尾靜脈注射腺病毒空載體,CUMS+Ad-AMPKα1組尾靜脈注射AMPKα1高表達腺病毒[9-10]。
1.2.2RT-PCR檢測mRNA表達 RT-PCR提取總RNA,反轉錄為cDNA,以β-actin為內參,反應條件為:95℃預變性2 min,95℃變性15 s,64℃退火 30 s,72℃延伸30 s,共40個循環。PGC-1α F:5′-TGCCACCATCAAAGAAGC-3′; PGC-1α R:5′-TCACCAAACAGAAGCAGACT-3′; GLUT4 F:5′-CCCACAGAAGGTGATTGAACAG-3′;GLUT4 R:5′-GATGGCCAGTTGGTTGAGTG-3′。
1.2.3Western blot檢測蛋白表達 取組織加入RIPA裂解提取蛋白,BCA試劑盒測定蛋白含量;取30 μl 蛋白電泳分離,轉至PVDF膜,脫脂奶粉封閉1 h ;加入對應一抗,4℃孵育過夜;加入二抗孵育4 h,TBST液清洗;ECL顯影,以β-actin為內參計算蛋白相對表達。
1.2.4Morris水迷宮實驗檢測大鼠學習記憶能力 造模第22天將大鼠面向池壁放入水中,記錄動物找到水下平臺的時間,即為逃避潛伏期時間。若超過 1 min 則引導大鼠找到平臺。讓大鼠在平臺上停留10 s,早晚各1次,持續6 d。在應激造模第28天撤去平臺,將大鼠面向池壁放入水中,記錄大鼠60 s 內在原平臺所在象限停留時間,即為目標象限記憶時間[11]。
1.2.5曠場實驗檢測大鼠自主探究行為 將大鼠放入底部有25個4 cm×4 cm的黑色曠場反應箱,讓其自由活動1 min 后,記錄大鼠4 min內的水平活動次數和垂直站立次數。
1.2.6HE染色檢測大鼠腦損傷情況 將組織用甲醛固定、石蠟包埋后切片;HE染色后脫水,中性樹膠封片,光學顯微鏡下觀察。
1.2.7氧化應激檢測 將組織加入生理鹽水勻漿離心后,按SOD、MDA和 LDH試劑盒說明書分別測定SOD、MDA、和LDH含量。
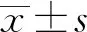
2 結果
2.1AMPKα1高表達腺病毒促進抑郁癥模型大鼠AMPKα1表達 與Control組相比,CUMS組大鼠AMPKα1 mRNA及蛋白表達顯著下調,說明抑郁癥抑制大鼠AMPKα1呈低表達;與CUMS組相比,CUMS+Ad-NC組AMPKα1 mRNA、蛋白表達變化無統計學意義,說明空載體不影響抑郁癥大鼠AMPKα1表達;與CUMS+Ad-NC組相比,CUMS+Ad-AMPKα1組大鼠AMPKα1 mRNA、蛋白表達顯著上調,說明AMPKα1高表達腺病毒可促進抑郁癥大鼠AMPKα1表達(P<0.01,圖1A)。
2.2AMPKα1高表達腺病毒改善抑郁癥大鼠學習記憶能力 與Control組相比,CUMS組大鼠逃避潛伏期時間顯著延長,目標象限記憶時間顯著縮短,說明抑郁癥抑制大鼠記憶力嚴重受損;與CUMS組相比,CUMS+Ad-NC組大鼠逃避潛伏期時間和目標象限記憶時間變化無統計學意義,說明空載體對抑郁癥大鼠記憶力無影響;與CUMS+Ad-NC組相比,CUMS+Ad-AMPKα1組大鼠逃避潛伏期時間顯著縮短,目標象限記憶時間顯著增加,說明AMPKα1高表達腺病毒可改善抑郁癥大鼠的學習記憶能力(P<0.01,圖1B)。
2.3AMPKα1高表達腺病毒促進抑郁癥大鼠自主探究行為 與Control組相比,CUMS組大鼠水平活動次數和垂直站立次數顯著減少,說明抑郁癥可抑制大鼠自主探究行為;與CUMS組相比,CUMS+Ad-NC組大鼠水平活動次數和垂直站立次數差異無統計學意義,說明空載體對抑郁癥大鼠自主探究行為無影響;與CUMS+Ad-NC組相比,CUMS+Ad-AMPKα1組大鼠水平活動次數和垂直站立次數顯著增加,說明AMPKα1高表達腺病毒能可促進抑郁癥大鼠的自主探究行為(P<0.01,圖1C)。
2.4AMPKα1高表達腺病毒減輕抑郁癥大鼠腦損傷 Control組大鼠大腦海馬和前額葉皮質神經元形態規則,結構完整,細胞間隙正常,排列整齊有序;CUMS組大鼠細胞排列散亂,神經元缺失明顯,胞核染色較深,部分胞體呈空泡狀;CUMS+Ad-NC組與CUMS組組織形態相似;CUMS+Ad-AMPKα1組神經元結構基本正常,細胞間隙縮小,損傷情況得到明顯緩解(圖2)。
2.5AMPKα1高表達腺病毒減輕抑郁癥大鼠細胞線粒體損傷 與Control組相比,CUMS組大鼠Bcl-2蛋白表達顯著下調,Bax、Caspase-3和Caspase-9蛋白表達顯著上調,說明抑郁癥大鼠線粒體明顯損傷;與CUMS組相比,CUMS+Ad-NC組大鼠Bcl-2、Bax、Caspase-3和Caspase-9蛋白表達變化無統計學意義,說明空載體不影響抑郁癥大鼠線粒體損傷;與CUMS+Ad-NC組相比,CUMS+Ad-AMPKα1組大鼠Bcl-2蛋白表達顯著上調,Bax、Caspase-3和Caspase-9蛋白表達顯著下調,說明AMPKα1高表達腺病毒減輕抑郁癥大鼠線粒體損傷(P<0.01,圖3)。

圖1 抑郁癥大鼠AMPKα1表達、記憶力和自主探究行為Fig.1 AMPKα1 expression,memory and self-exploration behavior in rats with depressionNote:Compared with control group,**.P<0.01;compared with CUMS+Ad-NC group,##.P<0.01.
2.6AMPKα1高表達腺病毒抑制抑郁癥大鼠細胞氧化應激 如圖4所示, 與Control組相比, CUMS組SOD含量顯著下降,LDH和MDA含量顯著上升,說明抑郁癥引起大鼠氧化應激;與CUMS組相比,CUMS+Ad-NC組大鼠LDH、SOD和MDA含量變化無統計學意義,說明空載體不影響抑郁癥大鼠氧化應激;與CUMS+Ad-NC組相比,CUMS+Ad-AMPKα1組大鼠SOD含量顯著增多,LDH和MDA含量顯著減少,說明AMPKα1高表達腺病毒可減輕抑郁癥大鼠氧化應激(P<0.01)。

圖2 大鼠海馬區HE染色(×200)Fig.2 HE staining of rats hippocampus(×200)

圖3 線粒體損傷程度Fig.3 Degree of mitochondrial damageNote:Compared with control group,**.P<0.01;compared with CUMS+Ad-NC group,##.P<0.01.

圖4 試劑盒檢測LDH、SOD和MDA含量Fig.4 LDH,SOD and MDA contents were detected by kitNote:Compared with control group,**.P<0.01;compared with CUMS+Ad-NC group,##.P<0.01.

圖5 各組大鼠的糖代謝檢測Fig.5 Glucose metabolism in rats of each groupNote:Compared with control group,**.P<0.01;compared with CUMS+Ad-NC group,##.P<0.01.
2.7AMPKα1高表達腺病毒增強抑郁癥大鼠細胞糖代謝 與Control組相比,CUMS組大鼠PGC-1α和GLUT4 mRNA、蛋白表達顯著下調,說明抑郁癥抑制大鼠糖代謝;與CUMS組相比,CUMS+Ad-NC組大鼠PGC-1α和GLUT4 mRNA、表達變化無統計學意義,說明空載體不影響抑郁癥大鼠糖代謝;與CUMS+Ad-NC組相比,CUMS+Ad-AMPKα1組大鼠PGC-1α和GLUT4 mRNA、蛋白表達顯著上調,說明AMPKα1高表達腺病毒可增強抑郁癥大鼠糖代謝(P<0.01,圖5)。
3 討論
抑郁癥具有高患病率、高致殘率和高自殺率等特點,是由社會環境、自身遺傳、個體性格、生物化學等多種因素共同作用而產生的情緒低落、快感缺失、行為遲緩、學習記憶下降的精神疾病。因此,記憶能力和行為是抑郁癥評價的重要指標之一。本研究通過Morris水迷宮實驗和曠場實驗發現,AMPKα1高表達腺病毒可顯著減少抑郁癥大鼠逃避潛伏期時間,顯著增加抑郁癥大鼠目標象限記憶時間、水平活動次數和垂直站立次數,說明AMPKα1高表達腺病毒可改善抑郁癥大鼠學習記憶能力,并促進抑郁癥大鼠自主探究行為。
海馬和前額葉是大腦執行情緒和認知的關鍵區域,海馬主要負責生物體的學習和記憶,前額葉皮質主要負責感覺認知、情緒調節和功能執行[12]。SHIRAYAMA等[13]研究發現海馬和前額葉與抑郁癥的發生密切相關,且重度抑郁癥患者的海馬和前額葉皮質區較健康志愿者體積明顯減小。本文通過海馬和前額葉皮質HE染色發現,AMPKα1高表達腺病毒可緩解抑郁癥細胞排列散亂,神經元缺失和胞體空泡狀等現象,從而緩解腦損傷。
線粒體是細胞有氧呼吸的主要場所,其產生的能量在維持細胞正常功能中發揮重要作用,一旦線粒體受損,則會干擾細胞的正常功能[14]。CZARNY等[15]研究發現,抑郁癥會導致氧化應激和低效DNA損傷修復,進而導致線粒體功能障礙;GONG等[16]研究發現慢性輕度壓力抑制小鼠海馬、皮質和下丘腦中線粒體呼吸,并導致腦中線粒體超微結構受損,提示抑郁癥可誘導線粒體受損。XU等[17]通過研究發現,小鼠胚胎成纖維細胞中AMPKα1缺陷可促進細胞增殖和線粒體損傷。因此,AMPKα1過表達有望減緩抑郁癥引起的線粒體損傷。本研究發現AMPKα1高表達腺病毒可顯著上調抑郁癥大鼠Bcl-2蛋白表達,并顯著下調抑郁癥大鼠Bax、Caspase-3和Caspase-9蛋白表達,說明AMPKα1過表達腺病毒可減緩抑郁癥引起的線粒體損傷。
氧化應激是自由基在體內失衡而產生的一種負面作用。VAVAKOVA等[18]研究發現氧化應激通過自由基、非自由基分子和活性氧等在重度抑郁癥的病理生理學中起重要作用;MAURYA等[19]發現包括重度抑郁癥在內的神經變性/神經精神病癥的發病機理中起重要作用,因此,氧化應激在抑郁癥發生中起關鍵作用。COLOMBO等[20]研究發現在人臍靜脈內皮細胞中AMPKα1可調節其氧化應激能力。AMPKα1高表達有望調節抑郁癥患者的氧化應激能力。本研究發現AMPKα1高表達上調抑郁癥大鼠SOD含量,并下調抑郁癥大鼠LDH和MDA含量,說明AMPKα1高表達腺病毒減輕抑郁癥大鼠氧化應激。
生物體的精神狀態和糖代謝水平密切相關[21]。夏青春等[22]研究發現抑郁癥患者的空腹血糖和餐后2 h內血糖水平均顯著高于健康對照組,且葡萄糖耐量異常發生率高于對照組。因此,抑郁癥患者存在糖代謝異常。BODE等[2]研究發現AMPKα1過表達可顯著降低糖尿病患者血糖濃度,AMPKα1過表達有望改善抑郁癥大鼠細胞糖代謝異常。本研究發現AMPKα1高表達可上調PGC-1α和GLUT4表達,說明AMPKα1高表達腺病毒可改善抑郁癥大鼠糖代謝。
綜上所述,尾靜脈注射AMPKα1高表達腺病毒可改善抑郁癥模型大鼠學習記憶能力,促進自主探究行為,緩解腦損傷及線粒體損傷,減輕氧化應激,并改善糖代謝,從而緩解抑郁癥,為抑郁癥治療提供新的治療方案。

