PI3K/Akt信號通路對臍血間充質干細胞減輕缺血性腦損傷和炎癥反應的調節作用
陳 慧 鄭曉梅 夏 曉 孫玉錦 徐 靜
(西南醫科大學附屬醫院神經內科,瀘州 646000)
腦血管疾病的致死率與致殘率在所有疾病中位居第二,且發病率逐年上升,有可能成為導致死亡的首要疾病,其致死率與致殘率在我國位居第一[1-3]。在所有腦血管疾病中,缺血性腦卒中的發病率位居第一,具有起病急、難預測、致死率與致殘率高的特點,缺血性腦卒中的預防與治療一直是臨床研究重點。目前FDA批準的缺血性腦卒中治療方式為靜脈注射重組組織纖溶酶原激活物,但多數患者并未獲益[4-5]。除短期的溶栓治療窗外,目前仍無證據表明該干預可有效促進神經元功能恢復。
干細胞療法是治療腦卒中的潛在策略,相關研究已證明干細胞移植治療可改善缺血性腦卒中患者的療效,但目前對干細胞移植修復缺血性腦卒中的作用機制仍不明確[6-7]。臍血間充質干細胞(umbilical cord blood-derived mesenchymal stem cells,UCBMSCs)具有獲取無痛、免疫耐受高、無倫理爭議等特點,成為細胞移植治療的較好選擇。研究證明PI3K/Akt信號通路與缺血性腦卒中關系密切,但UCBMSCs對缺血性腦卒中的神經保護作用是否與該通路相關尚未明確。本研究觀察人UCBMSCs對大鼠缺血性腦損傷的保護作用,分析UCBMSCs對缺血性腦損傷患者PI3K/Akt信號通路的影響,探討其可能的作用機制。
1 材料與方法
1.1材料
1.1.1臍血 由我院婦產科提供,來自健康足月嬰兒,孕產婦血常規與感染免疫9項檢查均正常,產婦及其家屬知情同意。無菌條件下共采集臍血10份,每份80 ml,加入25 U/ml肝素抗凝。
1.1.2實驗動物 成年雄性SD大鼠70只,體重(260±25)g,飼養于25℃、光12 h/暗12 h環境中,自由飲食。
1.1.3主要試劑與儀器 Akt1/2/3抗體抑制劑GSK2141795(EYK-CAS0019337,廈門研科生物技術有限公司);DMEM-LG培養液(129075-73-6,上海鼓臣生物技術有限公司);胎牛血清(深圳市浩克生物技術有限公司);流式細胞儀(BriCyte E6,深圳邁瑞生物醫療電子股份有限公司);CD105-APC抗體(MHCD10505)、CD90-APC抗體(A15726)和CD30-APC抗體(A15715,Invitrogen);AKT1/2/3抗體(AP20658c,百奇生物科技(蘇州)有限公司);Western blot檢測試劑盒(xyW001,上海信裕生物科技有限公司);ELISA檢測試劑盒(YOYOBIO,上海研謹生物科技有限公司);Bcl-2抗體(ab692)、Bax抗體(ab32503,Abcam);TUNEL細胞凋亡原位檢測試劑盒(SNM537-OSJ,北京百奧萊博科技有限公司) 。
1.2方法
1.2.1UCBMSCs提取、培養 取新生兒臍血,以1∶1.5比例加入D-Hank′s 緩沖液稀釋,移液器吹打均勻;25℃下2 000 r/min離心15 min,吸取界面細胞層;D-Hank′s 緩沖液清洗1次,25℃下1 500 r/min離心8 min,棄上清,取細胞沉淀,加入含5%胎牛血清、2 mol/L L-谷氨酰胺與100 U/ml青-鏈霉素的DMEM-LG培養液重懸細胞,調整細胞濃度為4×107個/ml,置于37℃、5%CO2培養,根據細胞生長情況更換培養液,去除未貼壁細胞。細胞生長至80%融合時按1∶2 比例進行傳代培養,每4 d半量換液1次,顯微鏡觀察細胞生長形態。將第3代UCBMSCs以鼠抗人細胞系特異性抗體MAB1281標記,進行移植實驗[8]。
1.2.2UCBMSCs鑒定 取第3代UCBMSCs,胰酶消化,以PBS調整細胞濃度為1×106個/ml,流式細胞術檢測CD105、CD90和CD30表面標記物表達,誘導UCBMSCs向成骨細胞與脂肪細胞分化[9]。
1.2.3構建腦損傷模型 取SD大鼠稱體重,腹腔注射3.6%水合氯醛10 ml/kg麻醉,固定于手術臺,常規消毒、鋪巾,在頸部正中皮膚做4 cm左右切口,假手術組分離右側頸總、頸內與頸外后直接縫合切口;腦損傷組制作大腦中動脈缺血模型,于右側頸總動脈基底部結扎血管,并用動脈瘤夾夾閉右側頸總動脈,在右側頸內動脈根部剪1個斜形小口,向內緩緩插入線栓,當插入線栓到達預定深度時打開動脈瘤夾,繼續插入出現阻滯感時迅速結扎頸內動脈,45 min 后拔除線栓,逐層關閉切口、縫合皮膚。以Z-Longa神經功能評分1~3分為造模成功[10]。
1.2.4人UCBMSCs的腦保護作用檢測 將30只大鼠隨機分為假手術組、腦損傷組、UCBMSCs組,每組10只。缺血性腦損傷造模成功后24 h,腦損傷組于左側股靜脈注射1 ml生理鹽水,UCBMSCs組左側股靜脈注射等體積UCBMSCs生理鹽水溶液,細胞濃度為3×106個/ml。術后1、3、7、14 d采用改良神經功能缺損評分評估大鼠神經功能恢復情況,包括評估運動能力、感覺能力、平衡能力與異常活動能力,總分18分,評分越高說明神經功能缺損越嚴重。術后1、3、7、14 d尾靜脈取血1 ml、8℃、1 000 r/min離心15 min,取上清,ELISA檢測試劑盒檢測IL-6、TGF-β水平。
1.2.5尼氏染色 術后14 d斷頭取腦海馬組織,40 g/L多聚甲醛固定24 h,制備石蠟切片(25 μm),脫蠟入水,甲基紫染色15 min,蒸餾水沖洗3次,梯度乙醇脫水,Nissl Differentiation染色液分化8 s,乙醇脫水,二甲苯透明,中性樹脂封固,顯微鏡下觀察。
1.2.6免疫熒光染色 術后14 d取UCBMSCs組海馬組織,制作冰凍切片,加入抗MAB1281抗體(1∶125)與NeuN抗體(1∶50)混合抗體,4℃孵育24 h 后加入FITC標記的羊抗兔IgG(1∶100)與PE標記的羊抗鼠IgG(1∶100)混合抗體孵育,DAPI復染,甘油封固后熒光顯微鏡下觀察。
1.2.7UCBMSCs對PI3K/Akt信號通路的影響 將40只大鼠隨機分為假手術組、腦損傷組、UCBMSCs組與抑制劑組,每組10只。缺血性腦損傷造模成功后24 h,模型組于左側股靜脈注射1 ml生理鹽水,UCBMSCs組左側股靜脈注射等體積UCBMSCs生理鹽水,細胞濃度為3×106個/ml;抑制劑組左側股靜脈注射0.1 ml Akt1/2/3抗體抑制劑GSK2141795與1 ml UCBMSCs生理鹽水,細胞濃度為3×106個/ml。術后14 d處死大鼠。
1.2.8Tunel法檢測細胞凋亡 取大鼠部分腦組織制作2 mm切片,取切片缺血區腦組織10%甲醛固定,制作石蠟切片,常規脫蠟,滴加4%H2O2后25℃保存10 min,蒸餾水沖洗3次,加入蛋白酶36℃消化15 min,PBS清洗,36℃下加標記緩沖液120 min,封閉液封閉、稀釋,DAB顯色,蒸餾水沖洗,脫水、透明、封固,鏡下觀察。
1.2.9Western blot檢測相關蛋白表達 取大鼠腦海馬組織50 mg提取總蛋白,Western blot檢測Bax、Bcl-2凋亡蛋白、IL-6、TGF-β1炎癥因子蛋白、Akt、p-Akt蛋白表達,嚴格按照試劑盒說明書操作。BCA法檢測蛋白濃度,行10%SDS-PAGE 凝膠電泳,加樣量為50 μg,轉膜,加入稀釋的一抗4℃孵育24 h,加入二抗室溫孵育1 h,DAB顯色,曝光、顯影。
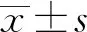
2 結果
2.1UCBMSCs鑒定 接種72 h后出現細胞貼壁,細胞形態多呈梭形,接種7 d后可見逐漸增多的梭形細胞(圖1A、B);第3代UCBMSCs呈典型的旋渦狀排列,單個細胞呈紡錘形(圖1C),其高表達CD105、CD90表面標記物,低表達CD30表面標記物(圖2)。油紅O染色顯示UCBMSCs可分化為脂肪細胞(圖3A),可見大小不等的紅色脂滴,茜素紅染色顯示UCBMSCs可分化為成骨細胞(圖3B),可見大小不規則的紅色礦化結節。
2.2UCBMSCs促進神經功能恢復 假手術組大鼠神經功能正常,不同時段的神經功能缺損評分為0分。UCBMSCs組與損傷組術后1 d的神經功能缺損評分差異無統計學意義,UCBMSCs組術后3、7、14 d的神經功能缺損評分明顯低于損傷組(P<0.05),見表1。

圖1 UCBMSCs的細胞形態特征(×100)Fig.1 Morphological characteristics of UCBMSCs(×100)
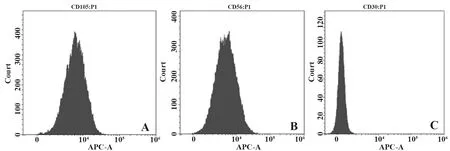
圖2 第3代UCBMSCs的表面標記物表達Fig.2 Expression of surface markers in generation 3 UC-BMSCs
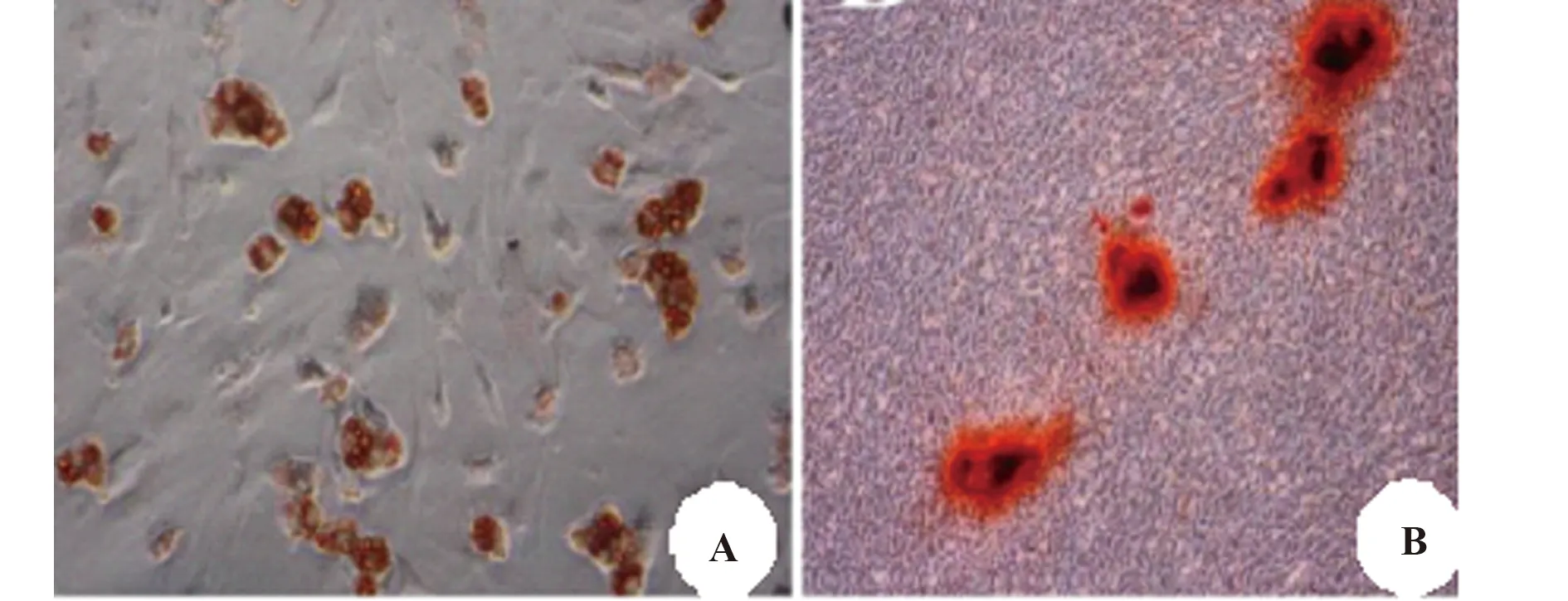
圖3 UCBMSCs的成脂與成骨誘導分化(×100)Fig.3 Adipogenic and osteogenic differentiation of UCB-MSCs(×100)
表1 各組大鼠術后不同時段神經功能缺損評分
2.3UCBMSCs改善炎癥因子分泌 術后1、3、7、14 d,損傷組IL-6水平均高于假手術組(P<0.05),TGF-β1水平低于假手術組(P<0.05);術后3、7、14 d, UCBMSCs組IL-6水平低于損傷組(P<0.05),TGF-β1水平高于損傷組(P<0.05),見表2。
2.4UCBMSCs的神經保護作用 假手術組海馬區錐體細胞排列規則緊密,細胞結構完整,胞漿內可見豐富的尼氏小體;損傷組海馬區錐體細胞缺失,排列混亂,細胞輪廓不清晰,胞漿內尼氏小體縮小;與損傷組相比,UCBMSCs組海馬區椎體細胞明顯增加,排列規則有序,細胞輪廓較清晰,胞漿內尼氏小體變大,見圖4。
2.5移植UCBMSCs的存活與分化 術后14 d,在大鼠腦海馬組織內可見MAB1281標記的陽性細胞,同時也可見NeuN標記的陽性細胞,兩者有重疊,說明移植的UCBMSCs在海馬區存活,并部分分化為神經樣細胞,見圖5。DAPI 染色的為腦組織內的神經元細胞,MAB1281標記的為移植的UCBMSCs,NeuN標記的陽性細胞為移植干細胞分化的神經元樣細胞。
2.6UCBMSCs調節p-Akt蛋白表達 4組Akt蛋白表達差異無統計學意義。損傷組p-Akt蛋白表達高于假手術組(P<0.05),UCBMSCs組、抑制劑組p-Akt蛋白表達高于損傷組(P<0.05),UCBMSCs組p-Akt蛋白表達高于抑制劑組(P<0.05),見圖6。
2.7UCBMSCs通過PI3K/Akt信號通路抑制神經元細胞凋亡 Tunel染色可見假手術組僅有少量凋亡神經元細胞,凋亡率為(6.19±1.23)%;與假手術組相比,損傷組可見大量凋亡神經元細胞,凋亡率為(56.79±3.41)%;UCBMSCs組也可見較多凋亡的神經元細胞,但數量明顯少于損傷組,凋亡率為(26.38±2.17)%;抑制劑組凋亡神經元細胞數量介于損傷組與UCBMSCs組之間,細胞凋亡率為(40.13±2.97)%,4組神經元細胞凋亡率差異有統計學意義(P<0.05),見圖7。
2.8UCBMSCs通過PI3K/Akt信號通路調節凋亡蛋白、炎癥因子蛋白表達 與假手術組相比,損傷組Bax蛋白表達升高(P<0.05),Bcl-2蛋白表達下降(P<0.05);與損傷組相比,UCBMSCs組、抑制劑組Bax蛋白表達降低(P<0.05),Bcl-2蛋白表達升高(P<0.05);UCBMSCs組與抑制劑組Bax蛋白、Bcl-2蛋白表達差異有統計學意義(P<0.05)。與假手術組相比,損傷組IL-6蛋白表達升高(P<0.05),TGF-β1蛋白表達降低(P<0.05);與損傷組相比,UCBMSCs組、抑制劑組IL-6蛋白表達降低(P<0.05),TGF-β1蛋白表達升高(P<0.05);UCBMSCs組與抑制劑組IL-6蛋白、TGF-β1蛋白表達差異有統計學意義(P<0.05),見圖8。
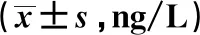
表2 各組大鼠血清炎癥因子濃度
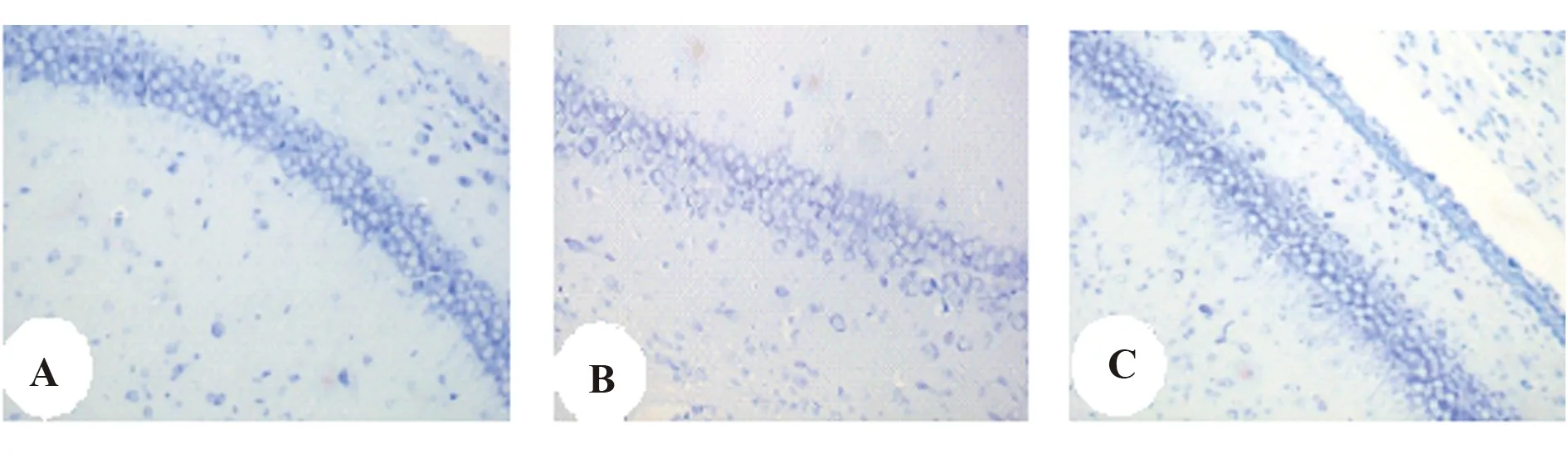
圖4 各組大鼠腦海馬區尼氏染色(×100)Fig.4 Nissl staining in hippocampus of rats in each group(×100)Note:A.Sham;B.Injury;C.UCBMSCs.
圖5 移植的UCBMSCs在大鼠腦海馬區的存活與分化Fig.5 Survival and differentiation of UCBMSCs transplanted in rat hippocampus
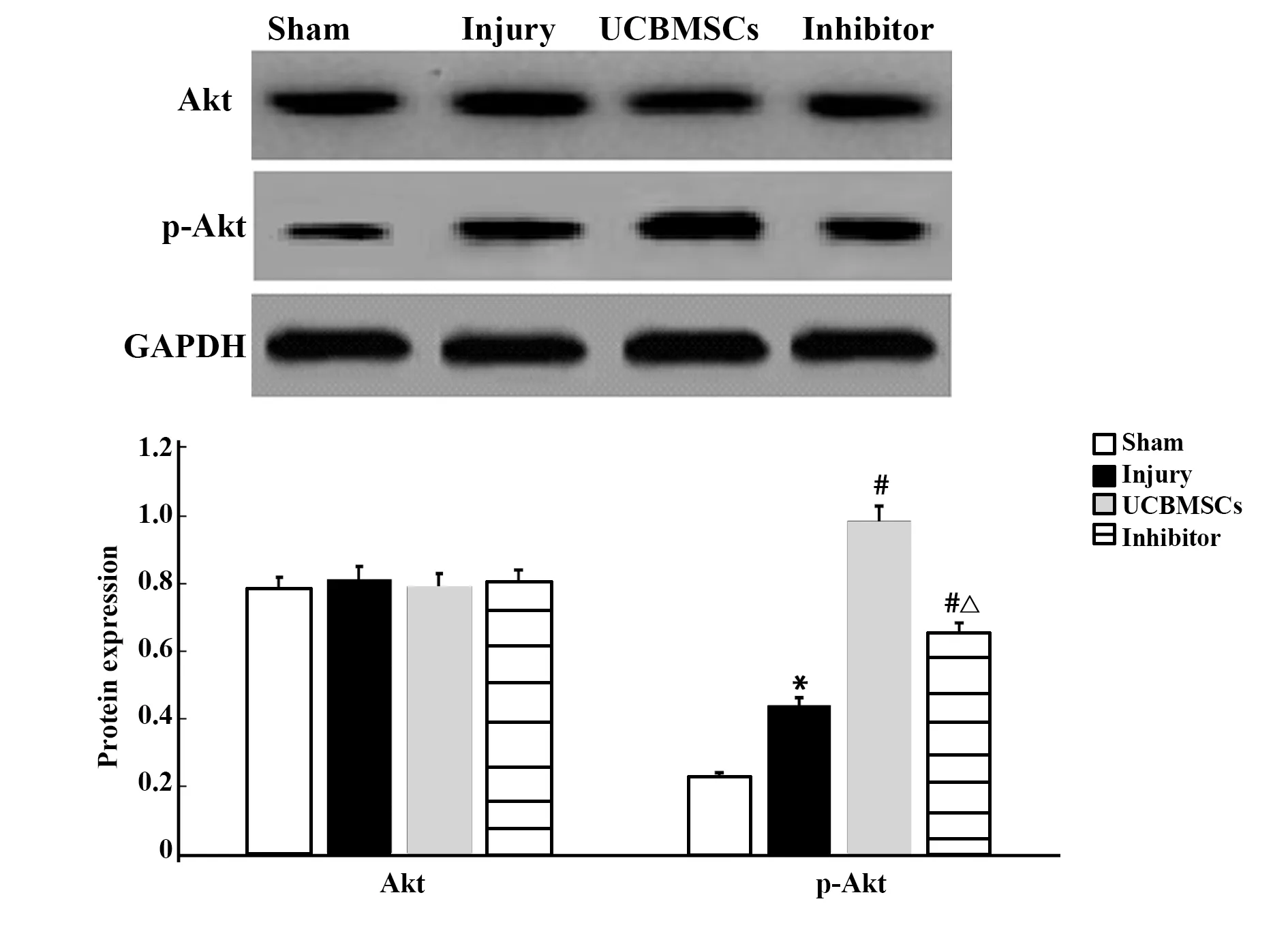
圖6 各組Akt、p-Akt蛋白表達Fig.6 Expressions of Akt and p-Akt in each groupNote:Compared with sham,*.P<0.05;compared with injury,#.P<0.05;compared with UCBMSCs,△.P<0.05.
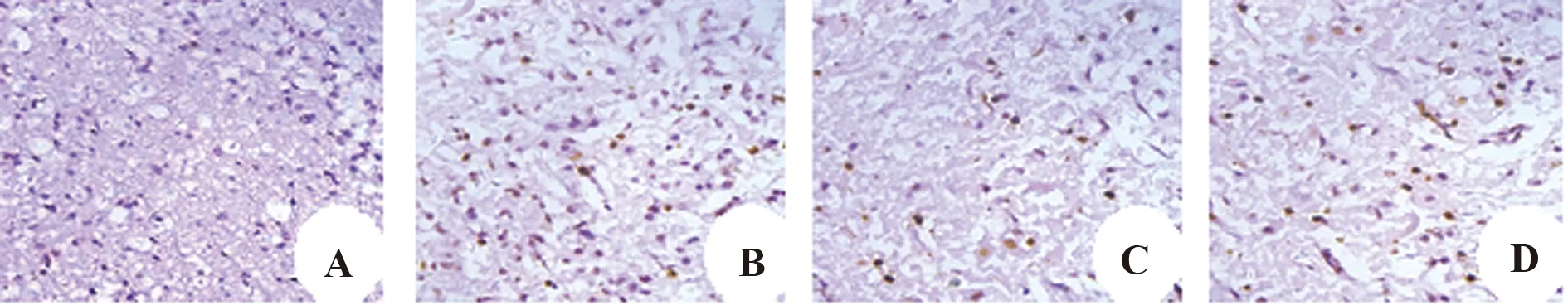
圖7 Tunel染色檢測各組細胞凋亡(×400)Fig.7 Tunel staining of apoptotic cells in each group(×400)Note:A.Sham;B.Injury;C.UCBMSCs;D.Inhibitor.
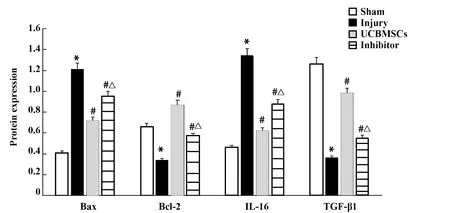
圖8 各組凋亡蛋白與炎癥因子蛋白表達Fig.8 Expressions of apoptotic protein and inflammatory factor in each groupNote:Compared with sham group,*.P<0.05;compared with injury group,#.P<0.05;compared with UCBMSCs,△.P<0.05.
3 討論
炎癥反應在缺血性腦卒中發病過程中發揮重要作用,腦組織缺血后,多種炎癥介質破壞神經血管單元,其中IL-6是腦損傷后出現最早的炎癥因子,臨床將其作為早期評估缺血性腦卒中損傷程度的重要指標[11-12]。TGF-β1參與缺血性腦卒中發展過程,可作為缺血性腦損傷預后獨立保護因子,對判斷患者預后具有一定價值。本研究選擇炎癥因子IL-6、TGF-β1進行檢測,實驗結果顯示IL-6與TGF-β1參與缺血性腦損傷發生發展,與既往研究結果一致[13]。UCBMSCs組術后3~14 d,IL-6水平明顯低于損傷組,TGF-β1水平明顯高于損傷組,神經功能損傷評分低于損傷組,說明UCBMSCs可通過降低IL-6水平、提升TGF-β1水平改善缺血性腦損傷大鼠的神經功能。課題組推測UCBMSCs可能通過以下途徑調節炎癥因子水平:腦缺血損傷后,腦組織內免疫細胞(如小膠質細胞)活化及外周血免疫細胞浸潤引發炎癥反應,而UCBMSCs分泌的因子作用于巨噬細胞,使其由M1向M2型轉化,干預免疫分泌的細胞因子圖譜,同時抑制和極化膠質細胞可發揮免疫調節與抗炎作用[14]。但UCBMSCs自身還是其分化后分泌的物質參與免疫調節,還是二者共同發揮作用還有待進一步研究。
尼氏染色顯示,損傷組大鼠海馬區錐體細胞缺失,排列混亂,細胞輪廓不清晰,胞漿內尼氏小體縮小;相比于損傷組,UCBMSCs組大鼠海馬區椎體細胞明顯增加,排列規則有序,細胞輪廓較清晰,胞漿內尼氏小體變大,說明UCBMSCs可能通過抑制細胞凋亡發揮神經保護作用。
干細胞移植主要有手術(腦內立體定向、腰椎穿刺、介入選擇性頸內動脈注射)與非手術(靜脈注射)2種途徑,各注射方式都有其優缺點,臨床中應根據患者實際情況進行選擇。本實驗選擇股靜脈注射途徑,簡單易行,無醫療條件及醫療水平限制,且不會對患者造成損傷,治療費用較低。同時,由于腦缺血后各種致腦損傷的炎癥因子被釋放與激活,嚴重破壞血腦屏障,經血管移植的干細胞較易進入腦損傷部位。本實驗免疫熒光染色顯示,經股靜脈移植的UCBMSCs可在腦組織中存活,并部分分化為神經樣細胞,但最佳移植細胞數還有待進一步研究。
PI3K/Akt信號通路是經典的抗凋亡通路,其作用途徑可分為Akt/Caspase途徑、Akt/GSK-3β途徑、Akt/叉頭途徑、Akt/Bcl-2途徑、NF-kB途徑與eNOS途徑,研究證明PI3K/Akt信號通路與缺血性腦卒中關系密切[15]。涂獻坤等[16]研究顯示大鼠腦組織缺血24 h后,缺血腦組織p-Akt蛋白表達上調,PI3K/Akt信號通路確實參與缺血性腦損傷發病。本研究假設PI3K/Akt信號通路參與UCBMSCs的神經保護作用,結果顯示缺血性腦損傷發生后,大鼠腦組織海馬神經元凋亡數上調,腦組織IL-6蛋白、Bax蛋白表達升高,而TGF-β1蛋白、Bcl-2蛋白表達降低,同時p-Akt蛋白表達上升;UCBMSCs移植后,缺血性腦損傷大鼠腦海馬神經元凋亡數減少,腦組織IL-6蛋白、Bax蛋白表達降低、TGF-β1蛋白、Bcl-2蛋白表達升高,同時p-Akt蛋白表達進一步上升,說明PI3K/Akt信號通路可能在UCBMSCs的抗炎與神經保護作用中具有重要調節作用。UCBMSCs的抗炎與神經保護作用可被Akt1/2/3抗體抑制劑削弱,進一步說明UCBMSCs通過激活PI3K/Akt信號通路發揮抗炎與神經保護作用[17]。
綜上,本研究證實PI3K/Akt信號通路在UCBMSCs減輕缺血性腦損傷和炎癥反應過程中發揮重要調節作用,但UCBMSCs的神經保護作用是否還有其他通路參與、其具體作用機制如何仍有待進一步研究。

