西紅花苷對缺血性腦卒中后抑郁大鼠炎癥反應及TLR4/MyD88/NF-κB信號通路的影響①
徐倩倩 錢旭東 孫 凡 劉 恒 竇志杰 龔 靜 張雪茹
(承德醫學院附屬醫院神經內科,承德 067000)
卒中后抑郁是腦卒中后常見的情感障礙,發病率較高,預后較差,且卒中后抑郁可誘發腦卒中再發以及其他血管相關事件。卒中后抑郁的發病機制復雜,研究發現中樞神經系統的炎癥反應在卒中后抑郁的發病中發揮重要作用[1]。西紅花苷為一類水溶性類胡蘿卜素,具有抗炎、心血管保護、神經保護、抗腫瘤等多種藥理活性[2]。陳欣宇等[3]研究發現卒中后抑郁大鼠腦組織IL-1水平升高,西紅花苷可降低腦組織IL-1水平,通過抗炎作用發揮改善卒中后抑郁大鼠的抑郁癥狀。但西紅花苷對卒中后抑郁腦組織中其他炎癥因子的影響及其抗炎的可能機制目前少有報道。本文研究西紅花苷對腦卒中后抑郁大鼠腦組織IL-1β、IL-6、腫瘤壞死因子-α(TNF-α)水平及Toll樣受體4/髓樣分化蛋白88/核轉錄因子-κB(TLR4/MyD88/NF-κB)信號通路的影響,進一步探討西紅花苷對腦卒中后抑郁大鼠抑郁癥狀的緩解作用及可能機制。
1 材料與方法
1.1材料 健康、雌雄各半、清潔級、體重200~220 g SD大鼠購自北京市醫療器械檢驗所,許可證號:SYXK(京)2015-0005,動物購回后在承德醫學院動物房中適應性飼養1周,用標準嚙齒類動物飼養籠飼養,自由進食進水。西紅花苷(源葉生物公司,純度99%,批號:111588-201812);蘇木素(南京建成生物工程研究所);兔抗鼠TLR4多克隆抗體(1∶200)、兔抗鼠MyD88多克隆抗體(1∶200)、兔抗鼠NF-κB多克隆抗體、兔抗鼠P65多克隆抗體、兔抗鼠p-P65多克隆抗體、兔抗鼠I-κBα多克隆抗體、兔抗鼠p-I-κBα多克隆抗體(美國Sigma公司);IL-1β、IL-6、TNF-α ELISA試劑盒(南京建成生物工程研究所);Olympus BX51顯微鏡(日本奧林巴斯);Tanon電泳儀(上海天能科技有限公司)。
1.2方法
1.2.1分組 將72只大鼠根據隨機數字法分為對照組(C組)、模型組(M組)、西紅花苷組(CR組),每組24只。
1.2.2腦卒中模型建立 M組和CR組大鼠采用KoiZumi法建立腦卒中大鼠模型[4]。水合氯醛麻醉大鼠,取頸前正中切口,暴露,分離頸總動脈、頸外動脈、頸內動脈,結扎頸總動脈主干和頸外動脈近端,動脈夾夾閉頸內動脈,頸總動脈分叉處剪開一小口,插入線栓,插入線栓長度約18~20 mm,建立局灶性腦缺血改變,結扎頸內動脈,逐層縫合。對照組大鼠不插入線栓,其他步驟同模型組。建模24 h內,采用Longa 5分法評定大鼠神經功能,行為正常者為0分;提起大鼠對側前肢內收、內旋者為1分;擠壓大鼠兩側,對側抵抗力下降者為2分;大鼠圍繞手術對側轉圈者記3分;無法自主活動者記4分[5]。0分和4分大鼠棄之不用,取正常大鼠重新按上述方法建模以補充。實驗過程中觀察各組大鼠每天進食、飲水、毛色、活動度、逃避反應等情況。實驗過程中死亡大鼠則另取正常大鼠按照同樣方法以補充。
1.2.3腦卒中后抑郁模型建立 M組和CR組大鼠腦卒中建模后7 d開始,按照慢性不可預見的溫和性應激建立腦卒中后抑郁模型,慢性不可預見的溫和性應激包括:禁水17 h、禁食20 h、持續光照17 h、傾斜鼠籠45°17 h、濕籠21 h、水平搖晃5 min、4℃游泳5 min、夾尾1 min、行為限制2 h[6]。以上刺激每日隨機采用1種,相鄰兩天刺激不相同,結合單獨飼養,共21 d,建立腦卒中后抑郁模型,C組大鼠群籠正常環境飼養。建模大鼠糖水消耗實驗和曠場試驗結果與未建模大鼠有顯著性差異表示建模成功。
1.2.4給藥方式 慢性不可預見的溫和性應激期間CR組大鼠腹腔注射西紅花苷(50 mg/kg),1次/d,至應激刺激結束[7]。C組和M組大鼠按照相同方法腹腔注射等量生理鹽水。
1.2.5體重檢測 分別予應激前和應激后稱取各組大鼠體重。
1.2.6糖水適應實驗 先給予大鼠糖水訓練檢測其基線值:第1天內給予2瓶1%蔗糖水,第2天內給予1瓶蔗糖水、1瓶礦泉水,禁食禁水23 h,測接下來1 h糖水消耗,即給予1瓶蔗糖水和1瓶礦泉水。統計糖水偏嗜比(SP)(SP=糖水攝入量/糖水和礦泉水總攝入量×100%)。然后給予2 h正常飲食飲水,禁食禁水 21 h,測1 h糖水消耗,以最后1次SP為基線值,排除SP<60%大鼠,取正常大鼠重新建模補充。分別測量各組大鼠應激前和應激后SP值。
1.2.7曠場試驗 采用80 cm×80 cm×60 cm敞箱進行曠場試驗。將箱底面分為面積相等的25塊,大鼠在底面進行水平活動,若靠邊行走,則穿越1格為1次,若按直徑方向走,10 cm為1次。垂直得分為大鼠雙前爪離開底面再落到底面為1次。分別與應激前和應激后,觀察5 min內各大鼠水平運動次數和垂直運動次數。
1.2.8取材 曠場試驗結束后,每組取12只大鼠進行心臟灌流,至腹腔內臟器由紅色變為蒼白色、左心房流出液為無色時改用多聚甲醛繼續灌注固定腦組織,至大鼠四肢完全變硬后停止灌流,斷頭取出腦組織,多聚甲醛固定4 h,常規進行石蠟包埋,制成 4 μm石蠟切片。每組剩余12只大鼠水合氯醛麻醉,在冰盤上快速開顱取腦,分離海馬組織,將其分為2份,一份用于ELISA測定,一份用于Western blot測定。
1.2.9ELISA測定腦組織IL-1β、IL-6、TNF-α水平 將海馬組織在冰浴環境下研磨勻漿,15 000 r/min 離心20 min,取上清液,ELISA測定腦組織IL-1β、IL-6、TNF-α水平。
1.2.10免疫組化測定腦組織TLR4、MyD88、NF-κB表達 取海馬最大的冠面切片進行免疫組化染色:將海馬組織石蠟切片脫蠟、水化,枸櫞酸修復緩沖液高壓熱修復抗原,置于過氧化氫中孵育10 min封閉內源性過氧化物酶活性,PBS沖洗,加入一抗:兔抗鼠TLR4多克隆抗體(1∶200)、兔抗鼠MyD88多克隆抗體(1∶200)、兔抗鼠NF-κB多克隆抗體(1∶200)過夜孵育,PBS液沖洗,加入抗兔抗體酶復合物孵育30 min,PBS液沖洗,DAB顯色10 min,流水沖洗,蘇木素復染2 min,PBS液沖洗,梯度酒精脫水,二甲苯透明,中性樹膠封片。陰性對照用PBS代替一抗。胞漿呈棕黃色為陽性細胞。鏡下觀察200倍視野下CA1區免疫組化陽性細胞數。
1.2.11Western blot測定各組大鼠腦組織P65、p-P65、I-κBα、p-I-κBα蛋白水平 取大鼠海馬組織加入RIPA裂解液冰浴中勻漿,收集總蛋白,考馬斯亮藍法測定蛋白總量,經電泳,轉膜,脫脂奶粉封閉,加入一抗:兔抗鼠P65多克隆抗體(1∶300)、兔抗鼠p-P65多克隆抗體(1∶300)、兔抗鼠I-κBα多克隆抗體(1∶300)、兔抗鼠p-I-κBα多克隆抗體(1∶300),過夜孵育,加入二抗(1∶2 000)孵育2 h,ECL發光劑發光,膠片上曝光,經顯影定影后,采用Quantity One軟件分析條帶灰度值。以β-actin為內參。目標蛋白水平以目標蛋白條帶灰度值/β-actin條帶灰度值表示。
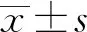
2 結果
2.13組大鼠一般狀態 C組大鼠進食、飲水、毛色、活動度均正常;M組大鼠進食、飲水減少,毛色差、活動量明顯減少,無明顯逃避反應;CR組大鼠進食、飲水、毛色、活動度及逃避反應均較M組改善。整個實驗過程中共死亡15只大鼠,均另取正常大鼠按照同樣方法處理以補充。
2.23組大鼠體重比較 應激前,3組大鼠體重差異無統計學意義(F=0.074,P=0.929);應激后,3組大鼠體重差異有統計學意義(F=65.672,P<0.001),M組大鼠體重低于C組,CR組大鼠體重高于M組。見圖1。
2.33組大鼠SP比較 應激前,3組大鼠SP差異無統計學意義(F=0.130,P=0.878);應激后,3組大鼠SP差異有統計學意義(F=214.307,P<0.001),M組大鼠SP低于C組,CR組大鼠SP高于M組。見圖2。
2.43組大鼠水平運動次數比較 應激前,3組大鼠水平運動次數差異無統計學意義(F=0.049,P=0.952); 應激后,3組大鼠水平運動次數差異有統計學意義(F=115.912,P<0.001),M組大鼠水平運動次數低于C組,CR組大鼠水平運動次數高于M組。見圖3。

圖1 3組大鼠應激前后體重比較Fig.1 Comparison of body weight before and after stress in three groups of ratsNote:Compared with C group,*.P<0.05;compared with M group,#.P<0.05.
2.53組大鼠垂直運動次數比較 應激前,3組大鼠垂直運動次數差異無統計學意義(F=0.355,P=0.702);應激后,3組大鼠垂直運動次數差異有統計學意義(F=69.910,P<0.001),M組大鼠垂直運動次數低于C組,CR組大鼠垂直運動次數高于M組。見圖4。
2.63組大鼠海馬組織IL-1β、IL-6、TNF-α水平比較 應激后,3組大鼠海馬組織IL-1β、IL-6、TNF-α水平差異有統計學意義(P<0.05),M組大鼠海馬組織IL-1β、IL-6、TNF-α水平高于C組,CR組大鼠海馬組織IL-1β、IL-6、TNF-α水平低于M組。見表1。
2.7各組大鼠海馬組織TLR4、MyD88、NF-κB免疫組化表達 應激后,3組大鼠海馬組織TLR4、MyD88、NF-κB陽性細胞數差異有統計學意義(P<0.05),M組大鼠海馬組織TLR4、MyD88、NF-κB陽性細胞數高于C組,CR組大鼠海馬組織TLR4、MyD88、NF-κB陽性細胞數低于M組。見表2、圖5~7。
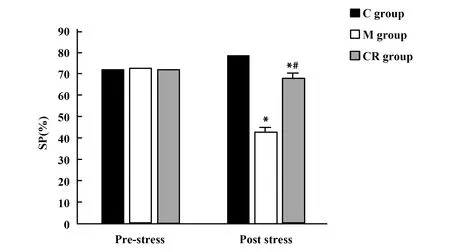
圖2 3組大鼠應激前后SP比較Fig.2 Comparison of SP before and after stress in three groups of ratsNote:Compared with C group,*.P<0.05;compared with M group,#.P<0.05.
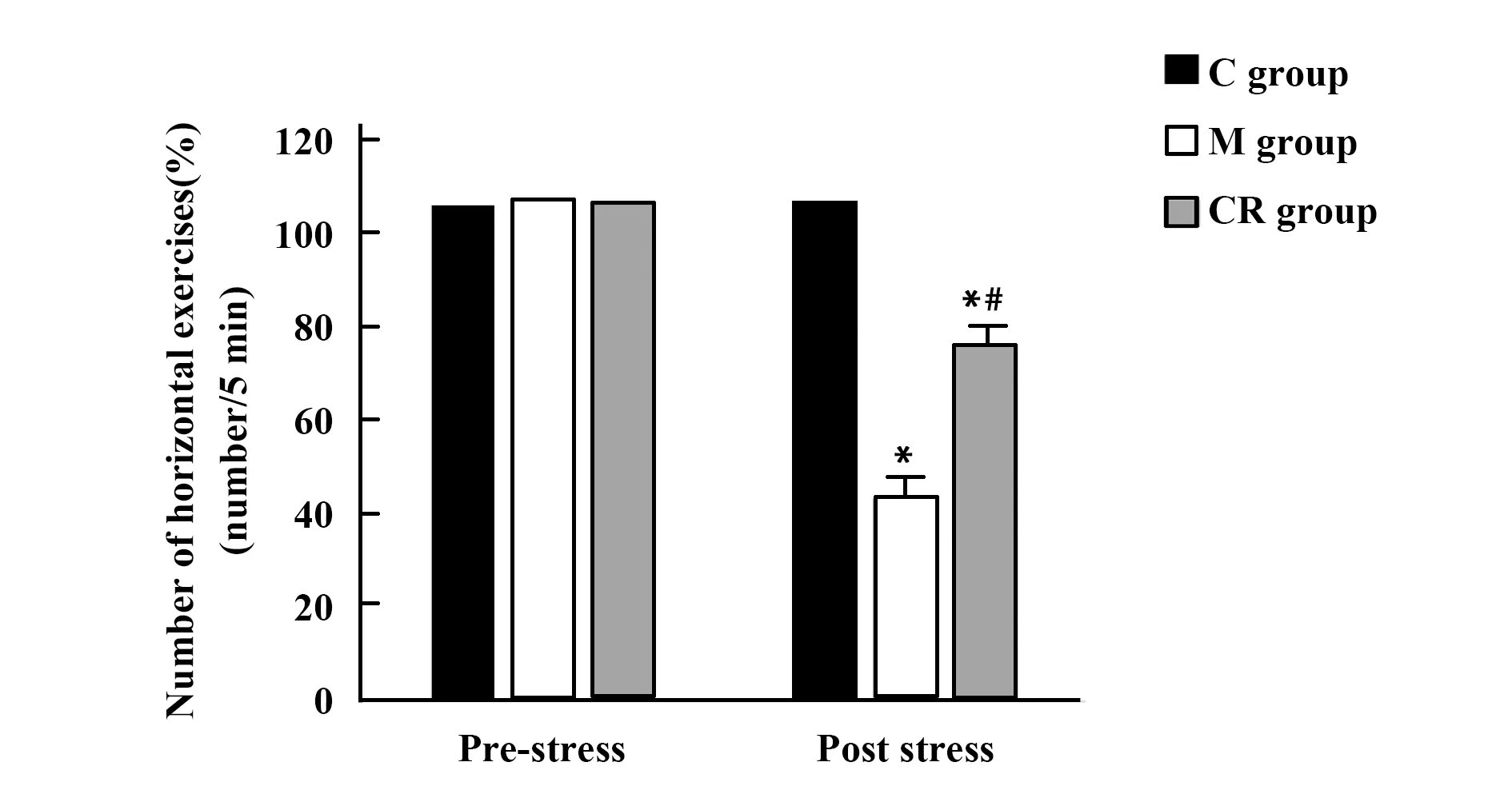
圖3 3組大鼠應激前后水平運動次數比較 Fig.3 Comparison of horizontal exercises number before and after stress in three groups of ratsNote:Compared with C group,*.P<0.05;compared with M group,#.P<0.05.
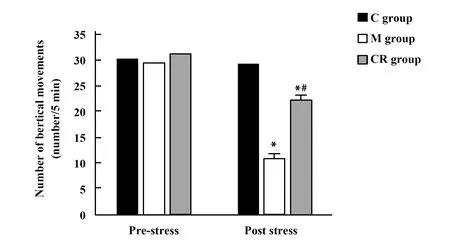
圖4 3組大鼠應激前后垂直運動次數比較(次/5 min)Fig.4 Comparison of vertical movements number before and after stress in three groups of rats(number/5 min)Note:Compared with C group,*.P<0.05;compared with M group,#.P<0.05.
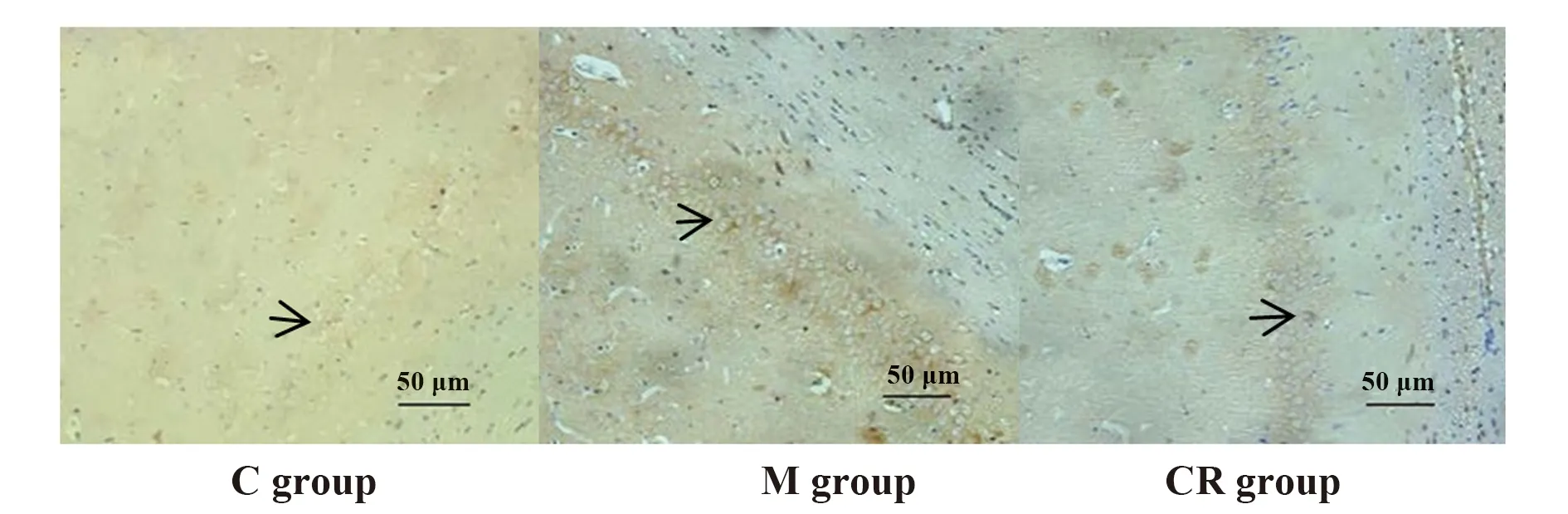
圖5 免疫組化測定3組大鼠海馬組織TLR4表達(×200)Fig.5 TLR4 expression in hippocampus tissue of three groups of rats by immunohistochemistry(×200)

圖6 免疫組化測定3組大鼠海馬組織MyD88表達(×200)Fig.6 MyD88 expression in hippocampus tissue of three groups of rats by immunohistochemistry(× 200)

圖7 免疫組化測定3組大鼠海馬組織NF-κB表達(×200)Fig.7 NF-κB expression in hippocampus tissue of three groups of rats by immunohistochemistry(×200)
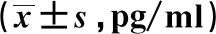
表1 3組大鼠海馬組織IL-1β、IL-6、TNF-α水平比較
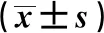
表2 3組大鼠海馬組織TLR4、MyD88、NF-κB陽性細胞數比較
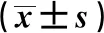
表3 3組大鼠海馬組織P65、p-P65、I-κBα、p-I-κBα蛋白水平比較
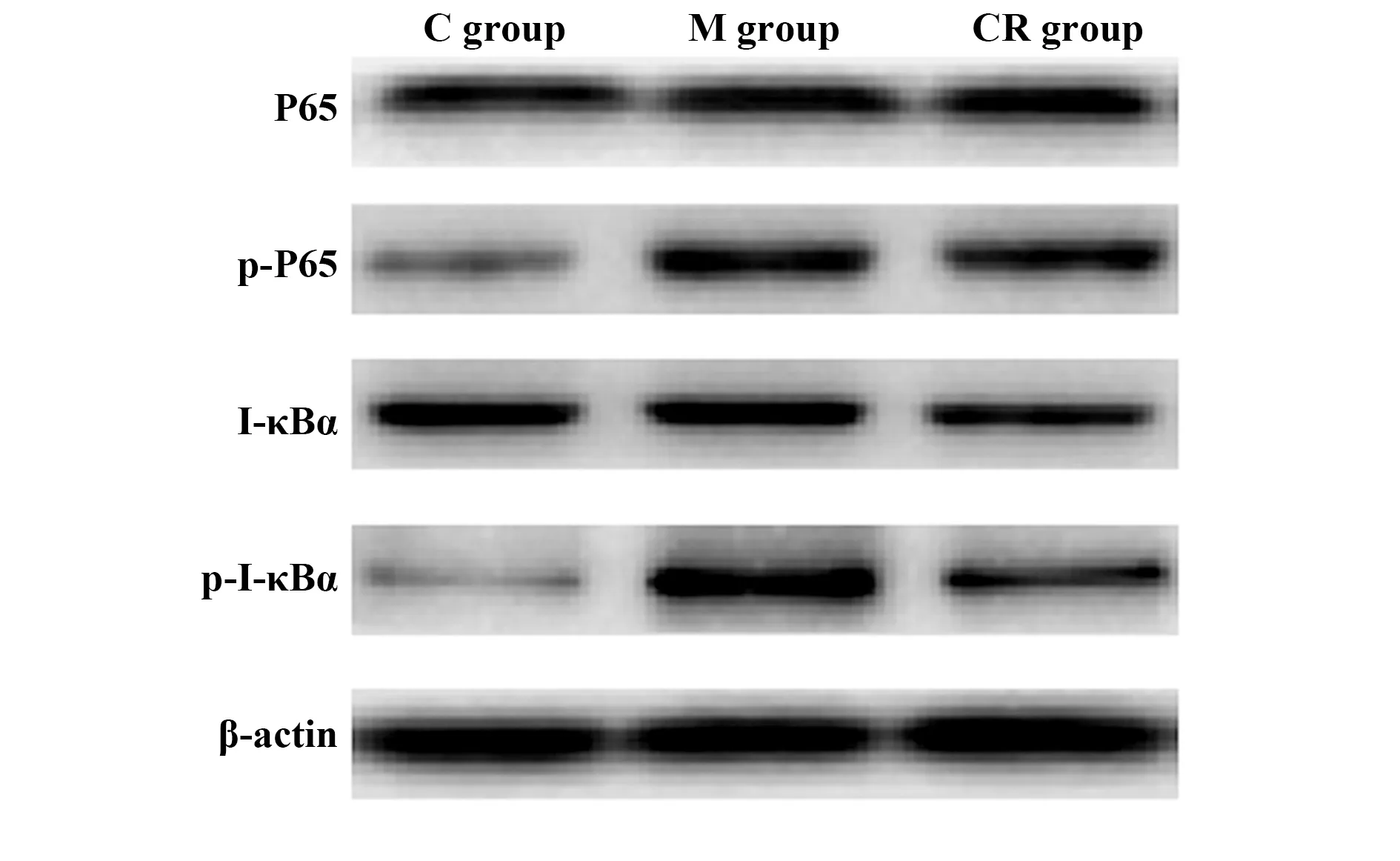
圖8 Western blot測定各組大鼠海馬組織P65、p-P65、I-κBα、p-I-κBα蛋白水平Fig.8 Western blot determination of P65,p-P65,I-κBα,and p-I-κBα protein levels in hippocampus tissue of rats in each group
2.83組大鼠海馬組織P65、p-P65、I-κBα、p-I-κBα蛋白水平比較 3組大鼠海馬組織P65、I-κBα蛋白水平差異無統計學意義(P>0.05);3組大鼠海馬組織p-P65、p-I-κBα蛋白水平差異有統計學意義(P<0.05),M組大鼠海馬組織p-P65、p-I-κBα蛋白水平高于C組,CR組大鼠海馬組織p-P65、p-I-κBα蛋白水平低于M組。見表3、圖8。
3 討論
腦卒中后抑郁為腦卒中后比較嚴重的一類并發癥,大約1/3的腦卒中患者會出現腦卒中后抑郁。腦卒中后抑郁為一類慢性疾病,患者往往出現失望、悲觀、對治療失去信心、絕食及自殺傾向,從而對患者的預后帶來不良影響。腦卒中后抑郁的發病機制復雜,近年來研究已證實腦卒中后抑郁患者抑郁行為的發生是由促炎細胞因子介導的,腦卒中可引起IL-1β、IL-6、TNF-α等多種促炎因子水平升高,這些炎癥因子和內分泌功能、神經遞質代謝、突觸可塑性等病理生理過程關系密切[6-8]。下丘腦-垂體-腎上腺軸異常和抑郁癥的發生關系密切,下丘腦-垂體-腎上腺軸的激活是抵御應激的內分泌機制之一;IL-1β、IL-6、TNF-α等炎癥因子是引起下丘腦-垂體-腎上腺素軸改變的潛在因素之一,其可引起皮質醇和乙酰膽堿水平升高,影響去甲腎上腺素活性。炎癥細胞因子水平升高還可引起吲哚胺-2,3-雙加氧酶升高,導致腦組織5-HT含量下降,從而誘發抑郁癥狀的發生。如WEN等[9]研究發現腦卒中誘發的炎癥反應與腦卒中后抑郁的關系密切;JIAO等[10]研究發現IL-6與腦卒中后抑郁的患病風險呈正相關,可以預測腦卒中后抑郁的預后;WIUM-ANDERSEN等[11]研究發現抗炎治療可降低腦卒中后抑郁的患病風險。由此可見,抑制炎癥反應對腦卒中后抑郁具有防治作用。
炎癥反應可由多種信號通路介導,TLR4/MyD88/NF-κB信號通路為介導炎癥反應的主要信號通路之一。TLRs為Ⅰ型跨膜蛋白,其和配體結合可導致細胞內同源區募集接頭蛋白,從而活化炎癥反應,產生一系列炎癥因子[12-16]。TLR4為研究最廣泛的一種,在中樞神經系統中,TLR4主要在神經膠質細胞中表達。腦損傷時產生的內源性配體可激活TLR4,活化的TLR4通過MyD88依賴性信號通路激活NF-κB。在MyD88依賴性信號途徑中,MyD88與IL-1受體相關激酶結合,激活TNF受體相關因子-6,使I-κKɑ/β磷酸化被激活,從而進一步激活NF-κB,NF-κB轉入細胞核,誘導產生IL-1β、IL-6、TNF-α等一系列炎癥因子,從而導致炎癥反應的發生[17]。
西紅花苷來源于番紅花、梔子花,具有抗腫瘤、抗血栓、調節免疫功能、保護神經元、抗神經炎癥等多種作用。大量研究發現西紅花苷在多種炎癥相關性疾病中發揮抗炎作用,如LI等[12]研究發現西紅花苷可抑制類風濕關節炎的炎癥反應;YARIJANI等[13]研究發現西紅花苷通過抑制炎癥反應發揮對缺血再灌注引起腎臟損傷的保護作用;SHAFAHI等[14]研究發現西紅花苷通過抗炎作用抑制海馬神經元凋亡;LIU等[15]研究發現西紅花苷對大鼠Ⅱ型膠原誘導的關節炎具有抗炎和抗關節炎作用。西紅花苷可通過NF-κB信號通路發揮作用,如FU等[18]研究發現西紅花苷通過抑制NF-κB信號通路激活來抑制破骨細胞形成和骨吸收;DU等[19]研究發現西紅花苷可通過抑制NF-κB信號激活減少煙曲霉誘導的氣道炎癥;LI等[20]研究發現西紅花苷可抑制NF-κB信號通路引起的炎癥反應,發揮對足細胞的保護作用。
本文通過建立腦卒中后抑郁大鼠模型,并給予西紅花苷治療,發現西紅花苷可改善腦卒中后抑郁大鼠的抑郁癥狀,降低海馬組織IL-1β、IL-6、TNF-α水平。表明西紅花苷可能通過抑制腦組織炎癥反應緩解腦卒中后抑郁大鼠的抑郁癥狀。介于TLR4/MyD88/NF-κB信號通路在介導炎癥反應中發揮重要作用,西紅花苷可通過NF-κB信號通路抑制炎癥反應,因此推測西紅花苷可能通過TLR4/MyD88/NF-κB信號通路抑制炎癥反應,從而發揮抗抑郁作用。本文對其進行研究,發現西紅花苷可降低腦卒中后抑郁大鼠海馬組織中TLR4、MyD88、NF-κB表達,降低海馬組織p-P65、p-I-κBα蛋白水平。p-P65為NF-κB的活化形式,p-P65水平降低表明NF-κB的活化被抑制;I-κBα本身具有抑制NF-κB活化的作用,I-κBα降解可導致NF-κB進入細胞核內活化,啟動下游因子表達,抑制I-κBα降解,可抑制I-κBα磷酸化過程,降低p-I-κBα水平,從而抑制NF-κB轉錄活化水平[21]。故本研究結果表明西紅花苷具有抑制TLR4/MyD88/NF-κB信號通路激活的作用,由此推測西紅花苷可能通過抑制TLR4/MyD88/NF-κB信號通路激活抑制腦組織炎癥反應的發生,從而發揮對腦卒中后抑郁大鼠抑郁癥狀的改善作用。
綜上所述,西紅花苷具有抑制腦卒中后抑郁大鼠抑郁癥狀的作用,其機制可能為西紅花苷通過抑制腦組織TLR4/MyD88/NF-κB信號通路抑制炎癥反應,從而抑制抑郁癥狀的發生。

