集胞藻PCC6803中基因slr0681功能初步研究
崔曉艷 鐘軻 耿耘 宣寧 孫秀芹 牛旭東 康佳 陳高

摘要:類胡蘿卜素是人體內維生素A的主要來源,具有抗氧化、免疫調節、抗癌等作用。前期初步推測集胞藻PCC6803中slr0681基因在類胡蘿卜素代謝中有重要作用。本研究利用同源重組方法構建了slr0681基因敲除突變株Δslr0681,研究了突變株與野生型在高鹽脅迫條件下葉綠素a和類胡蘿卜素含量變化以及光系統Ⅰ(PSⅠ)和光系統Ⅱ(PSⅡ)相關基因表達情況。結果表明,高鹽脅迫下,突變株比野生型更具生命活力;高鹽脅迫下Δslr0681中類胡蘿卜素和葉綠素a含量高于野生型;PSⅠ中psaA、psaB、psaL和PSⅡ中psbB、psbD基因的相對表達量較野生型分別增加3.4、1.9、1.5倍和2.1、1.6倍。以上結果表明,slr0681基因對于集胞藻類胡蘿卜素代謝有重要作用,并且在高鹽脅迫條件下影響更為突出。本研究為后續利用合成生物學策略提高微藻類胡蘿卜素代謝奠定了基礎。
關鍵詞:集胞藻PCC6803;slr0681基因;類胡蘿卜素;高鹽脅迫;光系統
中圖分類號:Q949.22:Q78 文獻標識號:A 文章編號:1001-4942(2021)12-0001-07
集胞藻PCC6803(以下簡稱集胞藻)是一種單細胞藍藻,有天然的外源DNA轉化系統,具有遺傳背景清晰、表達外源產物不形成包含體等優點[1],是理想的藍藻基因工程受體。
類胡蘿卜素在動物和人體中發揮著重要的作用,如預防疾病、提高機體免疫力、維持動物正常生長與繁殖等。類胡蘿卜素是一類脂溶性的類異戊二烯化合物,也是進行光合作用、由生物產生的親脂性色素[2],其可通過猝滅活性氧防止氧化,并且可在光合生物中收集光能[2,3],在許多生物中起著核心作用。
近年來,類胡蘿卜素在醫藥、食品、保健品、化妝品以及飼料行業中得到了廣泛應用[4]。隨著人們健康意識的不斷加強,從天然原料中獲得的類胡蘿卜素受到越來越多消費者的歡迎。目前,類胡蘿卜素的生產方式主要有化學合成、天然提取與生物合成3種。相對于前兩種方式,微生物合成的方式安全、天然,是健康可行的生產類胡蘿卜素方式。
藍藻中色素的積累受外界環境的影響,如光照、營養鹽、溫度以及酸度[5-8]等。集胞藻是一種中等耐鹽的淡水藍細菌,可在短時間內耐受高達1.2mol/L的氯化鈉。培養基中加入高鹽后可導致集胞藻細胞內自由水減少,且濃度增加的無機離子對細胞的新陳代謝產生毒性作用。藍藻細胞可使用“鹽外排策略”適應高鹽環境。首先藍藻細胞迅速失水和收縮;之后,Na+和Cl-進入細胞降低水勢,水回流到細胞中;細胞中高Na+含量會抑制細胞中的各種生理反應,特別是光合作用和翻譯,將有毒的Na+交換為毒性較小的K+可以重新激活光合作用,并開始合成兼容的溶質;藍藻的主要相容溶質是葡萄糖基甘油,積累葡萄糖基甘油允許多余的離子流出,然后基因表達再次被激活,最后基因表達的變化導致完全適應高鹽環境[9]。
地球上淡水資源有限,所以未來生物技術改造的藍藻大規模培養必須依賴海水,因而理想的菌株至少能在海水中生長,且有更高的耐鹽性。集胞藻PCC6803在高鹽條件下有較大比例的轉運與結合相關的基因上調[10],slr0681基因編碼鈉鈣轉運蛋白,因此研究在高鹽脅迫條件下敲除該基因的突變株Δslr0681的生化指標尤為重要。
本試驗利用同源重組方法構建了slr0681基因敲除突變株Δslr0681,研究了突變株在高鹽脅迫下葉綠素和類胡蘿卜素的變化及光系統相關基因的表達情況,以期為促進微藻在生物能源上的應用提供理論依據。
1 材料與方法
1.1 材料
1.1.1 菌株和質粒 集胞藻PCC6803、質粒pBluescriptsk(-)為本實驗室保存,大腸桿菌DH5α購自北京全式金生物技術有限公司。
1.1.2 主要試劑 DNA凝膠回收試劑盒、質粒提取試劑盒、EvoM-MLV反轉錄試劑盒購自AG公司;限制性內切酶、T4DNA連接酶購自TaKaRa公司;ChamQUniversalSYBRMasterMixes購自Vazyme公司。
1.2 培養條件
集胞藻使用BG-11培養基培養,培養條件為30℃、光照強度40μmol/(m2·s),連續光照靜置培養[11],采用SP-723型可見分光光度計在730nm處測定OD值(OD730),確定細胞密度。DH5α使用LB培養基于37℃進行培養。
1.3 Δslr0681突變株的獲得
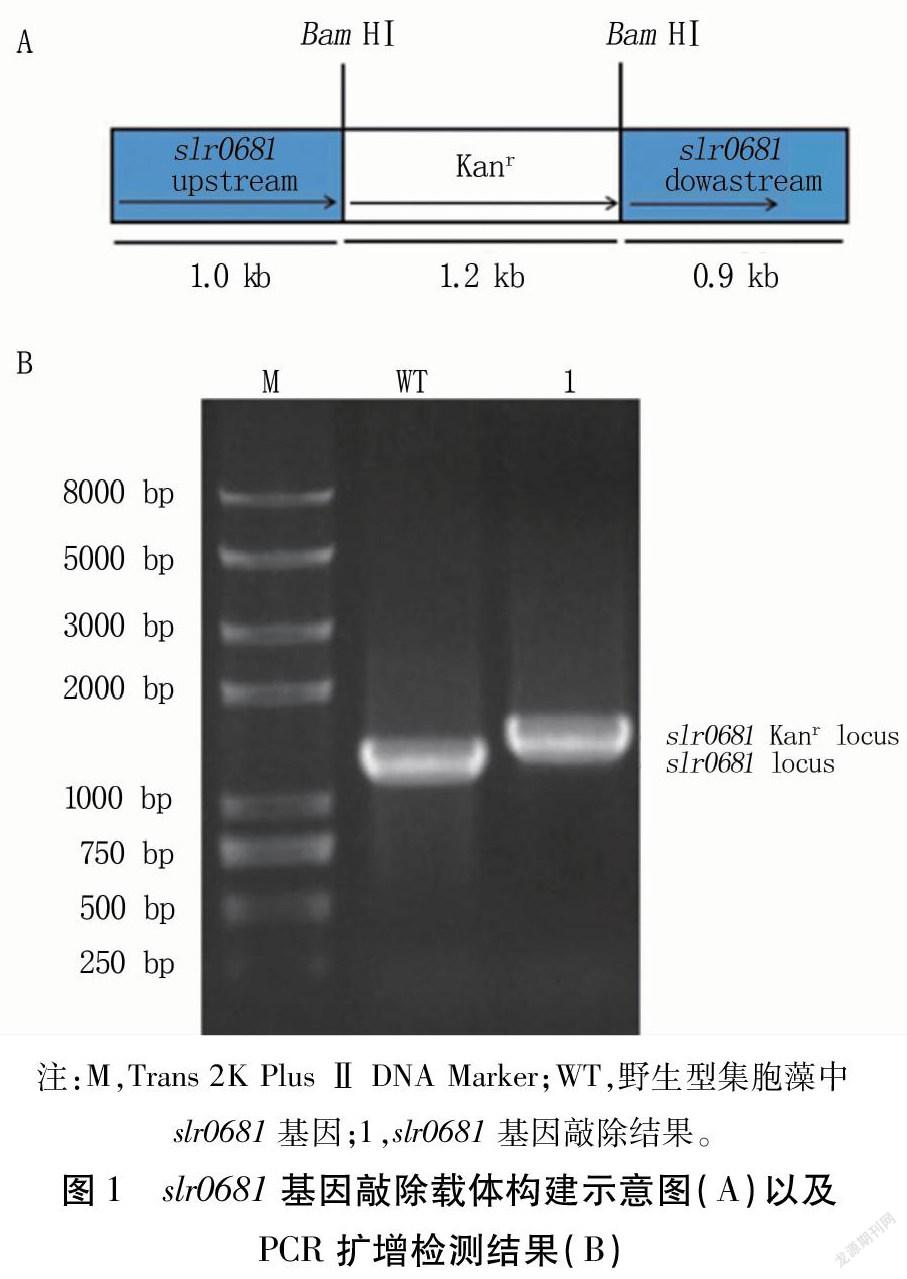
1.3.1 失活質粒構建 通過PCR方法用slr0681-1-F(5′GCTTTGCTGGATGTGCCCT3′)/slr0681-1-BamHⅠ-R(5′GGTGGAAAATAGGATCCGTTTGCTCTCAATAAGC3′)、slr0681-2-BamH Ⅰ -F(5′AACGGATCCTATTTTCCACCAAAGCCCATT3′)/slr0681-2-R(5′TTCGGCATGGGCTAACAA3′)引物從集胞藻基因組DNA中分別擴增得到slr0681基因的上下游片段。將兩基因片段連接到T3克隆載體后轉化至大腸桿菌DH5α,篩選陽性克隆并測序,制得slr0681-T3質粒。將slr0681-T3質粒用BamHⅠ酶切,回收載體片段;用BamHⅠ酶切pBluescriptsk(-)載體,回收卡那霉素抗性片段。用T4連接酶連接載體片段和卡那霉素抗性片段后轉化至大腸桿菌DH5α。通過篩選陽性克隆,獲得集胞藻slr0681基因敲除載體,命名為pΔslr0681。
1.3.2 集胞藻轉化及突變株篩選和鑒定 用質粒pΔslr0681轉化集胞藻,具體步驟參考Liu等[12]的方法。集胞藻轉化子在含有50μg/mL卡那霉素的BG-11固體培養基中長出后,轉到含有50μg/mL卡那霉素的液體培養基中傳代培養,并逐步提高卡那霉素濃度至200μg/mL。PCR鑒定卡那霉素抗性基因的插入,直至所有野生型拷貝完全消失,分別以集胞藻和突變株DNA為模板,以slr0681-F(5′ATGATGACTTGGTTGACC3′)和slr0681 -R(5′TTAGATTCCGGTATCGTT3′)為引物進行擴增,檢測條帶大小,獲得突變株Δslr0681。
1.4 高鹽脅迫處理
將野生型集胞藻(WT)和突變株Δslr0681在含0.51mol/LNaCl(3%,W/V)的BG-11液體培養基中培養,OD730值為0.2時,取100mL分裝到250mL三角瓶中。每隔24h觀察不同處理間的表型變化。
1.5 集胞藻生長曲線及葉綠素a和類胡蘿卜素含量測定
將WT和Δslr0681分別接種于正常和高鹽BG-11液體培養基中,調節OD730值至0.2,于30℃、光照強度40μmol(m2·s)條件下培養,分別于0、1、2、3、4、5、6、7、8d取樣,通過每天測定OD730值監測其生長情況。
每個樣品另取2mL,于13000r/min離心10min,沉淀用1mLN,N-二甲基甲酰胺溶液重懸,吸打混勻,于13000r/min離心10min,取上清液用分光光度計分別測定OD461、OD625、OD664值,并根據公式計算類胡蘿卜素和葉綠素a含量。
類胡蘿卜素(μg/mL) =(OD461 -0.046×OD664)×4 ;
葉綠素a(μg/mL)=12.1×OD664 -0.17×OD625 。
1.6 類胡蘿卜素的提取及HPLC分析
取各時期WT和Δslr0681樣品各2mL,于13000r/min離心10min,藻沉淀用1mL甲醇溶液懸浮,吸打混勻以萃取細胞色素,然后13000r/min離心10min,取上清液用高效液相色譜法(HPLC)檢測分析類胡蘿卜素組分。所用色譜柱型號為AcclaimC-18反相柱120A(5μm,4.6mm×250mm),具體步驟參考Liu等[12]的方法。
1.7 qRT-PCR分析
取對數生長期(OD730值為0.6)集胞藻50mL,7000r/min離心10min,收集沉淀,液氮中研磨,用Trizol法提取RNA[12]。電泳檢測RNA片段完整性,用核酸蛋白測定儀檢測RNA濃度及純度。用EvoM-MLV反轉錄試劑盒合成cDNA。以cDNA為模板,以集胞藻rnpB為內參基因,對光系統PSⅠ中psaA、psaB、psaL基因以及光系統PSⅡ 中psbA2、psbD、psbB基因進行表達量分析[13]。所用熒光染料為ChamQUniversalSYBRMasterMixes,系統為ABI7500實時PCR,使用2-△△Ct方法分析實時定量PCR數據。
1.8 數據處理
采用MicrosoftExcel2010軟件進行數據整理,所有數據均為3次試驗平均值,使用Origin軟件作圖。
2 結果與分析
2.1 slr0681基因的敲除
在slr0681基因中加入BamHⅠ酶切位點,與卡那霉素抗性片段連接,構建slr0681基因定向敲除載體(圖1A)。
以集胞藻為模板,以slr0681-F和slr0681-R為引物擴增得到slr0681基因片段(1.2kb)。以Δslr0681DNA為模板,以相同引物對擴增,得到約1.4kb左右的片段,并且在1.2kb處沒有片段(圖1B)。表明卡納霉素抗性片段已經以雙交換方式整合到集胞藻染色體上,突變株Δslr0681構建成功。
2.2 WT和Δslr0681在高鹽脅迫條件下的生長情況
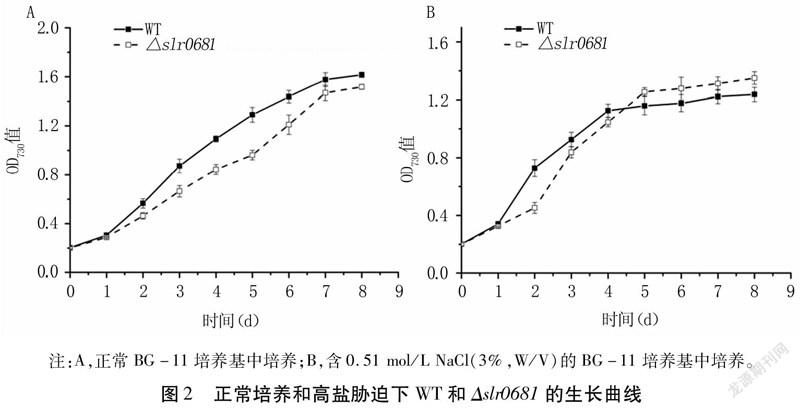
正常培養條件下,Δslr0681生長速率均低于WT,在第5d二者濃度差達到最大,但第6d后兩者濃度差逐漸變小(圖2A)。高鹽脅迫條件下,從第5d開始突變株的濃度均高于WT(圖2B),說明敲除slr0681基因在一定程度上影響了藻株的生長。WT在高鹽脅迫初期適應能力更強,Δslr0681生長有較長的遲緩期,但5d后生命活力高于WT,這可能是由于slr0681基因的缺失導致更多的有毒Na+排出,增強了集胞藻的耐鹽性,從而促進了高鹽脅迫下Δslr0681的生長。
2.3 WT和Δslr0681在高鹽脅迫條件下的表型變化
高鹽脅迫下WT和Δslr0681相較于正常培養條件下的生長處于弱勢狀態。正常條件下培養的WT和Δslr0681顏色無明顯差異,而在高鹽脅迫下培養到第6d時,WT和Δslr0681顏色差異最為明顯,Δslr0681比WT更具生命活力(圖3)。表明slr0681基因敲除對于藻株的生長產生了影響。
2.4 WT和Δslr0681在高鹽脅迫條件下的類胡蘿卜素和葉綠素a含量變化
由圖4可知,在正常培養和高鹽脅迫培養的前7d,WT和Δslr0681中類胡蘿卜素含量隨著藻株的生長不斷增加,第8d則降低。正常培養條件下,WT的類胡蘿卜素含量均高于Δslr0681,第5d時差異明顯,差值達1.23μg/mL;第6~8d差異逐漸減小(圖4A)。高鹽脅迫條件下,Δslr0681從第5d開始類胡蘿卜素含量明顯高于WT,第7d差值最大,為0.356μg/mL(圖4B)。
正常培養條件下,WT和Δslr0681的葉綠素a含量隨培養時間延長逐漸增加,且二者差異不明顯(圖5A)。高鹽脅迫條件下,WT和Δslr0681的葉綠素a含量呈先升高后降低趨勢,在第4d差值最大,為1.40μg/mL(圖5B)。
利用HPLC法檢測WT和Δslr0681中類胡蘿卜素各組分相對含量,發現在高鹽脅迫條件下,與WT相比,Δslr0681中海膽酮含量積累最為突出。這可能是因為slr0681基因的敲除增強了藻株的耐鹽性,促進了高鹽脅迫下Δslr0681的生長,從而增加了類胡蘿卜素和葉綠素a的含量;slr0681基因的敲除可能會間接影響類胡蘿卜素代謝途徑中某些基因的表達,促進海膽酮積累。
2.5 WT和Δslr0681光系統相關基因表達量
類胡蘿卜素中β-胡蘿卜素是光系統組分的核心,本試驗對光系統相關基因的表達量進行qRT-PCR分析,結果表明,正常培養條件下,Δslr0681PSⅠ中psaA、psaB、psaL基因表達量比WT低,PSⅡ中psbA2、psbD、psbB基因表達量與WT差異不大(圖6A)。高鹽脅迫條件下,Δslr0681中psaA、psaB、psaL、psbB、psbD基因的表達量分別是WT的3.4、1.9、1.5、2.1、1.6倍(圖6B)。這可能是因為slr0681基因影響藻株中某個或某些基因的表達,使PSⅠ和PSⅡ中相關基因的表達發生變化。
3 討論與結論
藍藻是藻類中最早能穩定表達外源基因的種類[14,15]。集胞藻是研究代謝調控的模式生物,也是用合成生物學改造構建細胞工廠的優良底盤[16,17]。Koch等[18]對集胞藻Slr0058蛋白的研究結果表明,Slr0058是一種參與PHB(聚-β-羥丁酸)形成的新型調節蛋白,在氮脅迫下Slr0058在PHB形成中起促進作用,該研究有助于更好地了解集胞藻的PHB代謝以及PHB的可持續工業生產;Mohamed等[19]研究了集胞藻中Sll0254編碼產藍藻葉黃素的雙功能番茄紅素環化酶/雙加氧酶,結果表明Sll0254基因不僅影響藻株生長,還具有番茄紅素環化酶和雙加氧酶活性,為微藻類胡蘿卜素代謝研究提供了理論基礎。本研究前期初步推測集胞藻中slr0681基因在類胡蘿卜素代謝中有重要作用。本試驗利用同源重組方法構建了slr0681基因敲除突變株Δslr0681,結果表明slr0681基因的敲除影響了藻株的生長、類胡蘿卜素的合成以及光系統相關基因的表達。由于藻類生長和類胡蘿卜素代謝基因調控的錯綜復雜性,本研究還無法判斷slr0681基因的具體作用位置。
集胞藻中色素的積累受光照、氮濃度以及鹽濃度等外界環境的影響[1,20,21]。Li等[22]研究了一種鎂轉運體slr1216參與集胞藻的鈉耐受性,表明轉運體slr1216可能通過影響細胞內糖基甘油的表達參與耐鹽調節,這為集胞藻在高鹽脅迫條件下生長提供了理論指導。利用藍藻抗鹽機制可構建對鹽耐受能力更高的菌株從而進行生物燃料的大規模生產。然而,目前的研究結果并不能全面闡述藍藻對鹽脅迫的反應機理,因此要想最大限度提高藍藻對鹽的耐受性,從而實現高濃度鹽下的大規模工業化培養,還需要進行深入的研究[22]。
slr0681是一種鈉鈣轉運蛋白,但作用位置尚不清楚。本研究利用同源重組技術構建了slr0681基因敲除突變藻株,得出slr0681基因為抗鹽調節因子,與類胡蘿卜素代謝相關,能夠影響光系統中相關基因的表達,為我們進一步研究該基因的具體性質和逆境條件下的具體功能奠定了基礎。

