載體介導杜氏肌營養不良癥的基因治療研究現狀
張鵬程,宋亞鋒
0 引言
杜氏肌營養不良癥(Duchenne Muscular Dystrophy,DMD)是由肌營養不良蛋白(Dystrophin)缺失或減少引起的全身肌肉漸進性損傷和運動功能減退的致死性基因遺傳病。致病基因DMD位于人體23號性染色體Xp21.1-p21.2上。基因組全長2.26Mb,包含79個外顯子。由于致病基因尺寸巨大、累及人體肌肉組織龐大且遍布全身,為DMD患者治療帶來困難。目前,尚無有效的治療方法。但隨著人們對DMD的發病機制和病理變化過程逐漸深入認識,全世界對DMD患者已采用包括藥物治療、物理治療、基因治療、干細胞療法和運動訓練療法等多種治療手段。
正常DMD基因長度較長,患者除了從親本獲得性遺傳導致發病之外,多數病例是由自發的新突變引起。因此不同患者之間Dystrophin蛋白缺失或減少的類型和程度不同,對機體的影響也就不盡相同。基因治療具有一定的普適性,能從根本上改善肌肉功能。載體介導DMD基因治療正是通過向組織或細胞內遞送具有功能的基因來代替受影響的DMD基因,成為DMD基因治療的主要研究熱點之一。本文就近年載體介導DMD基因治療綜述如下。
1 背景
DMD在19世紀中期被鑒定為一種遺傳性疾病。DMD患者多于2~5 歲時出現肌肉無力,伴隨肌肉功能逐漸下降,最終在20~30歲死于心肺功能衰竭[1]。每5 000個新生男嬰中就有1個患有DMD[2]。通過無創機械通氣和心血管藥物治療與無任何干預的治療相比,能延長DMD患者壽命[3]。糖皮質激素也能夠改善DMD患者的肌肉力量和呼吸功能,提高患者獨立行走能力[4-5]。但這些干預措施并沒有從微觀上改善患者的肌肉結構。
Dystrophin 蛋白在肌細胞骨架肌動蛋白和跨膜肌營養不良蛋白糖蛋白復合物(Dystrophin-associated glycoprotein complex,DGC)之間形成重要的機械連接,這些蛋白質共同保護肌纖維膜免受肌肉收縮期間所產生應力帶來的損傷[6]。在缺乏 Dystrophin蛋白的情況下,無法募集DGC復合物,肌纖維膜變得極不穩定。導致肌纖維壞死,炎性細胞浸潤。肌纖維再生以及最終肌纖維被結締組織取代并伴有進行性肌硬化和收縮性喪失。肌肉隨年齡增長因肌纖維再生能力下降而逐漸退化消失,最后累及心肌和膈肌[7]。
DMD另一種更溫和、進展更緩慢的變體被稱為貝克爾肌營養不良癥(Becker muscular dystrophy,BMD)。一位61歲BMD患者缺失17~48號外顯子,幾乎是DMD一半的編碼信息[8]。但該患者肌營養不良癥狀發展速度非常緩慢,壽命明顯高于DMD患者,其原因為突變在DMD基因中的位置不同。隨著人們對肌肉中DMD基因cDNA認識,Cox等[9]通過Full-length Dystrophin cDNA(約14Kb)轉基因糾正mdx小鼠(DMD動物模型)肌營養不良癥狀的潛力,探索DMD基因治療的可行性。結果顯示,在轉基因mdx小鼠肌肉中Dystrophin的表達消除了肌營養不良引起的形態學和免疫組織學癥狀,證明了DMD基因治療的可行性。為適應病毒載體有限的包裝能力,Phelps等[10]構建缺失17~48號外顯子的mini-cDNA(約6Kb)轉染mdx小鼠,發現短序列肌營養不良蛋白依舊可以改善小鼠肌營養不良癥狀。結果表明,病毒載體介導短序列肌營養不良蛋白基因可作為DMD患者的治療方法之一。
2 短序列肌營養不良蛋白的優化設計
2.1 Dystrophin蛋白的結構 Dystrophin蛋白共具有 4 個結構域:氨基端(N-terminal domain,N)、中央棒狀區(Central rod domain)、半胱氨酸豐富結構域(Cysteine-rich domain,CR)和C-末端結構域(C-terminal domain,C)。氨基端包含2個鈣調蛋白同源分子結構,該結構域可以與胞漿內的肌動蛋白結合;中央棒狀區由2 400多個氨基酸組成并構成24個同源三重螺旋重復區(Spectrin-like repeats)和4個鉸鏈域(Hinge)以維持Dystrophin的靈活性;半胱氨酸豐富結構域和C-末端結構域與肌細胞膜蛋白結合(圖1)。
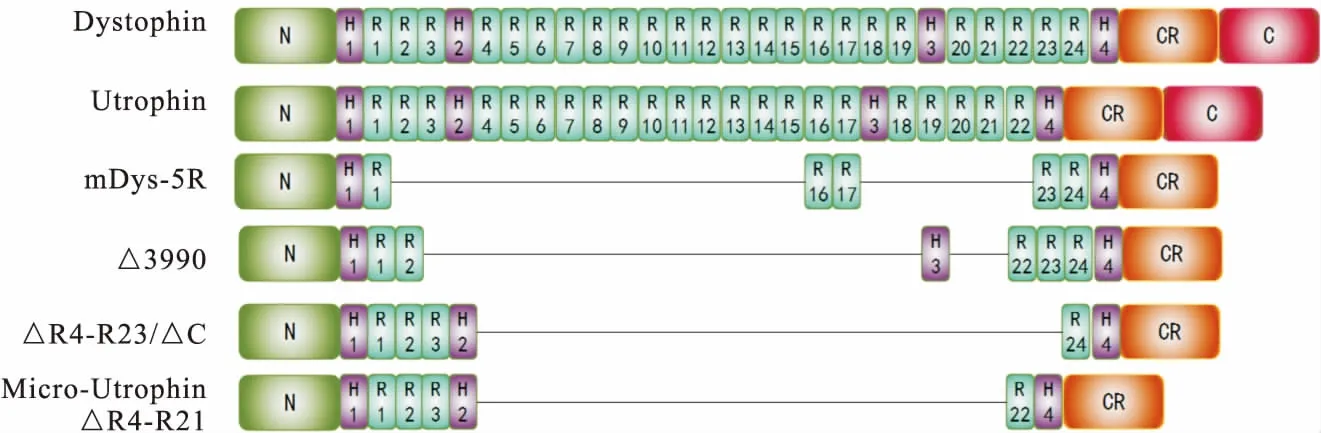
圖1 Dystrophin和Utrophin蛋白結構域模式圖注:N為N-terminal domain,H為Hinge,R為spectrin-like repeats,CR為cysteine-rich domain,C為C-terminal domain。△為設計短序列蛋白時去掉的部分
2.2 優化設計Micro-Dystrophin 隨著生物學的不斷發展,研究者成功從肌肉細胞中分離出DMD cDNA、Dystrophin蛋白,且伴隨對DMD cDNA序列解讀和Dystrophin結構深入認識,我們可以有目的地設計功能短序列并開展動物實驗。Yuasa等[11]率先設計出3.7 kb的△DysM3基因,其包含Dystrophin蛋白的氨基端結構域,Hinge1、Hinge4,repeat1,以及半胱氨酸豐富結構域和C-末端結構域。但這種構型蛋白并沒有在動物模型中產生作用。Crawford等[12]研究發現,在短序列肌營養不良蛋白設計時C-末端結構域可以刪減但并不影響DGC蛋白復合物的募集形成。Harper等[13]對Dystrophin蛋白結構域進行了詳細的功能分析,在保留氨基端和半胱氨酸豐富結構域的基礎上,重新設計了中央棒狀區的連接方式,以產生高功能的短序列肌營養不良蛋白。研究中所使用的不同短序列肌營養不良蛋白構型在小鼠體內產生的效果略有不同。結果表明,使用短序列肌營養不良蛋白的基因治療可以預防和逆轉營養不良的病理過程。
在之后的近20年內,人們不斷重新設計優化spectrin-like repeats和Hinge組合以產生高功能Micro-Dystrophin蛋白[14]。
2.3 Micro-Utrophin可改善肌營養不良癥狀 對Dystrophin蛋白進行研究分析的同時,發現位于正常成年肌肉的神經肌肉接頭處有一種與Dystrophin蛋白結構位置比較相似的蛋白,開始被稱為Dystrophin-related protein(DRP),后更名為Utrophin蛋白。最終發現人體6q24基因UTRN(583.77kb)編碼Utrophin蛋白(圖1)。DMD患者在缺乏Dystrophin蛋白的情況下,Utrophin仍存在于肌膜中,并且Utrophin蛋白在胎兒和再生肌肉中表達。然而DMD患者體內Utrophin蛋白的表達量不足以改善患者因缺失Dystrophin蛋白所帶來的影響。
關于Utrophin蛋白的高表達是否能在功能上補償因缺失Dystrophin蛋白引起的肌營養不良癥狀,Tinsley等[15]為了更詳細地研究Utrophin和Dystrophin之間的關系,克隆并測序了整個Utrophin cDNA,發現Utrophin和Dystrophin之間高度同源,表明它們來自一個共同的祖先基因。Rafael[16]發現在缺失dystrophin和Utrophin兩種蛋白質的情況下,mdx小鼠表現出比只缺失Dystrophinb蛋白更為嚴重的肌肉無力并伴有關節攣縮、明顯的生長遲緩和后凸畸形,這表明Dystrophin和Utrophin起互補作用。Ebihara等[17]使用含有Utrophin或Dystrophin轉基因的腺病毒載體(ADV),在mdx小鼠模型中直接比較Utrophin和Dystrophin基因轉移對肌營養不良功能的影響。在免疫功能較低的新生動物中,ADV-Dystrophin和ADV-Utrophin都改善了脛骨前肌的組織結構、收縮能力和肌肉抗損傷能力。然而,只有ADV-Utrophin能夠明顯改善免疫功能較強的成熟mdx動物肌肉收縮能力和抗損傷能力。此外,在免疫功能較強的成熟mdx小鼠中,與Dystrophin基因轉移相比,Utrophin不僅具有顯著的轉基因持久性,還能夠減少炎癥發生率。Odom等[18]使用rAAV-6型病毒包裝micro-Utrophin(△R4-R21,圖1)在小鼠模型中具有很高的功能性,表明micro-Utrophin可以改變DMD的進程,使其更接近于非常輕微的BMD表型。
Song等[19]構建micro-Utrophin基因AAV載體,然后在新生mdx小鼠、金毛犬肌營養不良癥(GRMD)幼犬和成年德國短毛犬肌營養不良癥(GSHPMD)犬中進行研究。發現AAV介導的micro-Utrophin表達可以預防新生mdx小鼠的肌肉疾病,避免新生GRMD犬的免疫反應,減輕病理損傷。一項免疫原性測試中,對2只7歲的GSHPMD狗進行了并排比較。一側脛骨肌接受micro-Utrophin載體(2.0×1012vector genome(vg)/kg),對側肌肉注射等量的micro-Dystrophin蛋白載體。注射肌肉4周后進行活檢。經H&E染色后,micro-Dystrophin蛋白處理后肌營養不良癥狀比較嚴重。與之形成鮮明對比的是,micro-Utrophin處理的肌肉中肌營養不良癥狀明顯減弱。免疫組化染色顯示micro-Utrophin蛋白表達旺盛,而micro-Dystrophin表達不旺盛。Dystrophin蛋白處理的肌肉中檢測到大量的CD3+和CD8+T細胞,而Utrophin處理的肌肉中未檢測到。
以上研究表明,與Dystrophin高度同源的Utrophin蛋白能夠替代Dystrophin蛋白行使一定功能,緩解肌營養不良的癥狀。但DMD患者因為缺失DMD基因,大多不同程度缺失或無完整Dystrophin蛋白,因此會對外源Dystrophin蛋白發生免疫反應[20-21]。在這種情況下,Utrophin蛋白作為Dystrophin蛋白基因轉移的替代物可能具有顯著的治療優勢。
3 表達載體的構建
臨床基因治療方案最早是針對造血系統疾病。在體外經過基因轉導糾正的細胞回輸到患者體內以獲得治療。原則上,可以認為DMD患者的成肌細胞也可以在體外分離和處理。將糾正后的成肌細胞移植到患者肌肉中,以期恢復正常的肌肉功能。由于成肌細胞在發展為肌細胞之前可以大量增殖,單個成肌細胞或肌源性干細胞便可以糾正大量肌肉組織。但來自DMD患者自身成肌細胞的復制能力很低,極大地限制了體外細胞的培養、糾正和再轉移的可能性。異源成肌細胞移植可以將正常的DMD基因帶入體內,但收效甚微。且異源成肌細胞受到供體細胞免疫排斥和大規模體外培養后發展為肌細胞潛能喪失的限制。因此,利用表達載體的構建直接向組織或細胞遞送目的基因,就能夠克服體外基因轉導復制率低和異源成肌細胞移植免疫排斥的問題。
只有少數已知的病毒載體,包括腺病毒(Adenovirus)和皰疹病毒(Herpesviruses),能夠攜帶長達14 kb的Dystrophin cDNA和一個啟動子。但這類病毒復制能力低、缺乏安全性,因此不被作為載體選用。AAV載體的攜帶能力為5 kb,不能包裝14 kb的Dystrophin cDNA。在轉基因小鼠中進行的研究表明,高度功能性的短序列肌營養不良蛋白基因可以小于4 kb[22]。直接肌肉注射AAV載體可在肌肉中產生高水平和持續的基因轉移。但肌肉注射只能局部感染一小塊肌肉,無法全身系統性傳遞。并且肌肉注射往往會引發更多的炎癥,比血管輸送方法更易誘發T細胞免疫反應。Gregorevic等[23]使用AAV-6型載體包裝目的基因注入血管,在提高外周微血管的急性通透性下,高劑量病毒載體[1014(vg)/kg]可以轉染所有成年老鼠的骨骼肌。單次靜脈注射AAV-6、AAV-8和AAV-9可轉染嚙齒動物和大型哺乳動物全身肌肉[24-25]。這些理想的特征促進了AAV作為肌肉基因治療載體的發展。
在不同AAV載體轉染效率的研究中,AAV-8在小鼠中肌肉轉導效率較高,AAV-rh74顯示了肝臟偏好,AAV-9顯示了心臟偏向性[26-27]。在正常和受影響的狗中所進行的幾項研究中測試了高劑量的全身AAV-8和AAV-9給藥。研究表明,AAV介導傳遞的基因存在于身體的所有肌肉中,但肝臟的含量最高[28-29]。AAV-9在小鼠中具有心臟偏向性的,在犬中傳導心臟的效率要低得多[30]。重組腺相關病毒(rAAV)具有安全性高、免疫原性低、宿主范圍廣、能介導外源基因在動物體內長期穩定表達等特點[31],成為基因治療領域最具應用前景的載體之一。
4 大型動物實驗和臨床治療研究
由于對小鼠的研究已較為成功并顯示出重要的前景,載體介導DMD基因治療研究轉向了對更大的犬類DMD模型。DMD犬類模型不僅可以評估基因治療后肌肉伸縮性,還可以對表達載體的潛在免疫反應進行更靈敏的測試。Yue等[32]在幼年DMD犬短暫或持續的免疫抑制下,對3只2個月大的狗進行AAV-9型病毒載體攜帶micro-Utrophin基因(1.92~6.24×1014vg/kg)的靜脈注射。DMD犬對注射耐受良好,未觀察到不良反應。在骨骼肌、膈肌和心臟中觀察到廣泛的蛋白表達并存在肌肉組織學的改善。證明了AAV載體介導DMD基因治療在幼年DMD大型哺乳動物中是安全有效的。
Le Guiner等[33]在共12只金毛獵犬肌營養不良癥(GRMD)犬上進行研究。使用rAAV-2型和rAAV-8型載體攜帶Micro-Dystrophin表達基因轉染GRMD局部和全身肌肉的治療效果是有效的。局部轉染肢體肌肉組織誘導高水平的Dystrophin蛋白表達,并顯著改善肌肉收縮能力。全身靜脈給藥后未發現明顯不良免疫后果,并有效減輕肌營養不良癥狀。以上研究表明,選擇合適病毒載體(特別是可選擇的病毒衣殼血清型)加上免疫系統中不活躍的短序列肌營養不良蛋白在血管傳遞系統下進入DMD患者體內有望實現治愈。
Mendell等[34-35]開展了載體介導短序列肌營養不良蛋白(△3990,圖1)的臨床合作研究,共涉及6例DMD患者。但沒有患者表現出顯著水平的Micro-Dystrophin蛋白表達。6例患者中,2例對肌營養不良蛋白表現出較低水平的T細胞免疫應答,另1例對AAV載體表現出明顯的T細胞應答。
2017年12月發表的一篇文章為載體介導基因治療提供了原則證明。Mendell等[36]使用單次靜脈注射AAV-9載體攜帶目的基因[劑量2×1014(vg)/kg]治療了患有1型脊髓性肌萎縮癥(Spinal muscular atrophy type 1,SMA1)的嬰兒。美國又陸續開始了3項獨立的AAV介導DMD患者基因治療試驗,分別是 Solid Biosciences (NCT03368742)、Pfizer (NCT03362502)和Nationwide Children′s Hospital (NCT03375164)。此3項臨床試驗分別采取mDys-5R[37]、△3990[38]、△R4-R23/△C[13]3種micro-Dystrophin構型(圖1)。Genethon and Sarepta Therapeutics也計劃在歐洲開展臨床試驗。
5 未來前景思考
人體對病毒載體的免疫是一個重要問題。在沒有某種形式的短暫免疫抑制的情況下,高劑量的AAV載體可誘導產生抗體,從而阻礙了使用第二劑病毒載體的能力[39-40]。如果動物研究的結果能很好地應用于人類,那么就有可能從單一劑量中獲得足夠水平的肌營養不良蛋白來糾正所有的肌細胞。
另一個困難是如何測量遍布全身的肌營養不良蛋白的表達和分布。目前,測量肌營養不良蛋白表達的唯一直接方法是對肌肉進行活檢分析。由于活檢對測試者肌肉有侵入性,并且從患者身上獲得的樣本量很少,這就限制了在長時間內對多個肌肉組織細胞或整塊肌肉中目的基因表達效果的追蹤。因此,開發可以無創監測的血清生物標志物,以及使用磁共振成像(MRI)等成像技術來跟蹤肌肉結構的發展其有良好前景[41-44]。最清晰的獲益指標也可以來自功能測量,其中許多已被開發用于其他DMD試驗,如6分鐘步行試驗等[45]。
雖然動物實驗顯示載體介導DMD基因治療安全有效,但能否改善人類的肌肉病變、病變改善所需時間、治療效果的持續時間及人類能否耐受高劑量病毒載體傳遞等問題等均不明確。年齡和疾病進展對轉導效率是否有影響?T細胞和/或B細胞的免疫反應是針對肌營養不良蛋白還是載體衣殼蛋白?數年后,當抗營養不良蛋白的表達低于治療所需的閾值時,能否重新對載體進行調節?這都需要進一步研究。
6 結論
利用載體介導DMD基因治療最初在mdx小鼠中開發的方法被證明是安全的,并且在小鼠的壽命中很大程度上消除了肌營養不良的病理生理學問題。在針對DMD的犬類模型中也觀察到了類似的結果,而且AAV載體已被證明在針對其他遺傳疾病的非人類靈長類動物研究和臨床試驗中是安全的。載體介導基因具有巨大的治療潛力,因為它能夠解決DMD和BMD患者不能產生正常肌營養不良蛋白的根本問題。

