熒光定量PCR用于hTRIMCyPA抑制HIV-1的研究①
吉夢夢 孟祥平 馮小倩 徐欣欣 張玉清 秦 宇
(河南科技大學醫學技術與工程學院,洛陽 471000)
HIV-1是反轉錄病毒科慢病毒屬成員,它的基因組是雙正鏈 RNA,主要侵犯人體的CD4+T淋巴細胞和巨噬細胞。當HIV-1進入宿主細胞后,其正鏈RNA開始反轉錄合成雙鏈DNA。HIV-1 反轉錄的過程一般包括以下步驟:①負鏈強終止DNA(-sssDNA)的合成;②長負鏈DNA的合成;③正鏈強終止DNA(+sssDNA)的合成;④完整的雙鏈DNA合成[1]。最后合成的完整DNA兩端含有LTR序列,又叫HIV-1晚期反轉錄產物(HIV-1 late RT),因此在檢測反轉錄過程完整的 DNA雙鏈時,應當檢測 LTR/Gag序列[2]。反轉錄過程是HIV-1病毒復制的關鍵環節,已成為研發抗HIV-1藥物的重要靶點[3]。恒河猴TRIM5α屬于三重基序蛋白(tripartite motif protein,TRIM)大家族的成員,通過多種機制抑制HIV-1,而人的TRIM5α作用較弱[4-8]。將人TRIM5α中結合衣殼蛋白的B30.2(SPRY)結構域用同樣結合衣殼蛋白的親環素A(CyPA)代替,構建人源的hTRIMCyPA以避免異種蛋白的免疫排斥反應。因此推測hTRIMCyPA也能特異識別并結合HIV-1衣殼蛋白,并影響衣殼蛋白的脫殼,抑制病毒的RNA反轉錄成DNA[4-5]。雖然臨床有效的抗反轉錄病毒治療(HAART)提高了艾滋病的臨床療效,但因HIV-1的高度變異性和潛伏感染,存在藥物療效不佳和毒副作用大的問題[9-10]。因此,本研究采用假病毒系統建立一種可分析感染細胞內病毒生命周期早期特異性DNA 產物的相對熒光定量 PCR技術,并以其評價hTRIMCyPA對HIV-1的抑制作用。這對于未來抗HIV-1相關病毒新藥的研發具有重要的意義。
1 材料與方法
1.1材料 蛋白酶K、DNase Ⅰ購自Sigma公司;SYBR Green Master Mix(Low Rox)購自上海翊圣生物科技有限公司;EZTrans細胞轉染試劑購自上海李記生物;熒光素酶檢測試劑盒購自碧云天生物技術公司;兔抗GFP和內參GAPDH多克隆抗體購自上海生工生物公司;hTRIMCyPA基因表達質粒hTRIMCyPA/pcDNA3.1EGFP由本實驗室構建,pNL4-3LucR-E-由徐建青教授惠贈,HEK293細胞、HEK293t細胞、pMD2.G、pcDNA3.1和pcDNA3.1EGFP載體由本實驗室保存。
1.2方法
1.2.1PCR引物的設計與合成 引物由premier5.0軟件設計,由上海生工生物公司合成。HIV-1晚期反轉錄產物基因引物的設計:參考 pNL4-3LucR-E-的序列,選擇HIV-1的LTR區和HIV-1Gag之間的序列設計晚期反轉錄產物引物,設計合成引物如下:LTRGag F:5′-TGTGTGCCCGTCTGTTGTGT-3′,R:5′-GAGTCCTGCGTCGAGAGATC-3′。作為內參基因的GAPDH基因引物如下:GAPDH F:5′-CAAGGCTGTGGGCAAGGTC-3′,R:5′-TGGAGGAGTGGGTGTCGCT-3′。
1.2.2HIV-1假病毒包裝 在包裝的前一天進行鋪板,待HEK293T細胞生長至約80%匯合度時,將質粒pMD2.G和pNL4-3LucR-E-以1∶3的比例聯合轉染到細胞中,轉染按照 EZTrans細胞轉染試劑說明書操作進行。轉染6 h后換液,48 h和72 h各收集全部上清,800 g離心5 min以去除細胞碎片,用0.45 μm的濾器過濾,分裝后保存備用。
1.2.3hTRIMCyPA的表達及Western blot鑒定 將hTRIMCyPA/pcDNA3.1EGFP及pcDNA3.1轉染HEK293細胞,第二天在熒光顯微鏡下觀察hTRIMCyPA的表達,48 h后,吸去培養液,用1 ml預冷的PBS洗1次,吸去 PBS,再用碧云天的IP及Western細胞裂解液(含1 mmol/L PMSF)裂解并收獲細胞,蛋白樣品經12%SDS-PAGE后,轉移至PVDF 膜,封閉后,5%脫脂牛奶封閉1 h后,分別加入Anti-EGFP 及內參GAPDH多抗4℃孵育過夜,洗膜后加入偶聯HRP的羊抗兔二抗,室溫孵育2 h,洗膜后進行ECL顯色。
1.2.4假病毒感染實驗 將1.2.3轉染hTRIMCyPA/pcDNA3.1EGFP及pcDNA3.1的細胞作為感染靶細胞,每組3個復孔。轉染前棄去培養基,每孔加入500 μl含2 ng p24 的假病毒,假病毒事先在37℃下10 mmol/L MgCl2中的用DNase Ⅰ(20 U/ml)預處理病毒1 h以除去殘存的質粒DNA。為提高感染效率,加入1 μg/ml的polybrene。6 h后,用PBS洗3次以去除殘留未感染的假病毒。再繼續培養至48 h,使用熒光素酶檢測試劑盒檢測熒光素酶活性以確認是否感染成功。
1.2.5細胞中總DNA的提取1.2.4操作至用 PBS 洗3 次去除殘留未感染的假病毒后,在24孔板中直接加入600 μl細胞裂解液(1.5 mmol/L pH8.0 Tris-HCl,50 mmol/L KCl,1.5 mmol/L MgCl2,0.45%Np-40,0.45%Tween20)充分裂解,混勻后加入蛋白酶K(終濃度為100 μg/ml),55℃過夜或57℃ 3 h,95℃15 min水浴滅活蛋白酶K,4℃,12 000 g 離心5 min取上清作為待測樣品。
1.2.6SYBR Green Ⅰ熒光定量PCR方法建立 按照SYBR Green Ⅰ熒光PCR試劑盒說明書操作,20 μl反應體系:2×SYBR Green Ⅰ Mixture 10.0 μl,10 μmol/L Forward Primer 0.4 μl,10 μmol/L Reverse Primer 0.4 μl,Template DNA 1 μl,加ddH2O至20 μl。循環條件:95℃ 5 min;95℃ 10 s;58℃ 40 s,40個循環;58℃ 1 min退火階段采集熒光信號。繪制標準曲線:取hTRIMCyPA組所提取的基因組DNA進行2倍梯度稀釋,做7個梯度,分別用內參引物和目的基因引物進行擴增。儀器自動繪制出對應于內參基因和目的基因的標準曲線。所有試驗樣品均設3次重復。采用 2-ΔΔCt計算HIV-1反轉錄產物的相對表達量,用內參基因校準目的基因表達。
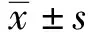
2 結果
2.1hTRIMCyPA的表達及Western blot鑒定 將hTRIMCyPA/pcDNA3.1EGFP和pcDNA3.1空載體質粒用EZTrans細胞轉染試劑轉染HEK293細胞。第二天用熒光顯微鏡觀察綠色熒光蛋白表達情況,發現轉染hTRIMCyPA孔出現明顯的綠色熒光(見圖1B),而對照孔沒有綠色熒光表達(見圖1A)。hTRIMCyPA與載體中的EGFP融合,因此可以判斷hTRIMCyPA表達成功。為進一步確定該蛋白的表達,將hTRIMCyPA/pcDNA3.1EGFP或pcDNA3.1空載體質粒轉染試劑轉染HEK293細胞,48 h后裂解細胞進行Western blot檢測,由于hTRIMCyPA與EGFP融合,因而hTRIMCyPA對應的孔出現條帶而空載體組及空白細胞對照組均沒有條帶(見圖2),進一步說明hTRIMCyPA成功表達。

圖1 hTRIMCyPA表達的熒光顯微鏡檢測

圖2 hTRIMCyPA的Western blot鑒定圖
2.2假病毒感染 熒光素酶檢測試劑盒檢測熒光素酶活性,結果發現轉染后2組的熒光素酶活性明顯高于空白細胞對照組。hTRIMCyPA組的熒光素酶活性低于空載體組轉染組(見圖3),說明HIV-1 假病毒顆粒感染成功,并且hTRIMCyPA具有抑制HIV-1的作用。

圖3 假病毒感染HEK293細胞后的熒光素酶活性分析
2.3熒光定量PCR檢測體系的建立 在QuantStu-dio 3 型熒光實時PCR檢測儀上結束擴增后,由系統軟件分析,以初始模板的對數為x軸,以Ct值為y軸作回歸曲線,自動生成標準曲線。其中HIV-1 late RT標準曲線(見圖4A)的相關系數R2為0.992 9。斜率為-3.381,標準曲線回歸方程為:y=-3.381x+27.208。內參GAPDH標準曲線(見圖4B)相關系數R2為0.993 7。斜率為-3.289,標準曲線回歸方程為:y=-3.289x+25.307。二者的斜率相差低于0.1,表明二者擴增效率一致,可用于接下來的相對定量分析。相關系數R2>0.99,表明兩標準曲線線性較好,能夠準確定量。

圖4 HIV-1 late RT 和 GAPDH 基因標準曲線
2.4各樣品相對定量分析結果 利用本試驗建立的SYBR GreenⅠ熒光定量 PCR方法對假病毒感染的hTRIMCyPA表達的樣本組的抑制效果見圖5。可見hTRIMCyPA組HIV-1相對late RT量明顯少于空載體組,有統計學意義。

圖5 HIV-1假病毒感染后各組HIV-1 late RT產物的相對量
3 討論
熒光定量PCR克服了常規 PCR 只能定性不能定量的技術難題,其包括絕對和相對兩種定量方法。絕對定量法需要克隆相關的基因以構建相應表達載體作為標準品用于構建標準曲線,并且每次試驗均要制作標準曲線,增加了實驗的復雜度。本研究以 SYBR GreenⅠ作為熒光標記物,不需要設計昂貴的探針,因而成本相對較低。為了驗證目的基因和內參基因擴增的Ct值與拷貝數的相關性,本研究建立了各自標準曲線加以驗證。在實時定量中,只要將待測樣品中的任何一個作為 “相對標準品”,系列稀釋后用于構建標準曲線,即可獲得斜率并驗證方法的可行性[11-12]。這無疑降低了實驗的工作量和復雜性。
本研究所設計的HIV-1 late RT引物,上游處于LTR序列,下游處于Gag前端,擴增出LTR/Gag序列代表連續完整的HIV-1序列。若把引物設計在Gag或Luc等部位,擴增出來的片段不能夠代表完整片段,很可能包含一些中間片段,部分是中間合成的長負鏈 DNA產物。本次研究也曾用Gag或Luc等部位設計的引物進行擴增,發現其PCR產物的量明顯大于LTR/Gag引物擴增的量,原因是這個引物擴增的產物含有很多不完整片段,因而不能真正反映完整HIV-1反轉錄產物量,也不能代表HIV前病毒量[2,13]。據報道,ZACK等[14]利用 PCR檢測受激和靜息狀態人類T淋巴細胞中 HIV-1的反轉錄過程時,發現R/U5序列、U3序列和U3/R/U5-PBS之間序列所擴增出的代表初始反轉錄片段產物數量幾乎相同,但受激T細胞中LTR和Gag之間擴增出的代表完整 DNA片段數量明顯多于靜息細胞,所以選擇擴增的LTR/Gag連續序列,能夠比較真實地反映HIV-1的反轉錄情況及病毒活性。
對于HIV-1DNA的提取一般參考基因組的提取方法,一般采用帶有DNA吸附柱的試劑盒提取或酚/氯仿抽提DNA法提取[15-16]。這2種方法一般要經過多次轉管和離心沉淀,但是HIV-1轉錄后不會馬上整合到龐大而復雜的染色體上,有一部分最先還是些非整合的線形或環狀雙鏈DNA分子,通常稱為赫特(Hirt)DNA,因此有特定的提取方法[17-18]。在經過多次轉管和離心沉淀后,這些散在的DNA可能并不一定和染色體基因組同比例的丟失,因而容易造成DNA得率較低以及實驗的重復性差。而直接用細胞裂解液處理后直接PCR在一定程度上能避免這個問題,同時也降低了實驗的工作量。目前直接PCR已經在基因組的PCR擴增中得到了廣泛的應用,與用試劑盒提取以及其他方法相比,無論是擴增質量還是效率等都具有明顯的優勢[19-20]。
本研究所用的pNL4-3LucR-E-HIV-1假病毒載體,因其基因序列中的膜蛋白基因被失活,需要與膜蛋白基因質粒共轉染才能包裝出子代假病毒,由此包裝的假病毒由于僅具有單次感染能力而十分安全;另外,由同一外源質粒表達所提供的膜蛋白可產生均一的假病毒顆粒,因而實驗的可重復性得到保證,這樣就避免了HIV-1活病毒反復傳代變異而導致的重復性差的問題[21]。有研究報道,用假病毒來進行藥物篩選與同時用活病毒篩選結果一致,從而大大提高了藥物篩選的通量和安全性[22-23]。利用本研究建立的方法已經成功篩選了多個抗病毒藥,并對其機制進行了研究。因而本研究建立的測定HIV-1特異性反轉錄產物的熒光定量PCR的方法具有簡單、高效和成本低廉等優點,可用于抗病毒藥物機制研究和藥物篩選。
致謝:感謝河南科技大學大學醫學技術與工程學院段萬理、張克蘭和秦怡帆同學,河南科技大學大學醫學院馬甜和余馮同學在實驗過程中給予的幫助。

