程序性細胞死亡受體1及其配體抑制劑在肝細胞癌治療中的應用進展
王昭月, 魏 來, 黃 緣
1 清華大學附屬北京清華長庚醫院 肝膽胰中心 肝膽內科,清華大學臨床醫學院, 北京 102218;
2 清華大學附屬北京清華長庚醫院 肝膽胰中心, 清華大學臨床醫學院, 北京 102218
原發性肝癌目前是我國第4位常見惡性腫瘤及第2位腫瘤致死病因,肝細胞癌(HCC)是原發性肝癌中最常見的病理類型,占85%~90%[1]。本文中所講的“肝癌”特指HCC。肝癌缺乏特異性癥狀,早期診斷困難,超過一半的患者初診時已經處于進展期,需要行全身系統治療。既往靶向治療和系統化療是進展期HCC的主要治療方法,療效有限。近年來,免疫治療發展迅速,在肝癌中也展開應用。
免疫系統對腫瘤細胞具有清除作用。腫瘤免疫主要由T淋巴細胞介導,腫瘤細胞逃避免疫監視有多種途徑,包括無效的腫瘤抗原遞呈、免疫抑制細胞聚集、免疫抑制因子釋放,以及免疫檢查點的失調。調控T淋巴細胞激活或抑制的信號通路稱為免疫檢查點,目前研究最多的包括細胞毒性T淋巴細胞相關抗原4(cytotoxic T lymphocyte associated antigen 4, CTLA-4)通路和程序性細胞死亡受體1(programmed death-1, PD-1)通路。PD-1是一種Ⅰ型跨膜蛋白,主要表達于活化的T淋巴細胞、B淋巴細胞、自然殺傷細胞等,其配體包括PD-L1(programmed death ligand 1, PD-L1)和PD-L2。PD-1與配體結合后,可抑制T淋巴細胞活性,誘導抗原耐受,促進T淋巴細胞凋亡,從而抑制或終止免疫應答,防止自身免疫疾病的發生。腫瘤細胞可以表達PD-L1,與T淋巴細胞表面的PD-1結合后,抑制T淋巴細胞的殺傷功能,還可以抑制細胞因子如IL-2、IFNγ的產生,導致腫瘤免疫逃逸,促進腫瘤生長[2]。因此,應用特異性單克隆抗體阻斷PD-1和PD-L1的結合,可增強T淋巴細胞的增殖和殺傷功能,發揮抗腫瘤作用。
PD-1或PD-L1抑制劑已廣泛用于多種惡性腫瘤的治療,在肝癌中也開展了多項臨床試驗,并逐步被指南推薦為系統治療的一線或二線方案。巴塞羅那分期(BCLC)是目前最常用的肝癌分期標準,免疫治療主要在無法切除的肝癌(unresectable HCC, uHCC)患者中進行,包括BCLC C期的進展期肝癌(advanced HCC, aHCC)和部分BCLC B期但經介入治療后進展的患者。本文就PD-1/PD-L1抑制劑在HCC中應用的臨床研究進展作一綜述。
1 PD-1/PD-L1抑制劑單藥治療
PD-1或PD-L1抑制劑單藥治療aHCC在全球范圍開展了多項臨床試驗(表1),驗證了其有效性和安全性,并逐步被多個指南推薦為系統治療藥物。

表1 PD-1/PD-L1抑制劑單藥治療在aHCC中的臨床試驗
1.1 納武利尤單抗(Nivolumab) Nivolumab是抗PD-1的全人源化IgG4型單克隆抗體。CheckMate 040是Nivolumab在aHCC中開展的Ⅰ/Ⅱ期、多隊列研究[3]。隊列1和隊列2是Nivolumab的ESC與EXP試驗,共262例患者。ESC隊列(Nivolumab 0.1/0.3/1/3/10 mg/kg,靜脈點滴,每2周一次)納入48例,結果顯示TRAEs的發生率與藥物使用劑量無關。1例患者因藥物相關毒性而停藥,3例患者因TRAEs而停藥,沒有治療相關死亡發生。常見的TRAEs(發生率>10%)包括AST、ALT、脂肪酶、淀粉酶的升高,以及皮疹和瘙癢。12例(25%)出現3~4級TRAEs,3例(6%)發生治療相關嚴重不良事件(serious adverse events, SAEs)。療效方面,大部分患者在3個月內出現應答,ORR為15%,DCR為58%,mOS為15.0個月。EXP隊列(Nivolumab 3 mg/kg,靜脈點滴,每2周一次)納入214例,ORR為20%,DCR為64%,mPFS為4個月,mOS未達到。安全性方面,8例患者因藥物毒性而停藥,24例患者因TRAEs而停藥,沒有治療相關死亡發生。
262例患者中,索拉非尼(Sorafenib)初治80例,Sorafenib經治182例[4]。Nivolumab作為一線治療,ORR為20%,mOS為28.6個月,治療有效率和長期生存均有明顯改善;作為二線治療,在ESC組和EXP組中,ORR分別為19%和14%,mOS分別為15.0和15.6個月。在Sorafenib經治的182例患者(ITT隊列)中,來自亞洲的有85例[5],亞洲隊列患者HBV感染、遠處轉移和既往接受過治療的比例更高,對我國更具參考意義。ITT隊列和亞洲隊列的ORR分別為14%和15%,mOS分別為15.1和14.9個月。
CheckMate 040第5隊列研究了Nivolumab用于Child-Pugh B級的aHCC[6]。49例患者ORR為10.2%,mOS為7.6個月。安全性方面與Child-Pugh A級患者相類似。另一回顧性病例分析[7]中,18例Child-Pugh B級aHCC患者應用Nivolumab,17例發生3級以上AEs,5例發生3級以上TRAEs,4例患者因TRAEs而停藥,ORR為17%,mOS為5.9個月。Nivolumab用于Child-Pugh B級患者需要謹慎,并有待更多循證學證據。
CheckMate 459是對比Nivolumab與Sorafenib用于一線治療aHCC的Ⅲ期臨床試驗(Nivolumab 240 mg,靜脈點滴,每2周一次;Sorafenib 400 mg,口服,2次/d),在2019年歐洲腫瘤內科學會(ESMO)年會上公布了結果[8]。Nivolumab組(371例)與Sorafenib組(372例)mOS分別為16.4和14.7個月(HR=0.85,95%CI:0.72~1.02,P=0.075 2), 未達到統計意義的預定閾值,兩組ORR分別為15%和7%。不同于CheckMate 040中Nivolumab作為一線用藥的良好結果,該Ⅲ期臨床試驗沒有達到預期的主要研究終點(OS),但與Sorafenib相比,Nivolumab的療效確實有所提高。
基于CheckMate 040的結果,2017年9月Nivolumab獲得美國食品藥品管理局(FDA)快速批準作為二線方案用于既往Sorafenib治療后進展或無法耐受的肝癌患者。2018年中國臨床腫瘤學會頒布的原發性肝癌診療指南[9]中將Nivolumab作為晚期HCC的二線治療。由于CheckMate 459的失敗,Nivolumab仍被推薦作為二線方案,但由于其表現出較好的生存獲益和安全性,在2020年美國國立綜合癌癥網絡(NCCN)指南[10]中指出,當不能應用酪氨酸激酶抑制劑或其他抗血管生成藥時,推薦Nivolumab作為一線用藥,而且Nivolumab作為二線用藥時適應證也包含了Child-Pugh B級患者。
1.2 帕博利珠單抗(Pembrolizumab) Pembrolizumab是抗PD-1的人源化IgG4型單克隆抗體。KEYNOTE-224是評估Pembrolizumab二線治療aHCC的Ⅱ期臨床試驗(Pembrolizumab 200 mg,靜脈點滴,每3周一次)[11]。納入104例患者,中位隨訪時間12.3個月,ORR為17%,mPFS為4.9個月,mOS為12.9個月。3級TRAEs有25例(24%),最常見AST升高、ALT升高、疲勞和腎上腺功能不全,4級TRAEs有1例(高膽紅素血癥),治療相關死亡1例(潰瘍性食管炎)。15例(14%)發生免疫相關不良事件(immune-related AEs, irAEs),3例(3%)發生免疫相關肝炎,沒有觀察到HBV或HCV的活化。最新發布的KEYNOTE-224隨訪2年后的數據[12]顯示,24個月總生存率為30.8%,ORR從17%提高到18.3%。
KEYNOTE-240是Pembrolizumab(200 mg,靜脈點滴,每3周一次)對比安慰劑用于aHCC二線治療的Ⅲ期臨床試驗[13]。Pembrolizumab組(278例)和安慰劑(135例)組mOS分別為13.9和10.6個月,mPFS分別為3.0和2.8個月,ORR分別為18.3%和4.4%。試驗結果未達到預設的統計學終點,研究結果為陰性。在Pembrolizumab組和安慰劑組,3級以上TRAEs分別占18.3%和7.5%。irAEs在Pembrolizumab組比例較高(18.3% vs 8.2%),常見甲狀腺功能減退、甲狀腺功能亢進和肺炎。
基于KEYNOTE-224研究,2018年11月美國FDA批準Pembrolizumab作為二線治療用于既往接受過Sorafenib治療的aHCC患者。由于KEYNOTE-240的失敗,NCCN在2019年第2版肝膽腫瘤指南[14]中將Pembrolizumab用于aHCC二線治療的證據類別從2A改為2B。Pembrolizumab在亞洲人群中的Ⅲ期臨床試驗KEYNOTE-394正在進行,以期再次驗證其療效。
1.3 卡瑞利珠單抗(Camrelizumab) Camrelizumab(SHR-1210)也是抗PD-1的人源化IgG4型單克隆抗體,在我國開展了二線治療aHCC的Ⅱ期臨床試驗(SHR-1201 3 mg/kg,靜脈點滴,每2周或3周一次)[15]。該研究中HBV感染的患者比例較高(83%)。217例患者ORR為14.7%,mPFS為2.1個月,mOS為13.8個月。研究中發現,有少部分患者出現治療后腫瘤病灶先增大后縮小的情況。所有級別中最常見的TRAEs為反應性皮膚毛細血管增生癥(67%)、AST升高(25%)、ALT升高(24%)和蛋白尿(23%)。發生反應性皮膚毛細血管增生癥的患者絕大多數見于體表皮膚,無內臟出血或死亡發生,且客觀緩解比例更高(ORR 19.3% vs 5.6%)。發生3~4級TRAEs者占22%。46例發生HBV DNA水平升高,但沒有患者因此中斷或終止治療。
1.4 度伐利尤單抗(Durvalumab) Durvalumab是抗PD-L1的人源化IgG1型單克隆抗體。2017年美國臨床腫瘤學會(ASCO)公布了Durvalumab單藥治療實體腫瘤的Ⅰ/Ⅱ期臨床試驗[16]中肝癌患者的中期分析結果:40例HCC患者接受Durvalumab單藥治療(10 mg/kg,靜脈點滴,每2周一次),其中93%患者既往應用過Sorafenib。TRAEs發生率80%,最常見為疲勞、瘙癢和AST升高,20%患者出現3~4級TRAEs,無TRAEs所致停藥或死亡。40例患者mOS為13.2個月,39例可評估療效,ORR為10.3%,DCR為33.3%。
2 PD-1/PD-L1抑制劑聯合治療
治療HCC的不同藥物抗腫瘤的機制不同,可能具有潛在的協同作用。系統化療可暴露腫瘤抗原,更好地被免疫系統識別;靶向藥物可減少免疫抑制性細胞數量、誘導活化的細胞毒性T淋巴細胞;抗血管生成藥有助于腫瘤血管的正常化,重塑腫瘤微環境。免疫治療與其他治療機制的藥物聯合,或者兩種不同機制作用通路的免疫治療聯合,是目前研究的主要方向[17-18](表2)。
2.1 與分子靶向藥物聯合 KEYNOTE-524/Study 116是Pembrolizumab聯合侖伐替尼(Lenvatinib)一線治療uHCC的Ⅰb期臨床試驗[Lenvatinib 12 mg(≥60 kg)或8 mg(<60 kg),口服,1次/d+Pembrolizumab 200 mg,靜脈點滴,每3周一次],2020年ASCO年會公布了最新數據[19]:共納入104例患者,對100例進行分析,ORR達36%,DCR達88%,mPFS為8.6個月,mOS達到22.0個月。安全性方面,3級以上TRAEs占67%(最常見的為高血壓,占17%),3例因TRAEs死亡。初期分析提示聯合治療的有效率和生存期明顯提高,但需警惕其安全性及藥物的相互作用。Lenvatinib聯合Pembrolizumab一線治療aHCC的Ⅲ期臨床試驗LEAP-002已經啟動[20]。
Nivolumab聯合Lenvatinib用于一線治療uHCC的 Ⅰ b期臨床試驗數據(Study117)在2020年ASCO-GI大會公布[21],30例患者接受Lenvatinib+Nivolumab治療[Lenvatinib 12 mg(≥60 kg)或8 mg(<60 kg),口服,1次/d+Nivolumab 240 mg,靜脈點滴,每2周一次],ORR為76.7%,DCR為96.7%。30例均出現TRAEs,最常見的為手足綜合征(56.7%)和發音困難(53.3%)。
Camrelizumab(SHR-1210)聯合阿帕替尼(Apatinib)用于二線治療aHCC和胃癌/胃食管交界處癌的Ⅰ期臨床試驗[22]結果已公布。共納入43例患者,其中18例為肝癌(均為HBV感染)。ESC隊列的給藥方案為:Apatinib 125/250/500 mg,口服,1次/d+SHR-1210 1200 mg,靜脈點滴,每2周一次,EXP隊列中Apatinib推薦劑量為250 mg。在應用Apatinib 250 mg的33例患者中,2例因TRAEs停藥,常見的3級以上TRAEs為高血壓(15.2%)和AST升高(15.2%)。SHR-1210可能增加了部分Apatinib相關AEs的發生率,如高血壓和ALT/AST升高,但SHR-1210相關AEs并無明顯增加,最常見的反應性皮膚毛細血管增生癥發生率反而有所下降。療效方面,其中16例可評估,ORR為50%,mPFS為7.2個月,mOS未達到。

阿維魯單抗(Avelumab)為人源化抗PD-L1的IgG1單抗。VEGF Liver 100是評估Avelumab聯合阿昔替尼(Axitinib)用于初治HCC的Ⅰb期臨床試驗(Avelumab 10 mg/kg,靜脈點滴,每2周一次+Axitinib 5 mg,口服,2次/d)[23]。22例患者中,最常見的3級TRAEs為高血壓(50%)和手足綜合征(22.7%),無4~5級TRAEs發生,最常見的irAEs為甲狀腺功能減退(31.8%)和甲狀腺功能亢進(13.6%)。采用RECIST v1.1和改良的實體瘤療效評價標準(modified RECIST, mRECIST)評價ORR分別為13.6%和31.8%,mPFS分別為5.5和3.8個月,OS的數據尚不可評估。
卡博替尼(Cabozantinib)是酪氨酸激酶抑制劑,為HCC系統治療的二線藥物。COSMIC-312是評估Cabozantinib聯合Atezolizumab對比Sorafenib用于aHCC一線治療的Ⅲ期臨床研究[24],目前正在進行。
2.2 與抗血管生成抗體聯合 阿替利珠單抗(Atezolizumab)是人源化抗PD-L1的IgG1單抗,貝伐珠單抗(Bevacizumab)為抗血管生成的單抗。GO30140是研究Atezolizumab+Bevacizumab一線治療uHCC的Ⅰb期臨床試驗,2019年ESMO年會上發布了最新數據[25]。A組104例患者接受Atezolizumab+Bevacizumab聯合治療(Atezolizumab 1200 mg+Bevacizumab 15 mg/kg,靜脈點滴,每3周一次),ORR達到36%,mPFS為7.3個月,mOS為17.1個月;3~4級TRAEs有39%,5級TRAEs有3%。F組患者中,60例接受Atezolizumab+Bevacizumab聯合治療,59例接受Atezolizumab單藥治療,聯合治療相比于單藥治療可顯著改善mPFS(5.6個月 vs 3.4個月),但TRAEs發生比例亦更高。兩組中,最常見的不良反應有蛋白尿、食欲下降、疲勞、皮疹、腹瀉、高血壓和腹痛,最常見的SAEs為肺炎和骨折。
IMbrave150是Atezolizumab+Bevacizumab對比Sorafenib一線治療uHCC的Ⅲ期臨床試驗[26-27]。Atezolizumab+Bevacizumab組(336例)和Sorafenib組(165例)的mOS分別為未達到和13.2個月(HR=0.58,95%CI:0.42~0.79,P<0.001),mPFS分別為6.8和4.3個月(HR=0.59,95%CI:0.47~0.76,P<0.001),ORR分別為27.3%和11.9%,DCR分別為73.6%和55.3%。聯合治療組的有效率和生存時間均明顯延長。安全性方面,在Atezolizumab+Bevacizumab組和Sorafenib組中,3~4級TRAEs分別為36%和46%。聯合治療還可以延緩患者報告生活質量發生惡化的時間(至惡化發生的中位時間:11.2個月vs 3.6個月,HR=0.63,95%CI:0.46~0.85)。2020年2月歐洲肝病學會主辦的肝癌峰會上公布了IMbrave 150的中國亞群數據[28]。共194例中國患者(137例來自IMbrave150全球研究,57例中國擴展隊列)。中國患者中HBV感染、BCLC C期、發生血管侵犯和/或遠處轉移、AFP≥400 ng/ml的比例更高。聯合治療組(133例)比Sorafenib組(61例)的mOS、mPFS、ORR均顯著提高。
IMbrave150取得雙終點陽性結果,聯合治療組OS和PFS都顯著延長,ORR和DCR也大幅提高,提示免疫聯合療法可能成為治療aHCC的有效方法。基于此研究結果,2020年NCCN新版指南[10]中將Atezolizumab+Bevacizumab聯合治療推薦為系統治療的一線用藥。
2.3 與CTLA-4抑制劑聯合 2019年ASCO會議上,CheckMate 040第4隊列數據證實Nivolumab和伊匹單抗(Ipilimumab,CTLA-4抑制劑)聯合治療可使aHCC患者顯著獲益,且安全性可控[29-30]。148例Sorafenib經治患者隨機分為3組:A組Nivolumab 1 mg/kg+Ipilimumab 3 mg/kg,每3周一次(連續4個周期);B組Nivolumab 3 mg/kg+Ipilimumab 1 mg/kg,每3周一次(連續4個周期),隨后接受Nivolumab 240 mg,每2周一次;C組Nivolumab 3 mg/kg,每2周一次+Ipilimumab 1 mg/kg,每6周一次。截至2018年9月25日,總體ORR為31%,3組mOS分別為22.8、12.5和12.7個月。安全性方面,最常見的TRAEs為瘙癢和皮疹,3~4級TRAEs占37%,多見AST和脂肪酶升高,未觀察到因增加Ipilimumab出現新的不良反應。NCCN指南[10]在2020年將Nivolumab+Ipilimumab聯合治療納入系統治療的二線方案。
Durvalumab(D)聯合Tremelimumab(T)(CTLA-4抑制劑)用于uHCC的Ⅱ臨床試驗在2020年ASCO年會上公布結果[31]。研究共分4組,其中兩組為T+D聯合治療[T300+D組(n=75):300 mg T藥+ 1500 mg D藥1個療程后使用D藥,每4周一次;T75+D組(n=84):75 mg T藥+1500 mg D藥4個療程后使用D藥,每4周一次]。T300+D組的ORR為22.7%,mOS達18.7個月;T75+D組ORR為9.5%,mOS為11.3個月;安全性方面,兩組3~4級TRAEs分別占35.1%和24.4%,因TRAEs而停藥者分別占10.8%和6.1%。兩藥聯合對比Sorafenib用于一線治療uHCC的Ⅲ期臨床研究(HIMALAYA)正在開展中[32]。
2.4 與系統化療聯合 我國秦叔逵教授團隊[33]開展了Camrelizumab(SHR-1210)(3 mg/kg,靜脈點滴,每2周一次)聯合FOLFOX4(氟尿嘧啶+亞葉酸+奧沙利鉑)或GEMOX(吉他西濱+奧沙利鉑)全身性化療用于一線治療aHCC或膽道癌的Ⅱ期臨床研究。在34例HCC患者中,27例合并HBV感染,ORR為26.5%,DCR為79.4%,mPFS為5.5個月,mOS尚未達到。3級以上TRAEs發生率為85.3%,最常見的包括中性粒細胞減少、白細胞減少和血小板減少。
2.5 多藥聯合 Checkmate 040的另一隊列研究了Nivolumab+Cabozantinib±Ipilimumab用于aHCC的療效和安全性,在2020年ASCO-GI會議上公布結果[34]。Sorafenib初治或經治的aHCC患者隨機分為兩組:Nivolumab 240 mg,靜脈點滴,每2周一次+Cabozantinib 40 mg,口服,1次/d,或者Nivolumab 3 mg/kg,每2周一次+Ipilimumab 1 mg/kg,每6周一次+Cabozantinib 40 mg,口服,1次/d。二聯治療組(36例)和三聯治療組(35例)ORR分別為17%和26%,mPFS分別為5.5和6.8個月,mOS均未達到。安全性方面,二聯治療的TRAEs發生率低于三聯治療,兩組發生3~4級TRAEs的患者分別有15例(42%)和25例(71%),分別導致1例和7例患者停藥。
3 小結
HCC的治療已經進入免疫治療時代。目前PD-1/PD-L1抑制劑在HCC治療中已取得初步成績。綜合上述臨床試驗結果(圖1),PD-1/PD-L1抑制劑單藥治療的ORR為14%~20%,DCR為44%~64%,mOS大部分為13~17個月,mPFS為2~5個月,與標準Sorafenib或安慰劑治療相比,療效有所提高,但取得的優勢有限。部分臨床試驗未達到統計學差異,可能與對照組患者疾病進展后加用其他二線治療或者免疫治療后生存期延長相關。而在免疫聯合治療中,ORR大部分可達20%~35%,DCR可達49%~74%,mOS亦明顯延長,基本在13個月以上,最長可達22.8個月,且有許多臨床試驗尚在隨訪中,mPFS可達5~9個月。以免疫治療為主的聯合治療在HCC的臨床試驗中顯示出前所未有的療效,正在改變HCC的治療格局,是未來的重要研究方向。
在關注良好療效的同時,亦需重視免疫治療相關不良事件(圖1)。在PD-1/PD-L1抑制劑單藥治療中,3~4級TRAEs發生率為18%~29%,而在免疫聯合治療中,3~4級TRAEs發生率明顯升高,達20%~80%。兩種不同作用機制的藥物單獨不良反應,以及藥物間的相互作用,可能都導致了TRAEs發生率的增加。故如何在提高療效的同時,最大限度減少不良反應,是免疫聯合治療亟需面對的問題。對于聯合治療,合理布局免疫治療與其他藥物的用藥順序(聯合或序貫),確定哪種策略安全性更好,需要進一步的探索。
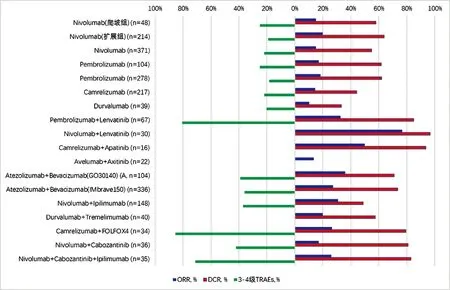
圖1 PD-1/PD-L1抑制劑單藥或聯合治療HCC的ORR、
除用于aHCC的系統治療,免疫治療在術前新輔助或術后輔助治療中也逐步開展,以期發揮更大的臨床效益。目前認為與免疫治療效果相關的生物標志物有PD-L1表達水平、高度微衛星不穩定性或錯配修復缺陷和腫瘤突變負荷等。在其他惡性腫瘤中,PD-1/PD-L1抑制劑的療效與生物標志物的相關性已得到證實,筆者也期待在HCC中早日發現合適的生物標志物,用于篩選優勢獲益人群,實現精確、個體化的治療。綜上,免疫治療有望貫穿于HCC治療的各個階段,多項臨床試驗正在進行中,將使越來越多的肝癌患者獲益。
作者貢獻聲明:王昭月負責資料分析、撰寫論文;魏來負責指導寫作思路、修改論文;黃緣負責指導撰寫文章、最后定稿。

