過表達miR-140-5p對高脂飼養誘導的非酒精性脂肪性肝病大鼠的作用及機制
盧的一 郭茂東 葉曉華
非酒精性脂肪性肝病(NAFLD)是一種常見的肝病,若不及時加以控制,易隨病程進展為肝纖維化、肝硬化,甚至肝細胞癌[1]。目前,全球約三分之一人口患有不同程度的NAFLD[2-4]。雖然通過增加運動量、控制飲食及應用法尼醇X受體(FXR)激動劑可在一定程度上抑制NAFLD進展,但仍無法起到保護肝臟的作用[5]。因此,臨床上迫切需要一種安全、有效且適用面廣的治療方式用于NAFLD的治療。已有多項研究表明,Toll樣受體4(TLR4)/核因子-κB(NF-κB)信號通路參與了NAFLD的發病及進展[6-7]。另有研究指出,miR-140-5p可靶向TLR4/NF-κB信號通路,調節炎性細胞因子水平[8-9]。目前關于miR-140-5p是否可通過調控TLR4/NF-κB信號通路參與NAFLD的發病及進展的報道較少。本研究探討了過表達miR-140-5p對NAFLD大鼠的作用及其機制與TLR4/NF-κB信號通路的關系。
1 材料與方法
1.1 實驗動物
選取44只SD大鼠,SPF級,雌雄各半,購自廣東省醫學動物實驗中心[生產許可證號:SCXK(粵)2018-0002]。44只大鼠均適應性飼養1周,控制晝夜交替頻率為12 h,期間給予充足的水和普通飼料飼養。
1.2 造模及分組
從44只SD大鼠中隨機選取34只,高脂飼料飼養12周,構建NAFLD大鼠模型[10]。飼養12周末,隨機選取4只大鼠處死,采用蘇木精-伊紅(HE)染色法判斷NAFLD大鼠模型是否構建成功。將造模成功的30只大鼠隨機分為模型組、空載體組和過表達組,每組10只。空載體組于飼養第13周、第18周尾靜脈注射含空載質粒的慢病毒,過表達組于飼養第13周、第18周尾靜脈注射含過表達miR-140-5p質粒的慢病毒。剩余10只大鼠為對照組,給予普通飼料飼養。
1.3 HE染色
在飼養第18周末,各組禁食不禁水12 h后,用2%戊巴比妥鈉麻醉大鼠,處死大鼠,取其肝臟組織,用4%多聚甲醛固定,石蠟包埋,然后使用RM2016病理組織切片機(購自上海徠卡儀器有限公司)切片。取病理切片,脫蠟,梯度乙醇水化,HE染色(試劑盒購自北京索萊寶科技有限公司),觀察肝臟組織病理學變化[11]。
1.4 肝功能及血脂相關指標的檢測
處死大鼠后,取各組大鼠心臟靜脈血5 mL,以3 500 r/min離心15 min,取上層清液。采用酶聯免疫吸附法檢測血清天冬氨酸氨基轉移酶(AST)、丙氨酸氨基轉移酶(ALT)、總膽固醇(TC)、三酰甘油(TG)、低密度脂蛋白膽固醇(LDL-C)、白細胞介素-6(IL-6)、腫瘤壞死因子-α(TNF-α)的表達水平。上述實驗所用試劑盒均購自上海碧云天生物技術有限公司。
1.5 肝組織中TLR4、NF-κB的檢測
采用蛋白質免疫印跡法檢測肝組織中TLR4、NF-κB的表達水平[12]。將RIPA裂解液滴加至盛有肝組織的容器中,提取總蛋白,并用BCA蛋白質定量檢測試劑盒(購自上海碧云天生物技術有限公司)進行定量。滴加勻漿緩沖液,4 ℃下以3 500 r/min離心15 min,取上清液;電泳100 min,漂洗3次,轉膜;分別滴加兔抗鼠TLR4單克隆抗體、兔抗鼠NF-κB單克隆抗體、β肌動蛋白(購自美國Abcam公司),4 ℃孵育過夜;滴加二抗(購自美國Abcam公司),室溫孵育2 h;曝光顯影,采用ImageJ軟件進行分析。
1.6 肝組織中miR-140-5p的檢測
采用實時熒光定量PCR法檢測肝組織中miR-140-5p的表達水平[13]。應用TRIzol試劑盒提取各組肝組織中的總RNA,然后用反轉錄試劑盒進行反轉錄反應,最后用PCR擴增儀擴增cDNA,擴增條件為94 ℃預變性10 min,之后94 ℃ 45 s,60 ℃ 45 s,72 ℃ 45 s,共40個循環。內參為β肌動蛋白。采用 2-ΔΔCt表示肝組織中miR-140-5p的相對表達量。引物序列見表1。

表1 引物序列
1.7 統計學方法
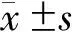
2 結果
2.1 各組肝組織病理學變化
HE染色結果顯示,對照組肝細胞排列正常,肝細胞內無脂肪堆積,無炎性細胞浸潤等情況;模型組和空載體組的肝細胞內均有大量脂肪堆積,存在明顯的炎性細胞浸潤情況,且有肝細胞壞死;過表達組有輕微脂肪堆積和少量炎性細胞浸潤,較模型組有明顯改善。具體見圖1。

圖1 各組肝組織病理圖像 HE染色 ×400 A 對照組 B 模型組 C 空載體組 D 過表達組
2.2 各組miR-140-5p的相對表達量比較
對照組、模型組、空載體組和過表達組的肝組織中miR-140-5p的相對表達量分別為1.02±0.05、0.48±0.08、0.50±0.11和2.31±0.10。與對照組比較,模型組肝組織中miR-140-5p的相對表達量降低,差異有統計學意義(P<0.05);與模型組和空載體組比較,過表達組肝組織中miR-140-5p的相對表達量升高,差異均有統計學意義(P均<0.05)。
2.3 各組肝功能及血脂水平比較
與對照組比較,模型組AST、ALT、TC、TG和LDL-C表達水平均升高,差異均有統計學意義(P均<0.05)。與模型組和空載體組比較,過表達組AST、ALT、TC、TG和LDL-C水平均降低,差異均有統計學意義(P均<0.05)。見表2。

表2 各組AST、ALT、TC、TG和LDL-C表達水平比較()
2.4 各組IL-6、TNF-α的表達水平比較
與對照組比較,模型組IL-6、TNF-α的表達水平均升高,差異均有統計學意義(P均<0.05)。與模型組和空載體組比較,過表達組IL-6、TNF-α的表達水平均降低,差異均有統計學意義(P均<0.05)。見表3。

表3 各組IL-6、TNF-α的表達水平比較()
2.5 各組肝組織中TLR4、NF-κB的相對表達量比較
與對照組比較,模型組肝組織中TLR4、NF-κB的相對表達量均升高,差異均有統計學意義(P均<0.05)。與模型組和空載體組比較,過表達組肝組織中TLR4、NF-κB的相對表達量均降低,差異均有統計學意義(P均<0.05)。見表4、圖2。

表4 各組肝組織中TLR4、NF-κB的相對表達量比較()

圖2 各組肝組織中TLR4、NF-κB的蛋白電泳圖 A 對照組 B 模型組 C 空載體組 D 過表達組
3 討論
NAFLD是一種除外過量飲酒和其他明確的損肝因素所致的,以肝臟脂質變性和脂肪過度貯積為特征的臨床綜合征[14]。研究顯示,全球NAFLD的發病率呈逐年升高趨勢,西方國家NAFLD發病率為20%~30%,近年來中國NAFLD發病率明顯升高,且有年輕化趨勢[15]。目前,有關NAFLD的病因及進展的機制尚未完全闡明,針對NAFLD的治療尚缺少直接、有效的治療方案。
微RNA(miRNA)是一種由18~25個核苷酸組成的不具備編碼蛋白質功能的RNA,具有調控細胞增殖、遷移、凋亡等多種生物學功能[16]。miR-140-5p作為miRNA中一員,已被報道可通過靶向轉化生長因子-β信號轉導通路調節脂肪細胞分化[17],還參與了肝細胞癌、結直腸癌的疾病進展過程[18-19]。本研究主要就miR-140-5p對參與NAFLD發病及進展的TLR4/NF-κB信號轉導通路的作用進行初步探究。
本研究通過HE染色法觀察各組大鼠肝組織病理學變化,發現過表達組肝細胞內脂質堆積及炎性細胞浸潤情況均較模型組和空載體組有明顯改善,提示過表達miR-140-5p對NAFLD有保護作用,可改善NAFLD肝組織病變。通過檢測各組AST、ALT、TC、TG、LDL-C的表達水平,發現過表達組AST、ALT、TC、TG、LDL-C的表達水平低于模型組,提示過表達miR-140-5p可改善高脂飼養誘導的NAFLD大鼠肝臟功能和脂質代謝紊亂狀態。有研究表明,TNF-α在NAFLD患者中高表達,且與其進展為非酒精性脂肪性肝炎密切相關;此外,TNF-α基因多態性與較高的胰島素抵抗指數關系密切,兩者相互作用參與了NAFLD的發病及進展過程[20]。IL-6不僅可促進肝組織再生,同時還可以通過誘導肝細胞凋亡和胰島素抵抗等刺激肝組織損傷,進而導致NAFLD進展為非酒精性脂肪性肝炎[20]。本研究結果表明,過表達組的IL-6、TNF-α表達水平均低于模型組,提示過表達miR-140-5p可降低高脂飼養誘導的NAFLD大鼠炎性細胞因子水平,進而發揮保護作用。
TLR4是細胞表面識別病原體的受體之一,對革蘭氏陰性菌細胞壁成分脂多糖尤為敏感。NAFLD患者腸道菌群多處于紊亂狀態,進而可產生大量的脂多糖。脂多糖可刺激TLR4表達并與之結合激活NF-κB表達,從而刺激大量炎性細胞因子合成、分泌,誘發肝臟炎性反應,致使肝細胞壞死,肝部損傷[21]。本研究結果顯示,過表達組肝組織中TLR4、NF-κB的相對表達量均低于模型組,提示過表達miR-140-5p可能通過抑制TLR4和NF-κB的表達,從而降低炎性細胞因子水平,改善肝臟炎性損傷。
綜上所述,過表達miR-140-5p可改善高脂飼養誘導的NAFLD大鼠肝臟功能,糾正其脂質代謝紊亂,減輕炎性反應,其機制可能與調控TLR4和NF-κB的表達水平有關。固醇調節元件結合蛋白-1c信號通路、腸道菌群紊亂及脂聯素的信號轉導通路等均與NAFLD發病有關,今后本課題組將進一步探究miR-140-5p對上述通路的影響,全面闡釋miR-140-5p與NAFLD的關系。

