上調脂蛋白酯酶基因對精神分裂癥大鼠的干預效果及作用機制研究
佘 意,余軍軍,呂 媛
(1.湖南省第二人民醫院精神科,中國 長沙 410007;2.湖南師范大學醫學院,分子流行病學湖南省重點實驗室,中國 長沙 410013)
精神分裂癥屬于一種較為常見的精神疾病,該病以精神活動與環境不協調為主要特征表現,患者多存在思維、知覺、情感及行為障礙,目前臨床上認為遺傳學變異、表現遺傳突變、環境因素相互作用下誘導精神分裂癥的發生,但其具體作用機制尚不完全明確[1]。研究表明,脂蛋白脂酶(LPL)為甘油三酯水解過程中的一種關鍵酶,其廣泛存在于大腦組織中的認知、記憶、學習等區域中,屬于血脂異常、冠心病、阿爾茲海默病的高危影響因素之一[2]。基于上述研究背景,本文研究上調LPL基因對精神分裂癥大鼠的干預效果及作用機制,以明確LPL基因與精神分裂癥的作用關系,為臨床應用提供參考。
1 材料與方法
1.1 材料
選取60只SPF級SD雄性大鼠,8~12周齡,購自慕恩(廣州)生物科技有限公司,動物許可證號:SYXK(粵)2020-0225,體重185~220 g,所有大鼠均在相對濕度為30%~50%、溫度為(23.8±1.5)℃的環境下預喂養7 d,每日光照12 h,分籠飼養。本研究獲我院倫理委員會批準,實驗操作嚴格按照動物實驗倫理要求相關規定進行。
主要試劑:LPL載體構建及慢病毒載體滴定由上海吉瑪公司完成;MK801購自美國Sigma公司;小鼠抗大鼠CREB抗體、兔抗大鼠p-CREB抗體、兔抗人BDNF抗體、兔抗大鼠TrkB抗體、小鼠抗大鼠p-TrkB抗體購自Cell Signaling Technology。
1.2 方法
1.2.1 LPL載體構建 使用GenBank查找序列獲得LPL基因序列,構建LPL下調轉染質粒、LPL上調轉染質粒,由上海吉瑪公司設計并合成,并做慢病毒滴度測定(病毒滴度為1×1012TU·L-1)。LPL引物序列:上游:5’-CTGTGTGGGACTTATTGAGGTGGT-3’,下游:5’-ACTGATGTAGTGTGTGGCTGTTGA-3’;LPL引物序列:上游:5’-CGCTTCTTTGCCAACATCGT-3’,下游:5’-ACACTCCATGCTGTCATCTTGA-3’。
1.2.2 分組及建模 將所選取的60只大鼠隨機分為正常組、模型組、下調組、上調組各15只,模型組、下調組、上調組大鼠參照房茂勝等[3]研究中精神分裂癥模型的建立方法構建精神分裂癥大鼠模型,取MK801,在使用前先稀釋為0.1 g·L-1的注射藥液,在恒溫狀態下水浴震蕩20 min,在每日9:00~10:00將0.3 μg·g-1的MK801注射于大鼠左或者右下側腹腔略靠近外科1/3處(左、右側每日交替),連續注射1周。正常組注射等劑量的生理鹽水。
1.2.3 LPL慢病毒載體滴定 建模成功后在下調組大鼠海馬組織注射含10 μL LPL的下調質粒慢病毒懸液,上調組大鼠海馬組織注射含10 μL LPL的上調質粒慢病毒懸液。正常組、模型組大鼠注射等量生理鹽水。7 d后觀察大鼠變化。
1.2.4 LPL慢病毒載體滴定效率鑒定 在LPL慢病毒載體滴定完成7 d后隨機取各組中3只大鼠使用5%苯巴比妥做常規腹腔注射麻醉后處死,迅速取海馬組織,采用實時熒光定量PCR法檢測LPL慢病毒載體滴定效率,提取并鑒定海馬組織總RNA含量、純度,使用Takara逆轉錄試劑盒行逆轉錄處理后獲得cDNA,采用Primer 5.0軟件設計引物序列。以U6為內參照,LPL上游序列5’-AGCTGTGCCTGTGATTGTAGCATTC-3’,下游序列:5’-AACATGTGAGTAAGGCTGCCACTAG-3’;U6上游序列5’-GCTTCGGCAGCACATATACTAAAA-3’,下游序列5’-CGCTTCACGAATTTGCGTGTCAT-3’。
1.2.5 刻板行為評分 依照Sams Dodd和Hoffman標準[4]對各組大鼠進行刻板行為評分,10 min·次-1,觀察60 min,共6次,評分標準:0分:大鼠靜止不動,無活動或者幾乎不活動;1分:大鼠正常活動,偶爾有向前的運動;2分:大鼠活動并伴隨著反復向前探索現象;3分:大鼠活動并持續向前探索;4分:大鼠存在重復旋轉、抬頭、搖頭表現;5分:大鼠出現快速搖頭、轉圈或者頭的背腹運動。
1.2.6 共計失調評分 對各組大鼠進行共濟失調評分[5],10 min·次-1,觀察60 min,共6次,評分標準:0分:大鼠協調運動;1分:大鼠存在輕度搖晃現象,搖擺運動,豎立不倒;2分:大鼠存在中度的不協調運動,偶爾跌倒;3分:大鼠無力支撐體重,爬行運動;4分:大鼠無運動,躺向一邊。
1.2.7 水迷宮試驗 采用水迷宮試驗評價大鼠平均逃避潛伏期、穿越原平臺位置次數連續測量3次,取均值。
1.2.8 樣本采集 在各組大鼠上述操作完成后,使用5%苯巴比妥做常規腹腔注射麻醉后處死,立即取海馬組織,分為均勻3等份,其中1等份做組織切片行病理組織學觀察,另外兩份在液氮中保存用于后續指標檢測。
1.2.9 病理組織學觀察 取所制備的海馬組織,固定1 d后,使用酒精脫水、二甲苯透明處理后做常規石蠟包埋,做5 μm切片,做HE染色,樹膠封片后使用光學顯微鏡觀察大鼠海馬組織病理變化。
1.2.10 Glu-DA神經遞質系統指標檢測 取1等份液氮中所保存的海馬組織,采用分光光度計檢測海馬組織中NO活性和MDA含量。采用實時熒光定量PCR法檢測海馬組織中nNOS mRNA表達量;采用HPLC-ECD法測定海馬組織中DA和Glu水平。
1.2.11 海馬組織CREB/BDNF/TrkB信號通路蛋白表達量檢測 采用Western blot法檢測大鼠海馬組織CREB/BDNF/TrkB信號通路蛋白CREB,p-CREB,BDNF,TrkB及p-TrkB表達量,取1等份液氮中所保存的海馬組織,將所制備的海馬組織做10 000×g離心處理10 min,提取上清液,BCA進行蛋白定量檢測,DAB顯色,定量分析蛋白表達情況,內參為GAPDH。
1.3 統計學處理
采用SPSS 20.0統計軟件進行處理。計量資料采用均數±標準差描述,多組間比較采用完全隨機設計方差分析,P≤0.05為差異具有統計學意義。
2 結果
2.1 LPL基因轉染效率鑒定
如表1所示,與正常組相比,模型組、下調組LPL基因表達量降低,上調組LPL基因表達量升高,差異具有統計學意義(P<0.05)。

表1 LPL基因轉染效率鑒定
2.2 各組大鼠刻板行為評分、共計失調評分、平均逃避潛伏期、穿越原平臺位置次數比較
如表2所示,與正常組相比,模型組、下調組、上調組刻板行為評分、共計失調評分、平均逃避潛伏期升高,穿越原平臺位置次數降低,差異具有統計學意義(P<0.05);與模型組、下調組相比,上調組刻板行為評分、共計失調評分、平均逃避潛伏期降低,穿越原平臺位置次數升高,差異具有統計學意義(P<0.05)。

表2 各組大鼠刻板行為評分、共計失調評分、平均逃避潛伏期、穿越原平臺位置次數比較
2.3 病理組織學觀察
如圖1所示,正常組大鼠海馬組織結構正常,海馬神經元細胞(箭頭處)正常;模型組大鼠海馬神經元變性,細胞核固縮(箭頭處),神經元細胞層減少;下調組大鼠海馬神經元變性,存在較為明顯的細胞核固縮現象(箭頭處),神經元細胞層明顯減少。上調組大鼠存在局灶性的神經元變性現象,少量細胞核固縮(箭頭處),組織學正常。
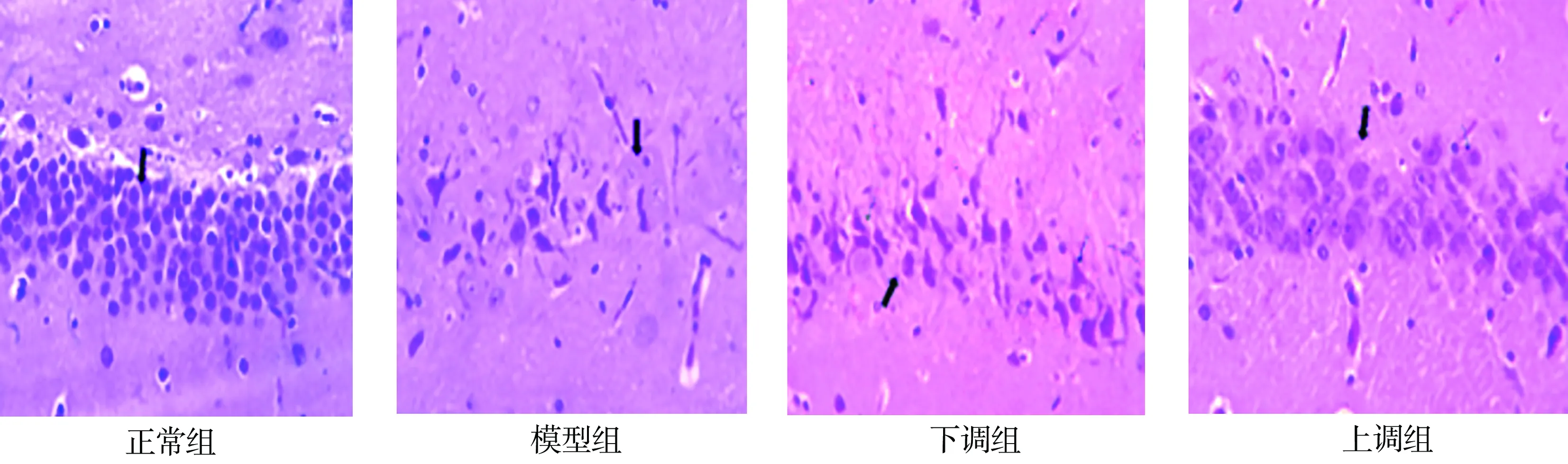
圖1 病理組織學觀察(HE×400)Fig. 1 Histopathological observation (HE×400)
2.4 各組大鼠Glu-DA神經遞質系統指標比較
如表3所示,與正常組相比,模型組、下調組、上調組NO活性、MDA含量、nNOS mRNA、DA水平升高,Glu水平降低,差異具有統計學意義(P<0.05);與模型組、下調組相比,上調組NO活性、MDA含量、nNOS mRNA、DA水平降低,Glu水平升高,差異具有統計學意義(P<0.05)。

表3 各組大鼠Glu-DA神經遞質系統指標比較
2.5 各組大鼠海馬組織中CREB/BDNF/TrkB信號通路蛋白表達量比較
如表4所示,與正常組相比,模型組、下調組、上調組的CREB,p-CREB,BDNF,TrkB及p-TrkB蛋白表達量降低,差異具有統計學意義(P<0.05);與模型組、下調組相比,上調組的CREB,p-CREB,BDNF,TrkB及p-TrkB蛋白表達量升高,差異具有統計學意義(P<0.05)。

表4 各組大鼠海馬組織中CREB/BDNF/TrkB信號通路蛋白表達量比較

圖2 CREB/BDNF/TrkB信號通路蛋白表達WB圖 Fig. 2 WB graph of protein expression of CREB/BDNF/TrkB signaling pathway
3 討論
目前臨床上對于精神分裂癥的具體發病機制仍處于不斷研究中,尚不完全明確,認為此病的發生與神經細胞膜相關,神經細胞膜主要包括花生四烯酸、二十二碳六烯酸,在神經發育的過程中多不飽和脂肪酸水平降低可增強血清、腦組織中PLA2的活性,進而誘導精神分裂癥的發生。
LPL基因定位于染色體8p22上,其長度大約為36 000 bp,由9個內含子和10個外顯子所構成,在脊髓、大腦、外周神經中廣泛存在,當大腦損傷或者周圍神經阻滯供血被阻斷后LPL含量顯著升高,修復損傷的神經組織[6-8]。臨床表明精神分裂癥的發生與人染色體8p22區域相關,而LPL基因同樣定位于染色體8p22上,因此推測LPL基因與精神分裂癥可能相關。但目前臨床上對于LPL基因與精神分裂癥的關系研究較少,僅有邢洪源等[2]發現LPL基因mRNA在精神分裂癥模型大鼠腦組織中的低表達。基于此背景,本文推測LPL基因可能作為精神分裂癥的靶點。上調和下調LPL基因對精神分裂癥動物模型的影響試驗結果顯示,LPL基因與精神分裂癥相關,上調LPL基因可阻止海馬組織進一步受損,抑制疾病進展。
CREB/BDNF/TrkB信號通路與神經系統發育相關,維持神經系統功能,其中BDNF屬于一種較為重要的腦源性神經營養因子,其在神經元生長分化、突出可塑性、抗神經元凋亡等過程中具有重要的意義[9]。而CREB屬于BNDF的上游轉錄因子,其具有對多種記憶相關蛋白表達的調節功能,其自身及磷酸化后均會在一定程度上抑制BDNF表達,促進BDNF下游調控因子TrkB磷酸化[10]。Guo等[11]在其研究中發現,上調CREB/BDNF/TrkB信號通路可改善精神分裂癥認知障礙。神經遞質系統紊亂與精神分裂癥發生后的海馬神經元損失相關,Glu-DA神經遞質系統在精神分裂癥發生后出現明顯的紊亂表現[12]。本文結果顯示,上調LPL基因可能經激活CREB/BDNF/TrkB信號通路,穩定Glu-DA神經遞質系統,發揮其改善精神分裂癥認知的作用。
綜上所述,本研究發現上調LPL基因后可在一定程度上修復精神分裂癥大鼠海馬組織損傷,其作用機制可能與激活CREB/BDNF/TrkB信號通路,穩定Glu-DA神經遞質系統,改善NO,MDA,nNOS,DA及Glu異常表達相關。但由于本研究動物樣本數量有限,該結論尚需后續試驗進一步證實。

