急性腦梗死患者的脂肪酸代謝組學相關性分析
唐 詩, 田步先
腦卒中在全球發病率位居第三,死亡率位居第二,其中急性腦梗死占69.6%~70.8%[1]。腦梗死是由于多種原因導致腦部血管發生阻塞,使血管內血流被阻斷或減少,導致阻塞部位腦細胞迅速死亡而引起神經功能障礙的一種疾病。腦梗死導致的缺血性病理生理改變并非完全不可逆。如果可以及時恢復受損腦組織部位的血流,則缺血半暗帶區域神經細胞的功能可以得到部分恢復。
脂質組學(Lipidomics)由Han等人于2003年首次提出,其系統分析生物體中脂質代謝物質的變化特征,以及脂質介導的信號通路,為探討疾病的發病機制提供一種新方法[2]。脂質組學已經廣泛應用于動脈粥樣硬化[3]、糖尿病[4]、阿爾茲海默[5]、腫瘤[6]等多種疾病的診斷及治療中。目前,基于脂質組學探討急性腦梗死發病與血漿游離脂肪酸(FFA)代謝物變化的相關文獻較少。本文采用串聯質譜技術分析腦梗死組和對照組的脂質代謝譜,篩選兩組間的差異性FFA代謝物,盡可能為以后探討腦梗死發病機制提供一種新思路。
1 資料與方法
1.1 一般資料 此研究中選擇2019年10月-2021年1月在錦州醫科大學附屬第一醫院神經內科住院的260例急性腦梗死患者為研究組,體檢中心非腦血管病志愿者200例為對照組。對照組與腦梗死組的年齡及性別盡量相匹配,減少其他因素對脂質代謝組學分析所造成的誤差。研究組入選標準:參照《中國急性缺血性腦卒中診治指南2018年》[1](1)患者具有神經功能缺損癥狀或體征;(2)癥狀或體征時間不超過2 w;(3)頭部CT或DWI影像學檢查顯示新發責任病灶。對照組納入標準:(1)無神經功能缺損癥狀或體征;(2)頭部CT檢查排除新發梗死病灶及其他顱內器質性病變。排除標準:(1)心、肝、腎等重要臟器功能嚴重衰竭者;(2)糖尿病、甲狀腺疾病、高尿酸血癥、痛風等代謝性疾病;(3)惡性腫瘤及自身免疫性疾病者。此研究通過醫院倫理委員會審批,所有研究對象均簽署知情同意書。
1.2 研究方法 所有研究對象在空腹8 h后,由醫務人員經由肘窩靜脈采取靜脈血漿樣本(肝素鋰抗凝),2 h之內進行離心(3000 r,10 min),取上清液置于EP管內,-80 ℃冷凍保持,送至我院遺傳代謝中心進行串聯質譜檢測,檢測方法可見參考文獻[7],共測得25個游離脂肪酸代謝物指標。
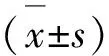
2 結 果
2.1 臨床資料分析 本研究納入了460例研究對象,其中研究組260例,對照組200例。研究組與對照組在年齡、性別、高血壓、冠心病、吸煙及飲酒史方面無明顯差異性(見表1)。
2.2 正交偏最小二乘法(OPLS-DA) 應用多元分析OPLA-DA法對兩組進行模式判別分析,并建立散點圖(見圖1)。從散點圖可以看出研究組與對照組之間分離比較明顯,得到R2X=0.449、R2Y=0.68、Q2=0.657,R2Y與Q2(cum)之間差值<0.3,同時Q2>0.5,提示模型的解釋和預測能力較強。經200次Permutation置換檢驗(見圖2),得出截距:R2(0.0,0.0241),Q2(0.0,-0.0851),Q2回歸曲線與y軸截距<0,說明OPLS-DA模型不存在過擬合現象。
2.3 差異代謝物的篩選 篩選血漿中25個游離脂肪酸代謝物。VIP值可以用于篩選對模型貢獻較大的變量。ROC曲線可以評估代謝物的鑒別能力、靈敏度和特異性。AUC值(ROC曲線下面積)可以評估潛在代謝物預測疾病的能力,AUC值越接近1其診斷能力越高,AUC>0.7表示具有中等及以上的診斷價值。經分析篩選獲得10個同時滿足VIP>1.0、AUC>0.7、P<0.01條件的代謝物(見表2)。
2.4 Logistic回歸分析與驗證
2.4.1 Logistic回歸分析 對上述所篩選出的10個FFA代謝物進行二元Logistic回歸分析(見表3)。結果示棕櫚酸(PA)、硬脂酸(SA)、亞油酸(LA)、油酸(OA)、花生四烯酸(AA)是兩組間顯著差異性代謝物(P<0.05)。據此建立回歸方程Y=14.54-0.001*PA-0.004*SA-0.001*LA-0.001*OA-0.002*AA,該方程可作為預測腦梗死發生概率的模型。根據此回歸方程,得出綜合性指標W。上述5個FFA代謝物與綜合性指標W在兩組間的表達差異見小提琴圖(見圖3)。

表1 研究對象一般臨床資料

表2 篩選兩組主要差異代謝物
2.4.2 驗證模型預測能力準確性 應用ROC曲線驗證模型的準確性(見圖4)。篩選出來的5種FFA代謝物的AUC值均大于0.7,綜合指標W的AUC值為0.917,說明該模型預測腦梗死的能力較高,并且多種代謝指標結合會提高預測的準確性。

表3 二元Logistic回歸分析中的變量
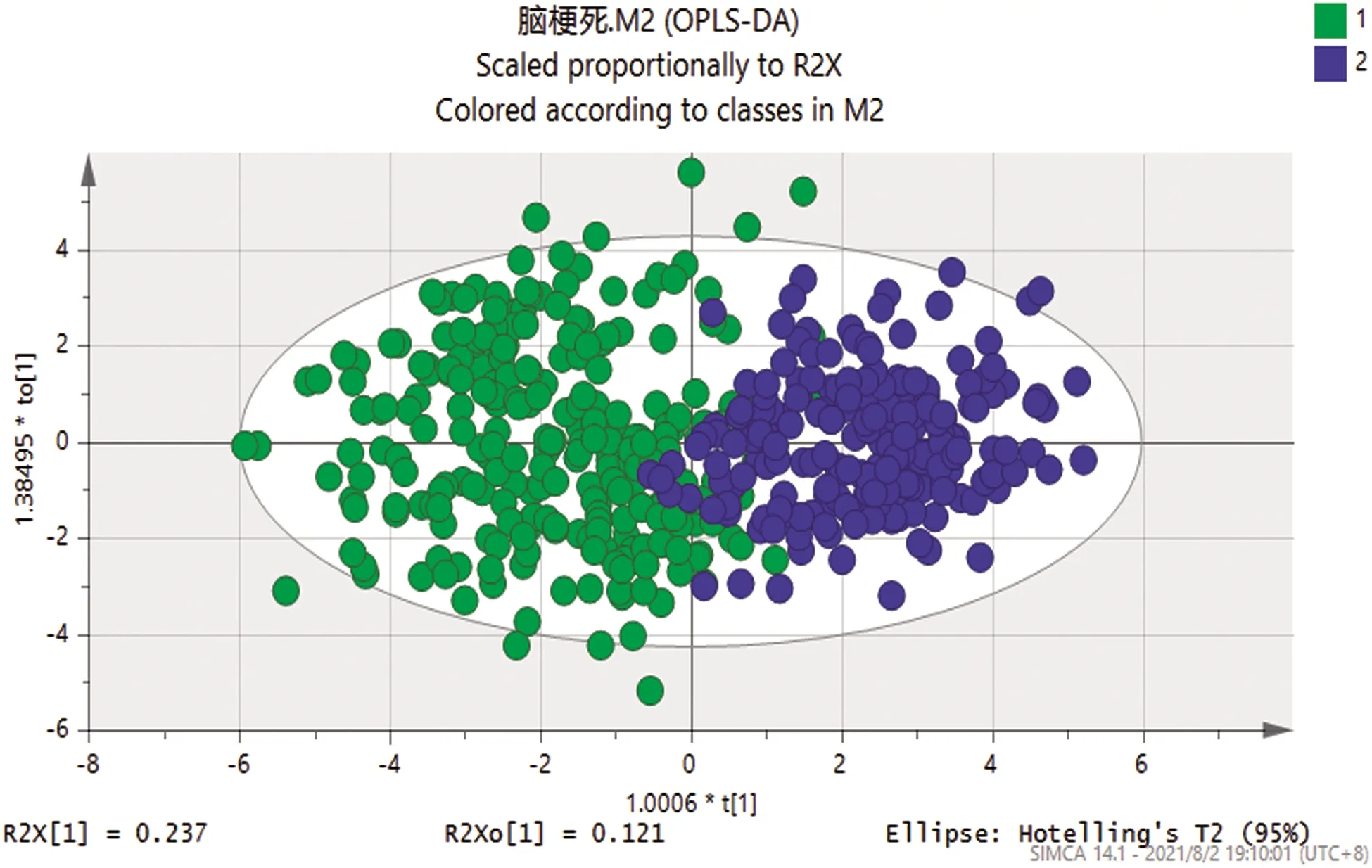
圖1 OPLS-DA散點圖(1:研究組:綠色;2:對照組:藍色)
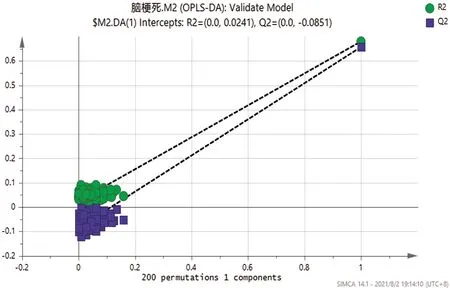
圖2 Permutation檢驗(1:研究組:綠色;2:對照組:藍色)
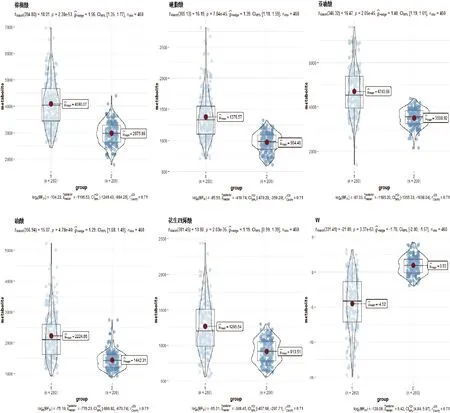
圖3 小提琴圖。其中每一個點代表一個統計量,中心紅點代表該項代謝物的中位數
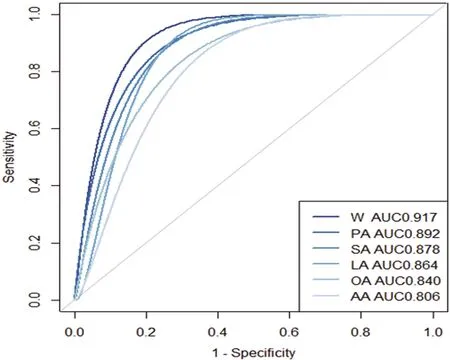
圖4 ROC曲線圖
3 討 論
腦卒中的發病率及死亡率在全球一直居高不下,及時有效的治療十分有必要。隨著串聯質譜技術的快速發展,小分子代謝物的精確檢測逐漸成為可能。本研究利用串聯質譜技術,對游離脂肪酸譜代謝物進行分析,尋找腦梗死組和對照組之間的代謝差異。
本研究對血漿FFA代謝物進行分析篩選,發現5個FFA代謝物與急性腦梗死具有一定相關性。與對照組相比,腦梗死組中棕櫚酸、硬脂酸、亞油酸、油酸、花生四烯酸含量顯著升高,差異有統計學意義(P<0.05)。
FFA是人體代謝過程重要的能源物質之一,其含量與心腦血管疾病有著密切地聯系。神經細胞對缺血缺氧十分敏感,當腦組織缺血缺氧時,葡萄糖氧化磷酸化障礙,ATP合成減少,機體通過分解脂肪酸來調節能量[8]。在本研究中,腦梗死組中棕櫚酸、硬脂酸、亞油酸、油酸、花生四烯酸增加,可能與疾病急性期維持能量穩態,脂肪酸分解代謝的增加有關。
動脈硬化是可以累及全身動脈導致血管疾病的慢性炎癥性疾病。頸動脈硬化不僅是腦梗死主要危險因素,也是疾病復發的危險因素。Vorkas PA等研究發現[9],花生四烯酸在有局灶性神經癥狀的頸動脈斑塊組的小鼠血漿中較無癥狀組含量顯著升高,具有較好的預測卒中風險能力。花生四烯酸可以增加低密度脂蛋白(LDL)對氧化的敏感性[10],還可以通過激活、聚集血小板,形成微血栓[11]。馬陽陽等人[12]發現硬脂酸在大動脈粥樣硬化型(LAA)中水平明顯升高,且與LDL呈正相關,原因可能與其增加LDL的濃度,促進動脈硬化的形成有關。巨噬細胞內脂質沉積是動脈粥樣斑塊形成的關鍵步驟,過多的脂質沉積可以增加氧化應激和炎癥反應,損傷腦細胞。棕櫚酸可以增加FABP-4和DGAT蛋白的表達,減低CPT-1表達,導致巨噬細胞內脂質沉積增多,加速腦梗死的發生[13]。本研究結果表明,硬脂酸和棕櫚酸在腦梗死患者血漿中含量明顯升高,其原因可能與其參與了動脈硬化的發生與發展過程相關。此外硬脂酸還可以激活凝血因子Ⅶ促進血栓的形成[14]。
高血壓與血管內皮細胞功能障礙在動脈硬化的發生發展進程中相輔相成。NO具有調節血管內皮舒張的功能,在控制血壓方面發揮重要作用。FFA可以通過抑制內皮細胞Ca2+和一氧化碳合酶,導致一氧化碳(NO)合成減少[15]。Lu Yihong等發現[16],在自發性高血壓的小鼠血漿中油酸、亞油酸和十六烷酸等FFA的水平隨著血壓的增高而升高,容易誘發腦血管疾病。本研究結果示腦梗死組血漿中亞油酸和油酸水平升高,其機制可能與脂肪酸代謝異常有關,使得血管舒張功能障礙和內皮細胞受損,導致腦梗死的發生。此外,油酸和亞油酸屬不飽和脂肪酸,其分子結構中含有易被氧化的雙鍵,可以導致氧化應激損傷,破壞腦細胞結構與功能。Xin Wang等研究發現[17],腦梗死患者血漿中的亞油酸、油酸、DHA等多種FFA的水平升高。研究結果與本研究基本一致。但Shuai Yuan等研究得出亞油酸和油酸與大動脈型卒中呈負相關,花生四烯酸和硬脂酸呈正相關[18]。該項研究結論與本研究不盡相同,具體的機制還需更深層次研究。另外,C16∶0、C18∶0、C18∶1和C18∶2水平在腦缺血再灌注的小鼠血漿中明顯升高,亞油酸代謝途徑變化較為顯著,因此控制亞油酸的水平可以預防及治療缺血再灌注損傷[19]。FFA代謝異常與卒中后抑郁的發生也具有一定相關性,棕櫚酸、亞油酸、油酸等7代謝物在腦卒中后抑郁的患者血漿中明顯升高,這可能與卒中后期患者發生失代償改變有關[20]。
基于本文的研究,我們發現棕櫚酸、硬脂酸、亞油酸、油酸、花生四烯酸可作為急性腦梗死的潛在生物標志物,并建立了預測能力良好的判別模型,這將為探討急性腦梗死疾病的發病機制提供了一些參考信息。本研究為單中心臨床研究,有很多局限性。研究中存在其他不可控因素可能導致個體代謝差異,因此同一患者疾病前后血漿樣本縱向分析十分必要。此外,本研究樣本量相對較小,尚未將全部脂質代謝物納入研究,還需擴大樣本進一步完善與優化試驗。

