多酚化合物對黃嘌呤氧化酶抑制作用的研究進展
洪鑫月 吳健妹 羅小喬 劉 凱 周偉杰 張國文
(南昌大學食品科學與技術國家重點實驗室,江西 南昌 330047)
黃嘌呤氧化酶(Xanthine Oxidase, XOD)是體內核酸代謝中重要的酶,能催化次黃嘌呤氧化生成黃嘌呤,再將黃嘌呤氧化產生尿酸[1]。由于人體內缺乏尿酸氧化酶,不能將尿酸進一步分解成可溶性的尿囊素,因此,當體內XOD活性異常增高時,會造成尿酸生成增多,尿酸的積累或排泄不暢將導致高尿酸血癥,長期的高尿酸血癥會導致尿酸鈉晶體在關節、組織等處沉積,引發痛風等癥狀。據統計[2],約有5%~12%的高尿酸血癥最終可發展為痛風。高尿酸血癥不僅是痛風的生化基礎,還與代謝綜合征、糖尿病、慢性腎病、高血壓、冠心病等疾病的發生發展密切相關[3]。隨著生活水平的提高和飲食結構的改變,人們對高嘌呤類食物的攝入量也日益增加,高尿酸血癥發病率在中國逐年上升,目前已達1.2億人,且發病年齡呈現低齡化的趨勢[4],高尿酸血癥已成為危害人民健康的嚴重代謝性疾病。
XOD是人體產生尿酸的限速酶,同時也是治療高尿酸血癥藥物的作用靶點,抑制XOD的催化活性,減少黃嘌呤向尿酸轉化,已成為臨床緩解和治療高尿酸血癥的主要途徑之一[5]。別嘌呤醇(Allopurinol)和非布索坦(Febuxostat)等是目前臨床最常用的XOD抑制劑,前者通過抑制黃嘌呤與Mo-pt中心的配位作用[6],后者通過占據酶的疏水空腔阻止與黃嘌呤的結合以抑制酶催化活性,從而達到降尿酸的目的[7],然而這些化學合成抑制劑在臨床使用中常引起發熱、皮疹、腹痛、腹瀉、白細胞與血小板減少以及肝腎損傷等不良反應[8],從而使其應用受到限制。因此,尋找活性高、毒副作用小且作用機制明確的新型XOD抑制劑已成為亟待解決的重要課題之一。
多酚化合物是許多天然植物的主要有效成分,具有抗氧化、抗動脈粥樣硬化、抗高血壓、降血糖、抗炎抑菌、抗病毒、抗癌等廣譜藥理活性和低毒性,是食品功能因子和新藥研發的重要資源。近年來,多酚化合物對XOD的抑制作用受到國內外學者的廣泛關注,已有較多的報道。文章擬重點對近5年來多酚化合物抑制XOD活性及其相互作用研究進行綜述,以期為多酚類化合物作為降尿酸食品功能因子或藥物的研發提供依據。
1 黃嘌呤氧化酶

2 多酚化合物對XOD的抑制作用
多酚化合物是廣泛存在于植物中的一類含有酚基團的次生代謝產物,目前在自然界中已經發現8 000多種多酚類化合物,其結構復雜,有的可以與單糖或多糖結合成苷,還有的以衍生物的形式存在。多酚化合物按照其結構式和化學基團的不同主要分為黃酮類、酚酸類、單寧類、香豆素類和二苯乙烯類。研究[11-12]表明,多酚化合物具有抗氧化、降血糖、降血脂、抗動脈粥樣硬化、抗炎抑菌、抗病毒、抗癌等生理活性。近年來,多酚化合物尤其是黃酮類和酚酸類化合物對XOD的抑制作用受到國內外學者的高度關注,顯示出該類化合物具有進一步發展成為高效XOD抑制劑的潛能。
2.1 黃酮類化合物對XOD的抑制作用
黃酮類化合物是由C6-C3-C6骨架構成的一系列化合物的總稱,由兩個苯環(A環和B環)通過3個碳(C)相互連接而成,該類化合物根據B環連接位置及3碳鏈氧化程度和是否成環等可分為黃酮、黃酮醇、異黃酮、二氫黃酮、黃烷酮、花青素和查爾酮等[13]。針對XOD的抑制作用,黃酮類化合物目前已有較多的報道,是多酚化合物中研究最多的一類化合物。
2.1.1 黃酮 Lin等[14]報道白楊素、芹菜素均有較強的XOD抑制活性,白楊素的半抑制濃度(IC50)為1.26 μmol/L,低于陽性對照別嘌呤醇的IC50(2.93 μmol/L),其抑制XOD的能力強于芹菜素(IC50=3.57 μmol/L),是一種可逆的競爭型抑制劑。閆家凱[15]采用酶促動力學方法研究了木犀草素對XOD的抑制作用,發現木犀草素能夠有效地抑制XOD活性,是一種可逆的競爭型XOD抑制劑,其IC50為4.79 μmol/L,抑制常數Ki為2.38 μmol/L。Orsolya等[16]報道香葉木素對XOD的抑制能力比木犀草素更強,二者的IC50分別為0.53,0.84 μmol/L。馬文濤[17]報道芹菜素、木犀草素、木犀草苷的IC50分別為0.060,0.022,0.047 mmol/L,三者均可以較好地抑制XOD活性,且抑制率均>50%,對XOD的抑制類型屬于可逆性抑制。芹菜素、苜蓿素屬于混合型XOD抑制劑,對游離酶的抑制作用強于對酶—底物復合物的抑制作用,且苜蓿素的IC50為4.13 μmol/L[18]。筆者團隊[19]發現黃芩素有較強的XOD抑制能力,而黃芩苷的抑制活性較弱,均為混合型可逆抑制劑,在抑制50%和70% XOD活性水平時,黃芩素與別嘌呤醇聯用具有一定的協同抑制作用,而黃芩苷與別嘌呤醇的聯合使用僅在抑制50% XOD活性時存在協同效應,在抑制30%和70% XOD活性時,二者聯用顯示出拮抗作用,而黃芩素與黃芩苷聯用在抑制30%,50%和70% XOD活性時均有較好的協同作用。還有文獻[20]35-37報道異澤蘭黃素、澤蘭黃酮、高車前素、棕矢車菊素及半齒澤蘭素均表現出較好的XOD抑制效果,其IC50分別為0.72,3.98,7.53,16.00,42.20 μmol/L,其中澤蘭黃酮只能與游離酶結合,屬于競爭型XOD抑制劑,其他4種化合物均為混合型抑制劑。

2.1.3 異黃酮 異黃酮具有3-苯基色原酮基本骨架,其B環連接位置與黃酮有所不同,因主要存在于豆科植物特別是大豆中,也被稱為大豆異黃酮。染料木素屬于異黃酮,IC50為1.73 μmol/L,抑制常數Ki為1.39 μmol/L,是一種活性很強的可逆競爭型XOD抑制劑。染料木素與芹菜素互為同分異構體,二者僅B環的連接位置不同(染料木素B環連接在C-3位,芹菜素為C-2位)。染料木素的B環可以插入XOD的疏水空腔,與氨基酸殘基之間存在的π—π相互作用使其能穩定在空腔內而具有更強的抑制活性[31]46-48。葛根素對XOD的抑制活性較弱,IC50為555.2 μg/mL,當其質量濃度>60 μg/mL時,抑制率也僅有18%,造成抑制能力不強的原因很可能是結構中存在較大體積的取代基團使其不易與酶的活性位點結合[25]54-55[32-33]。

此外,越來越多的動物試驗[38-39]也表明,富含黃酮類物質的食物可顯著抑制動物體內XOD活性,降低模型動物體內的尿酸生成。近年來,作為潛在的酶抑制劑,黃酮類化合物的合成與生物活性研究日益增多,研究也更加傾向于其藥用價值的開發。
2.2 酚酸類化合物對XOD的抑制作用
酚酸類化合物是指在一個苯環上有多個酚羥基取代的芳香羧酸類化合物[40],它們在自然界特別是水果、蔬菜、茶和咖啡等食物中廣泛存在,現階段對XOD的抑制作用研究主要集中在咖啡酸、綠原酸、阿魏酸、沒食子酸等酚酸類化合物。Lin等[41]報道幾種酚酸對XOD的抑制能力,其IC50值依次為:咖啡酸(7.16 mmol/L)>綠原酸(6.49 mmol/L)>對香豆酸(5.58 mmol/L)>丁香酸(4.36 mmol/L)>阿魏酸(3.45 mmol/L)>芥子酸(2.88 mmol/L)>別嘌呤醇(8.50 μmol/L),顯示出相對溫和的XOD抑制活性,且均為混合非競爭型抑制劑,也有文獻[42-43]報道咖啡酸、綠原酸和阿魏酸的抑制類型均為競爭型。Masuda等[44]發現咖啡酸氧化物對XOD的抑制作用遠強于咖啡酸,為別嘌呤醇的18倍。迷迭香酸的水溶性較差,溶液中溶解度僅有5%,其抑制XOD活性的能力(IC50=14.78 mg/mL)比咖啡酸(IC50=2.82 mg/mL)更弱,是一種競爭型XOD抑制劑[45-46]。沒食子酸是一種可逆的偏競爭型的混合型XOD抑制劑,IC50為183.61 μg/mL[33]。單一的沒食子酸抑制能力較弱,在維生素C的協同下其抑制率達到40.96%,比同濃度的沒食子酸提高了近15%,這可能與維生素C的強還原性阻止沒食子酸被氧化降解有關[30]。沒食子酸衍生物(辛基、癸基和十二烷基沒食子酸)均為XOD的競爭型抑制劑,對XOD的抑制作用會隨烷基碳鏈的增長而增強[47]。張婧妍等[48]報道丹酚酸A通過與底物競爭結合于酶的活性中心從而抑制XOD活性,抑制類型為競爭型,IC50為65.49 μmol/L,Ki值為28.5 μmol/L。杜洪芳等[49]測得原兒茶酸抑制XOD的IC50值為0.38 mmol/L,其抑制能力與楊梅素相當(IC50=0.32 mmol/L)。
2.3 其他類多酚化合物對XOD的抑制作用
研究[50-51]表明,其他的多酚化合物如兒茶素類、二苯乙烯類等也有一定的XOD抑制活性。表兒茶素沒食子酸酯(ECG,IC50=0.90 mmol/L)和表沒食子兒茶素沒食子酸酯(EGCG,IC50=0.49 mmol/L)均具有一定的XOD抑制活性,而兒茶素(C)、表兒茶素(EC)和表沒食子兒茶素(EGC)無明顯的XOD抑制能力。Tang等[52]研究幾種二苯乙烯類化合物對XOD的抑制作用,發現白皮杉醇是競爭型XOD抑制劑,土大黃苷、白藜蘆醇和異丹葉大黃素屬于非競爭型抑制劑,其IC50分別為6.440,5.997,3.880,46.750 μmol/L,顯示出良好的體外抑制能力。Dong等[37]發現短葉松素在不同的底物下對XOD的抑制作用有所差異,底物為次黃嘌呤時,低濃度(15~200 μmol/L)短葉松素才對XOD有抑制作用,IC50為125.10 μmol/L;底物為黃嘌呤時,短葉松素為混合型抑制劑,其IC50為137.32 μmol/L。Liu等[53]發現2’,4’-二甲氧基-4,5’,6’-三羥基查耳酮是一種混合型XOD抑制劑,IC50為0.21 μmol/L(別嘌呤醇為2.07 μmol/L),有很強的體外XOD抑制活性。孫永麗等[54]報道7,3’,4’-三羥基-3-芐基-2氫-苯并吡喃、3-去氧蘇木酮B、蘇木查爾酮和原蘇木素A均有一定的XOD抑制活性。劉雪梅[55]發現姜黃素對XOD的抑制能力與喬松素相當,但弱于山奈酚和高良姜素。異甘草素也有良好的XOD抑制能力(IC50=19.32 μmol/L),其抑制活性呈濃度依賴性[56]。
2.4 多酚類金屬配合物對XOD的抑制作用
多酚類化合物與金屬離子形成配合物,不僅能提高水溶性、穩定性和生物利用率,而且還可以增強多酚類化合物的藥理活性。Dong等[57]報道木樨草素—錳(II)配合物體外抑制XOD活性比相同濃度的母體木樨草素高出18.6%。邢志華等[58]報道芹菜素—釓(III)配合物能顯著降低高尿酸血癥小鼠血清中XOD的活性和血清尿酸水平,且其促進尿酸排泄和清除超氧自由基能力均優于芹菜素。筆者團隊[59]前期研究發現白楊素—銅(II)配合物對XOD的抑制能力比母體白楊素提高了1.5倍,主要是由于Cu2+發揮了橋梁作用使白楊素更容易結合到XOD的Mo-pt中心,占據了酶活性中心,導致酶結構緊縮,阻礙底物黃嘌呤與活性中心的作用,從而導致白楊素—Cu(II)配合物有更強的抑制能力。盡管目前多酚類金屬配合物對XOD抑制作用的研究還比較少,但已有的報道表明多酚金屬配合物可能是一類有良好前景的潛在XOD抑制劑。
3 多酚化合物與黃嘌呤氧化酶的相互作用
研究多酚化合物與XOD之間的相互作用,分析二者的結合常數、結合位點數、主要作用力、結合位點及參與作用的主要氨基酸殘基,研究多酚化合物誘導XOD結構的變化對酶催化底物的影響,對于從分子水平上闡明多酚化合物抑制XOD的分子機制具有重要的意義。
3.1 黃酮類化合物與XOD的相互作用
絕大多數黃酮類化合物能與XOD結合形成復合物,結合常數在104~105L/mol,為中等強度的結合親和力,結合位點數為1,對XOD的熒光猝滅機制大多為靜態猝滅。Lin等[60-61]報道染料木素和白楊素對XOD的猝滅類型為靜態猝滅,二者有一個結合位點,結合常數分別為5.24×104,7.98×105L/mol,氫鍵和疏水作用力為染料木素與XOD結合的主要驅動力,白楊素與XOD的結合則主要由氫鍵和范德華力驅動。Zhang等[23-24,62]研究了3種黃酮類化合物槲皮素、高良姜素和楊梅素與XOD的相互作用,發現它們的結合常數大小為:4.28×104L/mol(槲皮素)>3.60×104L/mol(高良姜素)>3.24×104L/mol(楊梅素),楊梅素、槲皮素與XOD的結合過程主要由范德華力和氫鍵驅動,氫鍵和疏水相互作用主導了高良姜素與XOD的結合,它們都通過靜態方式猝滅XOD的內源熒光。王亞杰等[63]報道桑色素通過疏水作用力與XOD結合形成復合物靜態猝滅XOD的熒光,結合常數為2.32×104L/mol。而橙皮苷和EGCG由于自身含有較多的羥基,與氨基酸殘基之間也可能存在靜電作用[64]。曾霓[65]27-31報道黃芩素、漆黃素、橙皮素對XOD均為靜態猝滅,而黃芩苷對XOD的猝滅則同時存在靜態與動態兩種類型,其在XOD上都只有一個結合位點和中等強度的結合親和力,結合常數從大到小依次為黃芩素(9.10×104L/mol)>黃芩苷(8.93×104L/mol)>橙皮素(8.27×104L/mol)>漆黃素(5.97×104L/mol),氫鍵和疏水作用力是這些黃酮類化合物與XOD作用的主要驅動力。

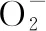
同步熒光光譜研究表明,黃酮類化合物與XOD相互作用常常會引起XOD酪氨酸和色氨酸殘基周圍的微環境發生改變。李夢榮[20]40-42報道異澤蘭黃素的存在會導致XOD色氨酸殘基周圍極性增加和疏水性降低,而對酪氨酸殘基周圍的微環境則無明顯影響。槲皮素能引起XOD酪氨酸殘基周圍的疏水性增強,色氨酸殘基周圍的疏水性降低和極性增加[62]。利用同步熒光猝滅比率(RFSQ)可以評估色氨酸和酪氨酸殘基對XOD熒光猝滅的貢獻大小。Zhang等[23]報道高良姜素Δλ=60 nm處的RFSQ值>Δλ=15 nm處的值,色氨酸對XOD內源熒光猝滅的貢獻大于酪氨酸,認為高良姜素與XOD的結合位點更靠近色氨酸殘基。
黃酮類化合物與XOD結合往住導致XOD結構發生改變,影響酶活性中心的形成及其與底物作用,從而降低酶的活性。葉素梅[67]報道芹菜素與XOD的結合會引起XOD的α-螺旋和β-折疊含量增加,β-轉角和無規則卷曲的含量降低,使得XOD的二級結構更加緊密,不利于酶形成活性中心。Zhang等[24]報道楊梅素與XOD結合會引起XOD的α-螺旋和無規卷曲含量增加,β-折疊和β-轉角的含量減少,更加緊縮的酶結構削弱了XOD的催化活性。而山奈酚則使XOD二級結構中α-螺旋和無規卷曲的含量降低,β-折疊和β-轉角的含量增加,山奈酚破壞了XOD的氫鍵網絡,導致酶多肽部分伸展,穩定性降低,從而影響酶的活性[22]。
3.2 酚酸類化合物與XOD的相互作用
現階段咖啡酸、綠原酸等酚酸類化合物與XOD之間相互作用受到更多的關注。Wan等[42]報道咖啡酸會使XOD分子結構變得無序而影響其催化活性,具體表現為α-螺旋含量降低,β-折疊、β-轉角和不規則性含量增加。分子模擬結果表明,咖啡酸作用于XOD的Mo-pt中心的疏水空腔,并與氨基酸殘基Glu802、Agr880、Thr1010形成氫鍵,其在XOD上結合區域與黃嘌呤相同。綠原酸能夠通過靜態和動態復合猝滅方式猝滅XOD的熒光,結合常數為2.39×106L/mol,氫鍵和范德華力是二者作用的主要驅動力,綠原酸與XOD結合導致XOD的α-螺旋含量增高,β-折疊含量降低,XOD的結構變得更加緊縮,影響酶與底物作用從而降低酶的活性[70-71]。朱大帥[72]報道綠原酸與XOD上的氨基酸殘基Glu1016、Asn1073形成氫鍵,與咖啡酸相比,綠原酸在化學結構上多一個六元環,分子體積過大使其不能進入XOD的活性口袋而暴露在外,且不能與XOD通過網格狀氫鍵結合,導致綠原酸與XOD的結合不夠牢固,影響了其對XOD的抑制活性。王雪潔等[73]發現異綠原酸B(3,4-二咖啡酰奎寧酸)結合到XOD的疏水口袋,其三咖啡酰基上的酚羥基與Glu802和Mos3004形成氫鍵,酰基與Ser876形成氫鍵,四咖啡酰基上的酚羥基與Glu879形成氫鍵,且與Ala1079、Ala1078、Arg880、Phe914、Leu873、Thr1010、Leu648、Lys771、Leu1014、Phe1013、Phe649、Val1011、His875和Phe1009等殘基產生疏水作用。張婧妍等[48]報道丹酚酸進入XOD的活性口袋,其1,2-二芳基乙烯基團伸入位于Mo-pt結構域的疏水性區域,3,4-二羥基芳基丙酸基團游離于活性口袋袋口處,其結構中的游離羥基與氨基酸殘基Gln767、Asn768、Arg880、Thr1010形成氫鍵,且苯環結構還與氨基酸殘基Phe914、Phe1009產生π—π效應。
3.3 其他多酚化合物與XOD的相互作用
除黃酮類和酚酸類化合物之外,目前其他多酚化合物與XOD相互作用的研究還比較少。李昕卓等[64]報道白藜蘆醇能夠與XOD相互作用形成復合物,二者有中等強度的結合親和力,氫鍵和疏水作用力是其結合的主要驅動力。白藜蘆醇結合于XOD活性中心Mo-pt結構域附近,與鉬喋呤Mos3004活性中心附近的Thr1010、Ala1079形成氫鍵,并與氨基酸殘基Leu648、Phe649、Glu802、Leu873、Ser876、Phe914、Phe1009、Val1011、Leu1014、Ala1078及鉬喋呤Mos1334活性中心間存在疏水相互作用,其結合區域與底物相同,而EGCG結合在XOD的FAD活性中心附近,被氨基酸殘基Gly46/350、Leu74/305、Glu263、Ile266、Phe337、Ala346、Asn351和Asp360包圍,并與氨基酸殘基Glu45、Ser347、Thr262、Ile358、Arg426和Lys433形成氫鍵。Zhang等[74]報道矢車菊素-3-槐苷-5-葡萄糖苷與XOD的氨基酸殘基Asn768、Glu802、Ser876和Gln1122形成7個氫鍵。矢車菊素-3-(6’咖啡酰基-6”-阿魏酸槐苷)-5-葡萄糖苷與活性位點周圍的Leu648、Agr871、Glu879、Agr880、Thr1010和Gln1122殘基形成5個氫鍵,其6’-咖啡酰基插入疏水空腔與Arg880和Thr1010形成氫鍵,花色苷的酰化基團插入XOD的疏水口袋后通過與底物競爭而占據酶的催化中心可能是其抑制XOD活性的主要原因。
4 結論與展望
多酚化合物作為具有廣泛藥理活性的植物活性成分,近年來,其對XOD抑制活性和相互作用的研究已有較多的文獻報道,取得了較好的研究進展,為該類化合物作為降尿酸食品功能因子和藥物的研發提供了科學依據,但多酚化合物的結構與其抑制XOD活性之間關系的研究還比較欠缺,對XOD抑制機制的認識也較為有限,還需要采用更加有效的策略進行深入探討。此外,由于多酚類化合物存在穩定性弱和溶解性差等不足而使其作為功能因子的生物利用率受到影響,因此,以天然多酚為先導化合物,對其結構進行修飾、改造或合成金屬配合物,開發出高效、安全且水溶性和穩定性更好的新型降尿酸化合物,是值得進一步探索的研究方向。

