組蛋白去乙酰化酶在小鼠神經元發育中的作用與機制研究
白雨薇 關夢龍 鄭濤 李世平 屈藝 母得志
(四川大學華西第二醫院兒科/出生缺陷與相關婦兒疾病教育部重點實驗室,四川成都 610041)
作為一種表觀遺傳方式,組蛋白乙酰化在腦細胞的發育過程中起到了重要的調控作用。組蛋白乙酰化由組蛋白乙酰轉移酶(histone acetyltransferases, HATs)和組蛋白去乙酰化酶(histone deacetylases, HDACs)共同調控[1]。HATs使核小體結構變松弛,各種轉錄因子和協同轉錄因子能與DNA位點特異性結合,激活基因的轉錄。而HDACs使組蛋白氨基末端去掉乙酰基暴露帶正電荷的堿性氨基酸,與帶負電荷的DNA緊密結合形成致密的染色質結構,抑制下游基因的轉錄。
哺乳動物HDACs由4類基于結構域不同的超家族構成。第1類中的HDAC1和HDAC2(HDAC1&2)廣泛表達于各類細胞的細胞核中,是發育過程中的重要調控因子[2]。HDAC1和HDAC2在功能上具有冗余性,HDAC1或HDAC2單獨缺失對腦的發育、腦結構和小鼠壽命無明顯影響;而HDAC1和HDAC2共同缺失會導致腦結構嚴重受損和胚胎期小鼠死亡[3]。在中樞神經系統中,HDAC1&2在早期大腦皮質發育中控制神經中間祖細胞的定位,缺失HDAC1&2導致神經中間祖細胞錯誤遷移,進而使大腦皮質發育畸形[4];在神經干細胞中敲除HDAC1&2會導致胚胎期小鼠死亡,伴有整個腦的體積縮小和大腦皮質、小腦結構受損[3]。在少突膠質細胞發育中,HDAC1&2通過抑制WNT通路的激活來維持少突膠質細胞的分化,缺失HDAC1&2導致少突膠質細胞無法正常成熟和形成髓鞘[5];此外,在胚胎時期,小鼠小膠質細胞中敲除HDAC1&2會導致小膠質細胞發育不良,存活率下降[6]。在外周神經系統中,HDAC1&2是施旺細胞形成髓鞘的關鍵轉錄因子,缺失HDAC1&2導致外周神經脫髓鞘化[7]。
目前HDAC1&2在神經元發育中的作用尚鮮有報道。突觸蛋白1(Synapsin1)是突觸蛋白家族的成員,編碼與突觸小泡表面相關聯的蛋白,參與突觸發生和調節神經遞質釋放。具有Synapsin1啟動子Cre重組酶(Synapsin1-Cre)的小鼠在神經元中特異性表達Cre重組酶[8]。因此我們通過與Synapsin1-Cre小鼠雜交建立了在神經元中特異性敲除HDAC1&2的小鼠模型,用以探索HDAC1&2在神經元發育過程中的作用。
為進一步探索HDAC1&2在神經元發育過程中的作用機制,我們嘗試探索敲除HDAC1&2后腦組織不同信號通路的變化。既往研究表明,哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是細胞內信號通路轉導分子,調節很多重要的生理過程。在中樞神經系統中,mTOR信號通路能夠調節神經元形態,調控各類蛋白質合成[9]。此外,mTOR信號通路還對軸突生長發育起正向調節作用[10]。因此,本研究中,我們著重檢測了小鼠神經元敲除HDAC1&2后mTOR信號通路的變化。
1 材料與方法
1.1 實驗動物
Synapsin1-Cre、HDAC1flox/+和HDAC2flox/+小 鼠為本實驗室飼養。親本通過雜交得到HDAC1&2flox/flox和Synapsin1-CreHDAC1&2flox/+基因型小鼠。將HDAC1&2flox/flox小鼠與Synapsin1-CreHDAC1&2flox/+小鼠再次雜交,獲得Synapsin1-CreHDAC1&2flox/flox基因型小鼠。該小鼠神經元內表達的Cre酶可使HDAC1&2基因內兩個loxp位點重組,最終使HDAC1&2被敲除。將該基因型小鼠作為敲除組,同窩出生的HDAC1&2flox/flox、HDAC1flox/+H D A C 2f l o x/f l o x、H D A C 1f l o x/f l o xH D A C 2f l o x/+、HDAC1&HDAC2flox/+小鼠作為對照組(圖1)。
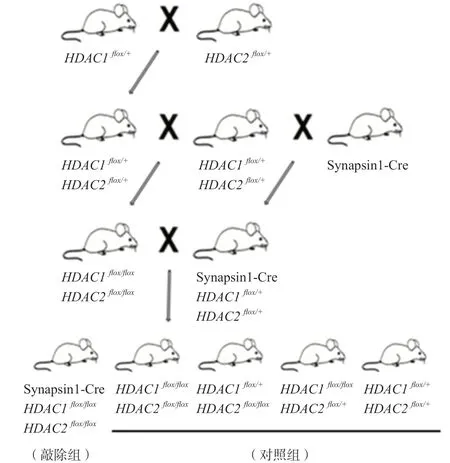
圖1 敲除小鼠構建策略
1.2 主要試劑
兔抗HDAC1抗體(Thermo公司,美國)、HDAC2抗體(Abcam公司,英國);鼠抗神經 元 核 抗 原(neuronal nuclear antigen, NeuN)(Millipore公司,美國);鼠抗磷酸化神經絲蛋白重鏈(phosphorylated neurofilament H, p-NF200)及非磷酸化神經絲蛋白重鏈(non-phosphorylated neurofilament H, np-NF200)(Covance公司,美國);兔抗磷酸化核糖體S6(p-S6)(CST公司,美國);山羊血清(Millipore公司,美國);脫脂奶粉(上海碧云天生物公司)。
1.3 組織切片制備
小鼠用乙醚麻醉后固定于解剖盤內。剪開右心包,從左心室注入預冷的磷酸鹽緩沖液(PBS),觀察到肝臟變白后注入4%預冷的多聚甲醛(PFA)。此時剪開小鼠顱骨,剔除腦膜取出完整腦組織。
取出的腦組織于4% PFA中固定過夜。梯度酒精依次脫水,二甲苯置換酒精后于融化的石蠟缸中浸蠟過夜。組織塊包埋,用LEICA石蠟切片機切成4 μm的切片,常溫保存。
取出的腦組織放置于4% PFA中固定過夜。4%PBS瓊脂糖包埋,用LEICA振動切片機切成50 μm的切片,浸泡于PBS中4℃保存。
1.4 蘇木精-伊紅染色
石蠟切片脫蠟復水后,蘇木素染液室溫孵育10 min,流水緩慢沖洗去除多余染色。鹽酸酒精分化數秒,流水沖洗。伊紅染液室溫孵育2 min,梯度酒精脫水、二甲苯透明后封片。
1.5 免疫組化染色
石蠟切片脫蠟復水后置于抗原修復液中100℃水浴加熱半小時。使用含0.3% TritonX-100的PBS處理15 min,3%過氧化氫處理20 min。封閉液(含5% FBS+0.3% TritonX-100的PBS)室溫孵育1 h。一抗溶解于封閉液中,NeuN(1 : 400)、np-NF200(1 : 1 000)、p-NF200(1 : 1 000)、 p-S6(1 : 200),4℃孵育過夜。二抗室溫孵育1 h,根據抗體特性,DAB顯色適當時間。蘇木素處理2 min,鹽酸酒精分化后流水沖洗,脫水、透明、封片。
1.6 Western blot檢測
小鼠經乙醚麻醉后灌注,快速取出腦組織。在冰上于PBS中分離出大腦皮質放入標記好的離心管,裂解后離心取上清液。加入等體積2×Loading Buffer,100℃處理15 min。取等體積蛋白樣品加樣,電泳、轉膜。PVDF膜封閉后浸于按比例稀釋好的一抗溶液中,4℃過夜,二抗室溫孵育2 h。ECL化學發光試劑浸泡2 min,凝膠成像儀曝光成像。
1.7 統計學分析
采用Graphpad Prism 5統計軟件對數據進行統計學分析。計量資料使用均數±標準差(x±s)表示,兩組均數比較采用兩樣本t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 神經元特異性敲除HDAC1&2小鼠模型驗證
Cre重組酶最早于孕12.5 d在神經元中表達,取出生后(P)14 d兩組小鼠大腦皮質,經Western blot檢測HDAC1及HDAC2蛋白表達量,結果顯示敲除組小鼠HDAC1及HDAC2蛋白表達水平明顯低于對照組(P<0.05,圖2、表1),提示敲除組小鼠HDAC1&2得到敲除。
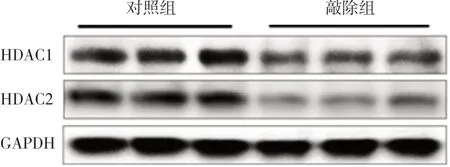
圖2 Western blot檢測P14 d兩組小鼠HDAC1、HDAC2蛋白表達電泳圖
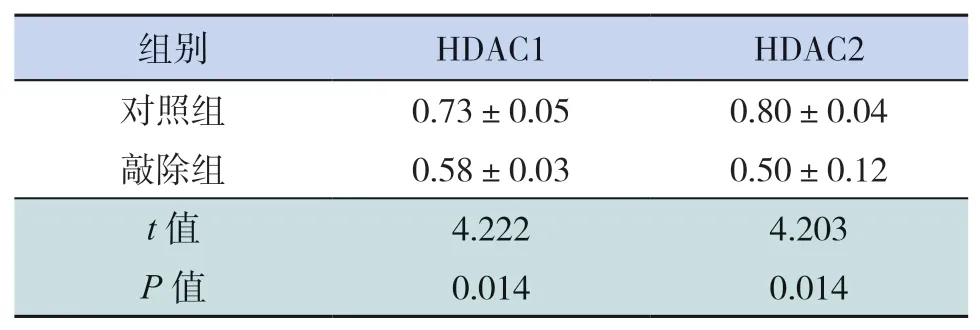
表1 兩組小鼠HDAC1、HDAC2蛋白相對表達水平比較(n=3,x±s)
2.2 神經元特異性敲除HDAC1&2小鼠一般情況
敲除組小鼠出生比例符合孟德爾定律,通常在出生后1個月以內死亡,死亡時間多在P13 d~P16 d(圖3A)。對照組小鼠則無明顯異常表型,可正常繁殖。在正常飼養環境下,敲除組小鼠在P11 d~P13 d出現全身性震顫,無法平穩行走等運動功能異常現象。提起尾巴時對照組小鼠后肢張開,而敲除組小鼠則緊抱后肢(圖3B)。敲除組小鼠腦組織和體型相較對照組明顯減小(圖3C~D)。
2.3 敲除HDAC1&2對小鼠神經元發育的影響
為研究敲除HDAC1&2是否對小鼠神經元正常發育產生影響,用成熟神經元標記物NeuN進行免疫組化染色。結果顯示敲除組小鼠胼胝體上方大腦皮質NeuN陽性細胞數量明顯減少(圖4)。
神經絲蛋白(neurofilament, NF)是神經元細胞骨架的主要組成部分,主要作用是為軸突提供結構支持和調節軸突直徑[11]。磷酸化過程被認為是調節NF從胞質運輸并形成軸突的重要步驟[12]。表達定位于神經元軸突的p-NF200的免疫組化染色結果顯示,敲除組小鼠存在明顯的軸突丟失及p-NF200水平下降。主要定位于神經元胞漿的np-NF200的免疫組化染色結果顯示,敲除組小鼠大腦皮質陽性信號相對于對照組顯著減少。見圖4。
Western blot結果也顯示敲除組NeuN、p-NF200、np-NF200蛋白表達量均較對照組降低(P<0.05),見圖5、表2。
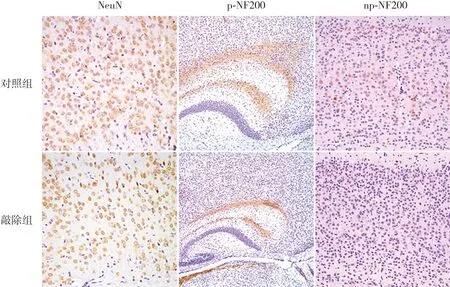
圖4 P14 d小鼠神經元和軸突發育標記物檢測 小鼠大腦皮質NeuN免疫組化染色(×400):敲除組小鼠大腦皮質NeuN陽性表達與對照組相比明顯減少,NeuN陽性表達呈棕黃色。小鼠大腦皮質p-NF200免疫組化染色(×100):敲除組小鼠胼胝體上方神經元軸突纖維萎縮、排布稀疏,而對照組神經元軸突纖維排列致密成網,p-NF200定位于神經元軸突,陽性表達呈棕黃色。小鼠大腦皮質np-NF200免疫組化染色(×200):敲除組小鼠大腦皮質神經元胞漿偶見np-NF200蛋白表達,而對照組神經元胞漿np-NF200蛋白表達較敲除組顯著增加,np-NF200陽性表達呈棕黃色。

圖5 Western blot檢 測P14 d兩 組 小 鼠NeuN、p-NF200、np-NF200蛋白表達電泳圖
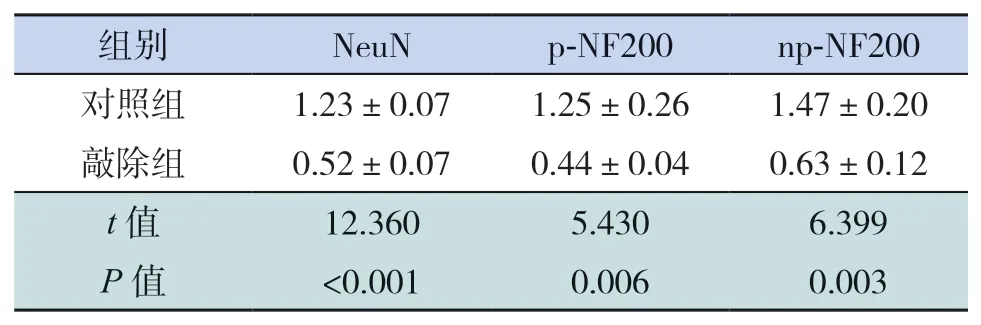
表2 兩組小鼠NeuN、p-NF200、np-NF200蛋白相對表達水平比較 (n=3,x±s)
2.4 神經元特異性敲除HDAC1&2小鼠mTOR信號通路表達
已知mTOR在哺乳動物中樞神經系統(CNS)中對軸突生長發育起正向調節作用[10]。mTOR含有兩種復合體,分別為mTORC1和mTORC2。mTORC1活性的可靠測量方法是檢測下游p-S6的表達情況[13]。研究結果發現,與對照組相比,敲除組小鼠中p-S6的陽性表達相對稀疏和減弱(圖6)。Western blot結果也顯示,敲除組p-S6蛋白表達量(0.72±0.10)較對照組降低(0.99±0.06,t=4.189,P=0.014,n=3)(圖7)。提 示 敲 除HDAC1&2導致小鼠mTORC1通路處于抑制狀態。
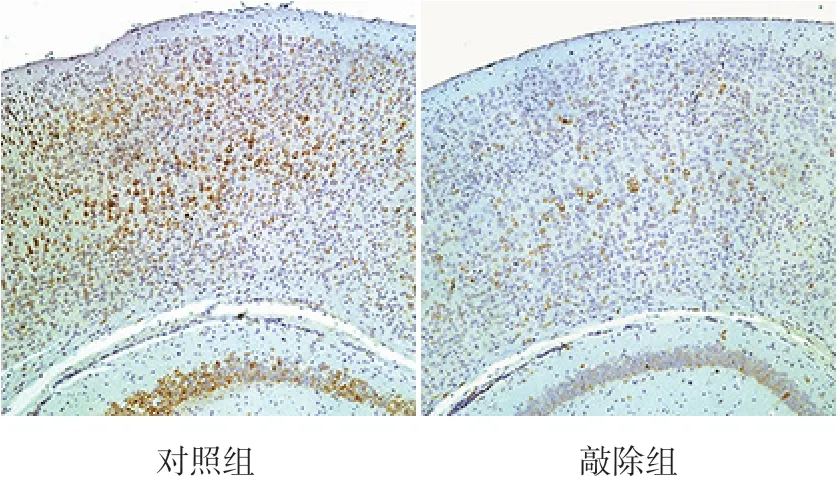
圖6 P14 d小鼠大腦皮質p-S6表達情況(免疫組化染色,×100) 敲除組小鼠大腦皮質胞漿p-S6表達明顯少于對照組,p-S6陽性表達呈棕黃色。
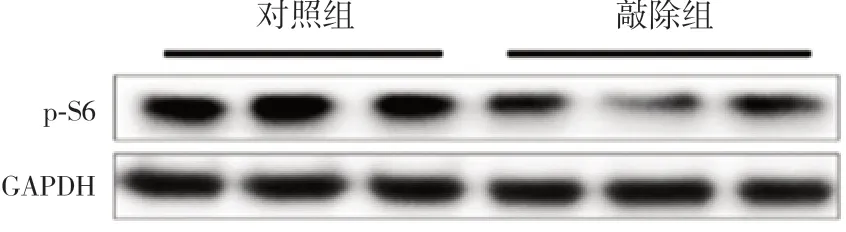
圖7 Western blot檢測P14 d兩組小鼠大腦皮質p-S6表達電泳圖
3 討論
研究表明,HDAC1和HDAC2同時缺失會影響不同類型腦細胞的增殖分化和腦組織的正常發育。為避免全部敲除導致的致命性,通常采用條件敲除的方式來研究HDAC1和HDAC2在中樞和外周神經系統發育過程中的作用[14]。Montgomery等[15]使用hGFAP-Cre條件敲除HDAC1&2,缺失HDAC1&2的神經祖細胞無法分化為成熟神經元并死亡,導致大腦皮質無法正常分層,小鼠出生7 d死亡。皮質神經元由兩種祖細胞,即徑向神經膠質祖細胞(radial glial progenitors, RGPs)和中間祖細胞(intermediate progenitors, IPs)組成。Tang等[4]使用Emx1-Cre在RGPs條件敲除HDAC1&2,小鼠出生不久即死亡;本該遷移到大腦室下區(SVZ)的IPs錯誤定位到腦室表面并分化為神經元,導致大腦皮質大幅減小且無法正常分層。Hagelkruys等[3]使用Nestin-Cre在神經干細胞中條件敲除HDAC1&2,小鼠胚胎期即死亡,伴有整個腦的體積大幅度縮小和大腦皮質空洞、小腦結構受損。這些研究揭示了HDAC1&2在早期神經細胞中調節細胞分化、定位和促進腦結構形成的作用。但是HDAC1&2對神經元發育的影響尚知之甚少。
本研究通過Synapsin1啟動子的Cre重組酶系統建立了在神經元中特異性敲除HDAC1&2的小鼠模型,用于探索HDAC1&2是否參與神經元成熟及軸突形成等過程。相比于其他Cre介導的HDAC1&2缺陷小鼠,Synapsin1-CreHDAC1&2flox/flox小鼠能夠存活較長時間,但通常在1個月內死亡。P11~P13 d開始出現明顯的全身震顫,提起尾巴后肢緊抱現象。成熟神經元標記物NeuN蛋白表達量降低,免疫組化結果顯示相比對照組,敲除小鼠大腦皮質NeuN+數量有所下降。提示缺失HDAC1&2會導致成熟神經元減少。
神經絲是神經元的主要細胞骨架成分,參與軸突、樹突的形成與穩定。未被磷酸化的NF200主要表達于核周胞漿、樹突、大的軸突,而磷酸化的NF200主要在神經元軸突中表達。NF200的磷酸化過程也是NF從胞質運輸并形成軸突的重要步驟。NF200磷酸化過程異常使神經絲排列紊亂,軸突變性,神經元死亡。本實驗中p-NF200及np-NF200表達量均降低,提示缺失HDAC1&2可能影響神經元正常形成細胞骨架,軸突發育不良,進而導致神經元死亡。
通過檢測p-S6蛋白水平,Park等[16]發現切除野生型成年小鼠視網膜神經節的軸突會導致mTOR活性被抑制,新蛋白合成受損;而通過敲除mTOR負調控因子PTEN激活該通路可使軸突再生。mTOR還可以通過調節神經元中特定蛋白質的翻譯來控制軸突形態形成[9]。因此我們對mTORC1下游的p-S6蛋白水平進行了免疫組化與Western blot檢測,發現p-S6表達下降,證明了HDAC1&2敲除鼠的mTOR信號通路被抑制。
綜上,我們發現在小鼠神經元中特異性敲除HDAC1&2使小鼠大腦皮質中的mTOR通路被抑制,伴有成熟神經元數量減少,軸突無法正常生長,小鼠死亡的現象,提示HDAC1&2在神經元正常發育與軸突形成過程中發揮重要作用,并推測該過程與mTOR通路有關。以上發現為新生兒腦發育異常的機制提供了參考,可望為臨床預防和治療腦神經發育異常提供更多線索。

