不同褪黑素治療方案對缺氧缺血性腦損傷新生大鼠腦白質損傷的影響
馬瑞 馬瑜徽 張新月 耿印 陳嵐芬 張學寧 王曉莉
(濰坊醫(yī)學院醫(yī)學影像學院,山東濰坊 261053)
缺氧缺血性腦病(hypoxic-ischemic encephalopathy, HIE)是新生兒圍生期窒息引起的缺氧缺血性腦損傷(hypoxic-ischemic brain damage,HIBD),常可導致腦白質損傷(white matter damage,WMD)[1]。由于腦完整性破壞,腦信息處理速度減慢[2],往往出現學習能力差、記憶力減退等認知障礙的臨床癥狀,是HIBD的重要臨床表現。因此,WMD修復程度是評價HIBD療效的重要指標。研究發(fā)現褪黑素(melatonin, Mel)具有抗炎、抗氧化的作用[3],且可促進未成熟腦白質的修復[4],從而減輕WMD,但不同Mel治療方案對受損腦白質保護作用的差別尚有待于進一步研究[5]。本項目組前期研究發(fā)現Mel可促進HIBD新生大鼠腦內神經干細胞的增殖[6],7日連續(xù)治療(7-day continuous treatment, 7DCT)方案優(yōu)于單次即刻治療(singledose immediate treatment, SDIT),但增殖的神經干細胞能否修復WMD,以及不同Mel治療方案對WMD的作用差別均尚不清楚。因此,本研究采用免疫熒光染色結合行為學實驗法檢測SDIT與7DCT兩種不同Mel治療方案對HIBD大鼠WMD的影響,以期為Mel治療方案的選擇提供科學依據。
1 材料與方法
1.1 實驗動物及分組
SPF級7日齡Sprague-Dawley新生大鼠32只[SCXK(魯)20190003,山東省濟南朋悅實驗動物繁育有限公司],雌雄不限,平均體重(11.8±1.5)g,采用隨機數字表法分為假手術組、HIBD組、SDIT組及7DCT組(n=8)。HIBD后21 d,各組大鼠行Morris水迷宮測試,HIBD后70 d,分別采用神經元核抗原(NeuN)免疫熒光染色法鑒定HIBD模型,并觀察Mel治療對新生大鼠遠期腦損傷的影響,堿性髓鞘蛋白(MBP)/神經絲蛋白重鏈(NF200)免疫熒光雙標法觀察Mel治療對大鼠遠期WMD的影響。
1.2 HIBD模型的建立及各組處理
HIBD組、SDIT組及7DCT組大鼠據經典的Rice-Vannucci法制作HIBD模型[7]。吸入乙醚麻醉,剪開頸部正中皮膚,分離右側頸總動脈,電凝筆(RS-300,Roboz公司,美國)電凝,消毒并縫合皮膚,置于低氧艙(DYC-Ⅰ,武漢七0一研究所)內連續(xù)缺氧(氧艙濃度8%±0.01%)2 h后,放回母鼠籠中喂養(yǎng)。假手術組大鼠僅分離右側頸總動脈,不予電凝及缺氧處理。SDIT組于造模后30 min內腹腔注射1次Mel,5 mg/kg(美國Sigma公司);7DCT組于造模后30 min內腹腔注射Mel,注射7 d,每次5 mg/kg,每天1次。HIBD組與假手術組于造模后30 min內,腹腔注射等量生理鹽水。
1.3 Morris水迷宮測試
HIBD后21 d,選用水迷宮大鼠通用型圓桶(深圳市瑞沃德生命科技有限公司),水池直徑100 cm,高40 cm。適應階段,將大鼠置于無平臺的裝置中,使其自由運動1 min。測試階段于第三象限正中放置直徑8 cm,高23 cm的平臺,沒入水下2 cm。將大鼠面朝固定位置的桶壁放入平臺對側的象限中,大鼠找到并爬上平臺后實驗結束,檢測時間為60 s。若在規(guī)定60 s內大鼠未找到平臺,則將大鼠引導到平臺上并停留15 s,同時記錄該大鼠的逃避潛伏期為60 s。每天每只大鼠測試4次,每次間隔時間1 min,記錄大鼠逃避潛伏期時間,連續(xù)測試5 d。
1.4 標本的收集
HIBD后70 d,10%水合氯醛麻醉,常規(guī)心臟灌注后取腦組織,4%多聚甲醛固定24 h,梯度乙醇脫水、二甲苯透明,浸蠟、石蠟包埋,分別取側腦室至海馬層面腦組織行冠狀位連續(xù)切片,厚度為4 μm,每4~5張腦片取1張,分別行NeuN免疫熒光及MBP/NF200免疫熒光雙標染色。
1.5 NeuN免疫熒光染色
各組每只大鼠分別取腦組織石蠟切片5~6張,梯度乙醇進行脫蠟至水,采用水浴熱修復法進行抗原修復,血清封閉后,棄掉封閉液,加入小鼠抗大鼠NeuN一抗(1 : 100,Chemicon,美國)混合液,4℃冰箱孵育過夜。次日,充分洗滌后,加入Alexa Fluor 594標記的山羊抗小鼠熒光二抗(1 : 100,北京中杉金橋生物技術有限公司),37℃避光孵育1 h后,0.01 mol/L PBS沖洗,含6-二脒基-2-苯基吲哚(DAPI)的熒光封片劑(F6057,Sigma,美國)封片。每張切片隨機取5個視野,正置熒光顯微鏡下觀察、拍照,并計數大腦皮質及海馬CA1區(qū)NeuN+細胞數。
1.6 MBP/NF200免疫熒光雙標染色
各組每只大鼠分別取腦組織石蠟切片5~6張,同1.5方法處理切片,水浴熱修復法修復抗原,37℃血清封閉后,加入小鼠抗大鼠NF200(1 : 500,Cell Signaling Technology,美國)與兔抗大鼠MBP(1 : 75,武漢博士德)一抗混合液,4℃冰箱孵育過夜。次日,充分洗滌后,滴加Alexa Fluor 488標記的山羊抗兔IgG(1 : 100)和山羊抗小鼠IgG(1 : 100)熒光二抗(北京中杉金橋生物技術有限公司)混合液,37℃避光孵育1 h后沖洗,含DAPI熒光封片劑封片。每張切片隨機取5個視野,正置熒光顯微鏡下拍照,并采用Image J軟件分析腦組織紋狀體區(qū)、胼胝體區(qū)熒光強度(fluorescense intensity, FI),即FIMBP、FINF200。
1.7 統(tǒng)計學分析
采用SPSS 22.0統(tǒng)計學軟件對數據進行統(tǒng)計學分析,計量資料采用均數±標準差(x±s)表示,多組間比較采用單因素方差分析,組間兩兩比較采用SNK-q檢驗,P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1 各組新生大鼠Morris水迷宮測試結果
HIBD后21 d,Morris水迷宮測試結果顯示各組大鼠逃避潛伏期比較差異有統(tǒng)計學意義(F=97.29,P<0.001,n=8)。HIBD組大鼠逃避潛伏期[(43.2±3.5)s]較假手術組[(21.3±2.1)s]顯著延長(P<0.05)。SDIT組[(31.4±2.8)s]和7DCT組[(25.3±2.4)s]大鼠逃避潛伏期均較HIBD組顯著縮短(P<0.05),但仍長于假手術組(P<0.05);且7DCT組逃避潛伏期短于SDIT組(P<0.05)。見圖1。
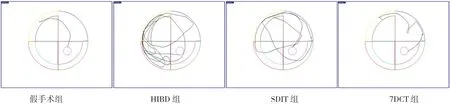
圖1 不同褪黑素治療方案對HIBD新生大鼠Morris水迷宮測試的影響 假手術組大鼠水中活動路徑最短最簡單,HIBD組大鼠水中活動路徑最長最復雜,SDIT組大鼠水中活動路徑較長較復雜,7DCT組大鼠水中活動路徑較短較簡單。
2.2 各組新生大鼠大腦皮質及海馬CA1區(qū)神經元個數變化
NeuN是成熟神經元的標記物,新生大鼠HIBD后,大腦皮質與海馬CA1區(qū)是神經元易受損傷的腦區(qū)。本研究分別觀察HIBD后,各組大鼠大腦皮質及海馬CA1區(qū)NeuN+細胞數的變化。HIBD后70 d(生后77 d),假手術組大鼠大腦皮質及海馬CA1區(qū)均可見大量NeuN+細胞,細胞分布均勻,排列整齊;HIBD組新生大鼠NeuN+細胞數較假手術組顯著減少(P<0.05),細胞排列不整齊;SDIT組與7DCT組均可見NeuN+細胞多于HIBD組,但仍少于假手術組(P<0.05);且7DCT組NeuN+細胞數顯著多于SDIT組(P<0.05)。見圖2、表1。
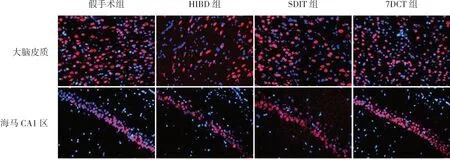
圖2 不同褪黑素治療方案對HIBD新生大鼠NeuN+細胞的影響(免疫熒光染色,×400) NeuN是成熟神經元的標記物,NeuN+細胞核染為紅色,DAPI+細胞核染為藍色。假手術組大腦皮質及海馬CA1區(qū)均可見大量NeuN+細胞;HIBD組NeuN+細胞明顯少于假手術組;SDIT組及7DCT組NeuN+細胞均多于HIBD組,但仍少于假手術組;且7DCT組NeuN+細胞多于SDIT組。
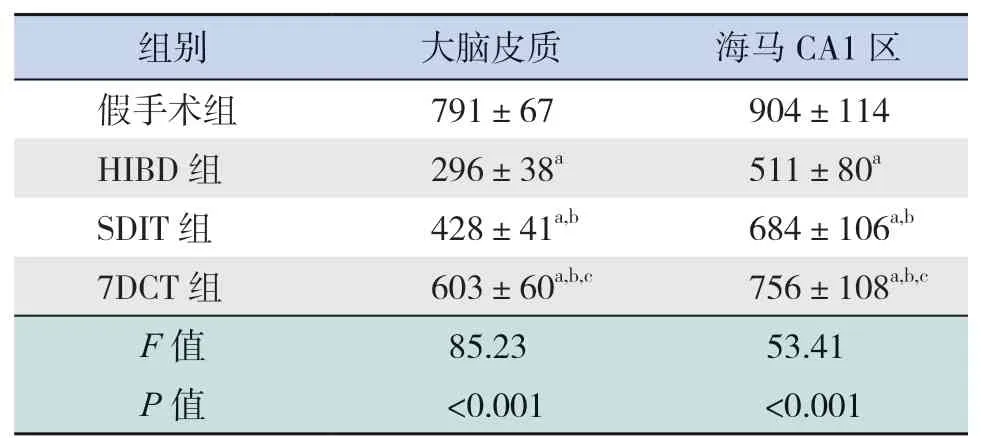
表1 各組大鼠大腦皮質及海馬CA1區(qū)NeuN+細胞數比較(個/mm2,n=8)
2.3 各組新生大鼠大腦紋狀體及胼胝體區(qū)FIMBP、FINF200變化
MBP包繞在NF200周圍構成有髓神經纖維,本研究觀察各組大鼠大腦紋狀體與胼胝體區(qū)MBP及NF200蛋白表達的變化。MBP染為綠色熒光,包繞在NF200(染為紅色熒光)的周圍。
HIBD后70 d,假手術組大鼠大腦紋狀體區(qū)可見大量MBP及NF200蛋白表達;與假手術組相比,HIBD組大鼠大腦紋狀體區(qū)FIMBP、FINF200均降低(P<0.05);SDIT組和7DCT組大鼠大腦紋狀體區(qū)FIMBP、FINF200顯著高于HIBD組(P<0.05),但仍低于假手術組(P<0.05);且7DCT組FIMBP、FINF200顯著高于SDIT組(P<0.05)。見圖3、表2。
HIBD后70 d,假手術組大鼠大腦胼胝體區(qū)可見大量MBP及NF200蛋白表達;與假手術組相比,HIBD組和SDIT組大鼠大腦胼胝體區(qū)FIMBP、FINF200均降低(P<0.05),但HIBD組和SDIT組大鼠大腦胼胝體區(qū)FIMBP、FINF200比較差異無統(tǒng)計學意義(P>0.05);7DCT組大鼠大腦胼胝體區(qū)FIMBP、FINF200顯著高于SDIT組和HIBD組,但仍低于假手術組(P<0.05)。見圖4、表3。
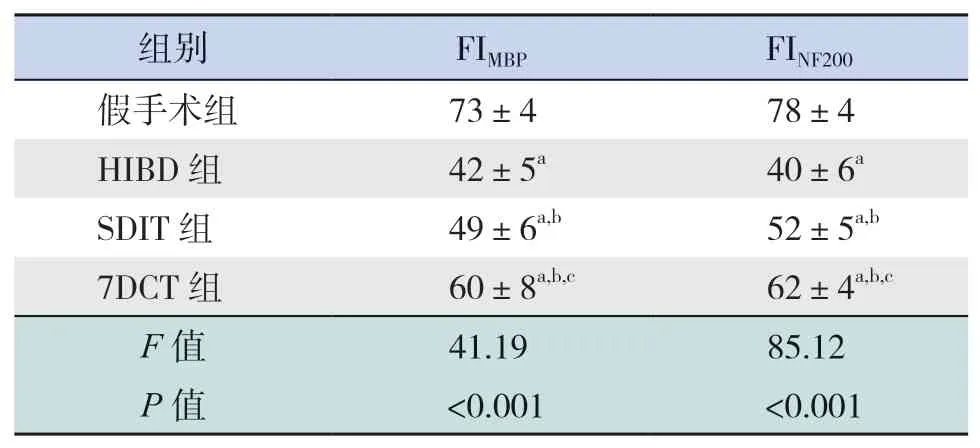
表2 各組大鼠大腦紋狀體區(qū)FIMBP及FINF200比較(x±s,n=8)
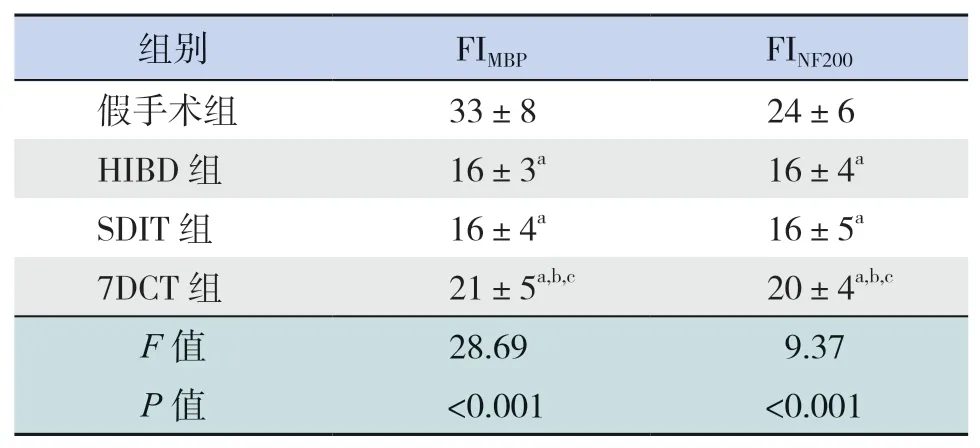
表3 各組大鼠大腦胼胝體區(qū)FIMBP及FINF200比較(x±s,n=8)
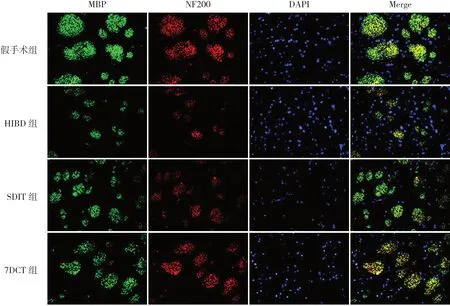
圖3 不同褪黑素治療方案對HIBD新生大鼠大腦紋狀體區(qū)髓鞘及軸突損傷的影響(MBP/NF200免疫熒光雙標染色,×400) MBP標記髓鞘,染為綠色;NF200標記神經纖維絲蛋白,染為紅色;DAPI標記細胞核,染為藍色;MBP+NF200+標記神經纖維束。假手術組可見大量髓鞘蛋白及神經纖維絲蛋白表達,神經纖維束完整;HIBD組僅見少量髓鞘蛋白及神經纖維絲蛋白表達,神經纖維束不完整;SDIT組和7DCT組可見較多髓鞘蛋白及神經纖維絲蛋白表達,且7DCT組神經纖維束較SDIT組更完整。
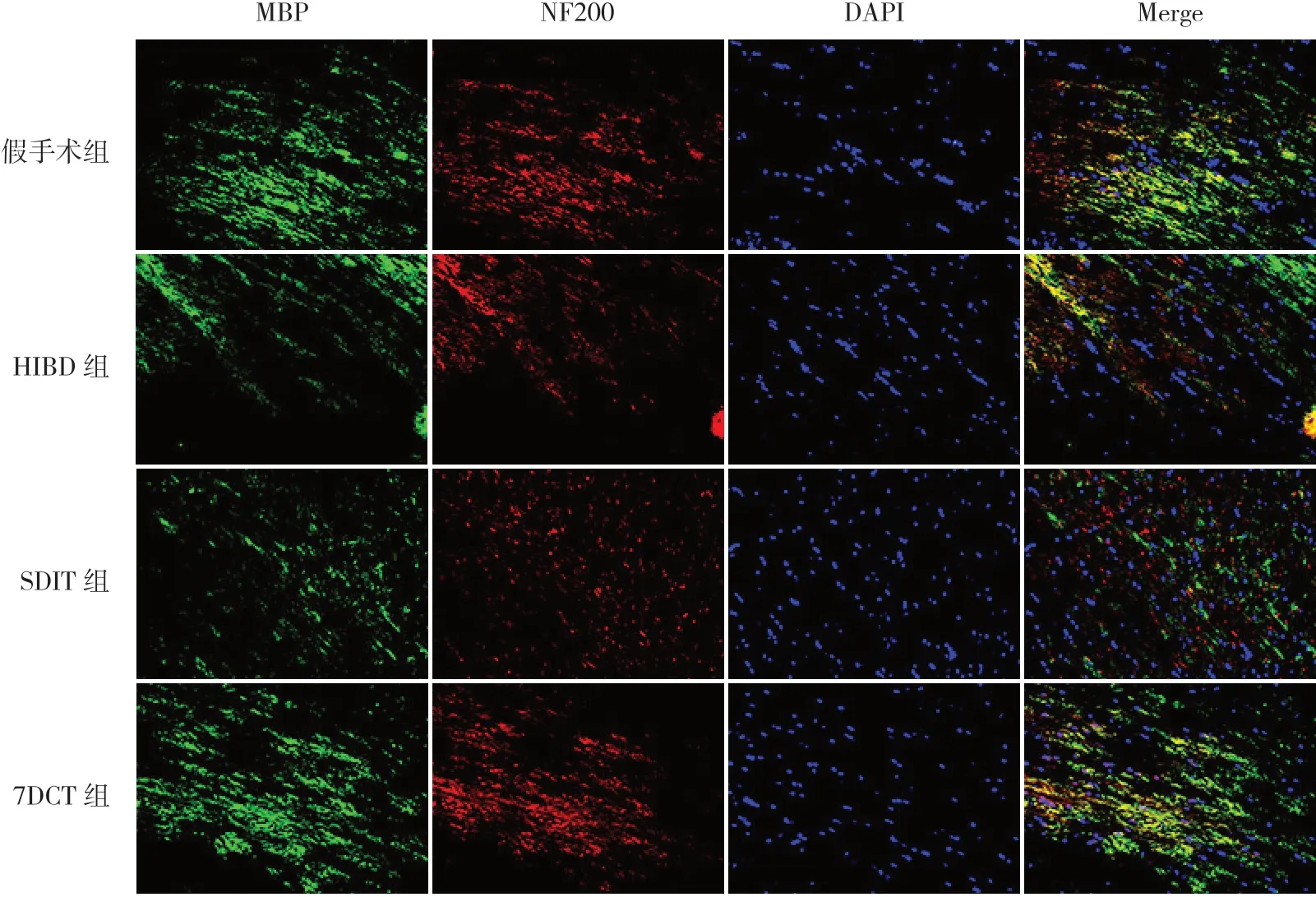
圖4 不同褪黑素治療方案對HIBD新生大鼠大腦胼胝體區(qū)髓鞘及軸突損傷的影響(MBP/NF200免疫熒光雙標染色,×400) MBP標記髓鞘,染為綠色;NF200標記神經纖維絲蛋白,染為紅色;DAPI標記細胞核,染為藍色;MBP+NF200+標記神經纖維束。假手術組可見大量髓鞘蛋白及神經纖維絲蛋白表達,神經纖維束完整;HIBD組和SDIT組均可見少量髓鞘蛋白及神經纖維絲蛋白表達,神經纖維束不完整;7DCT組可見較多髓鞘蛋白及神經纖維絲蛋白表達,神經纖維束較HIBD組及SDIT組更完整。
3 討論
圍生期窒息可導致癲癇、腦癱等后遺癥,發(fā)病癥狀與WMD密切相關。鑒于新生兒具有較強的再生能力與神經修復潛能,如果早期給予干預治療可減輕WMD。本課題組前期研究發(fā)現Mel的7DCT方案可更易促進腦內源性神經干細胞的增殖,研究還發(fā)現Mel可改善腦內微環(huán)境,減輕WMD[8],但不同治療方案對HIBD新生大鼠WMD的影響尚未見報道,本課題組就此科學問題展開研究,以期為較優(yōu)Mel治療方案的選擇提供科學依據。
NeuN是成熟神經元的常用標記物,本研究采用NeuN免疫熒光染色法分別觀察各組大鼠大腦皮質與海馬CA1區(qū)神經元的變化,結果發(fā)現HIBD組神經元數少于假手術組,提示造模成功,這與文獻報道一致[9]。SDIT組和7DCT組新生大鼠成熟神經元數多于HIBD組,且7DCT組陽性細胞數多于SDIT組,提示本研究Mel治療HIBD有效,且7DCT治療方案的療效優(yōu)于SDIT。
行為學檢測可反映動物運動機能和精神狀態(tài),是觀察治療后WMD修復的可靠手段。Morris測試結果顯示,SDIT組和7DCT組大鼠平均逃避潛伏期時間均短于HIBD組,且7DCT組平均逃避潛伏期時間短于SDIT組,提示兩種Mel治療方案均可從行為學水平改善大鼠空間記憶能力,且7DCT組更優(yōu),其機制可能與7DCT更易減輕HIBD后腦白質區(qū)髓鞘和神經纖維束損傷,有助于改善大鼠運動和空間記憶能力有關[10],但7DCT如何減輕HIBD新生大鼠腦白質區(qū)髓鞘和神經纖維束的損傷尚不清楚,Mel減輕WMD是否與其促進HIBD新生大鼠內源性神經再生有關尚不清楚,而不同Mel治療方案對HIBD新生大鼠遠期行為學的影響尚有待更多行為學實驗驗證。
腦白質是大腦發(fā)揮高級功能的重要部位。神經沖動沿有髓神經纖維跳躍傳導是大腦處理外界信息的重要保障。神經信號的傳導速度與神經軸突及其周圍的髓鞘密切相關。HIE發(fā)生后,腦白質脫髓鞘致使神經傳導受累,損害機體行為認知功能[11]。MBP是髓鞘的標記物,NF200為神經絲蛋白的標記物,本實驗于HIBD后70 d行MBP/NF200免疫熒光雙重染色,以觀察不同Mel治療方案對大鼠大腦紋狀體區(qū)及胼胝體區(qū)有髓神經纖維束的保護作用。結果顯示,SDIT和7DCT組大鼠大腦紋狀體區(qū)FIMBP、FINF200高于HIBD組,且7DCT組高于SDIT組,提示SDIT與7DCT兩種Mel治療方案均可減輕大腦紋狀體區(qū)神經纖維束損傷,7DCT方案療效較優(yōu)。7DCT組大鼠大腦胼胝體區(qū)FIMBP、FINF200高于HIBD組,而SDIT組大鼠大腦胼胝體區(qū)FIMBP、FINF200與HIBD組無差別,提示7DCT治療方案可減輕大鼠大腦胼胝體區(qū)神經纖維束損傷,且療效優(yōu)于SDIT。
綜上,兩種Mel治療方案均可減輕新生大鼠HIBD后WMD,并改善大鼠運動和空間記憶能力,且7DCT治療方案療效較優(yōu)。

