C與SiO2反應的熱力學分析
潘書恒 程萍
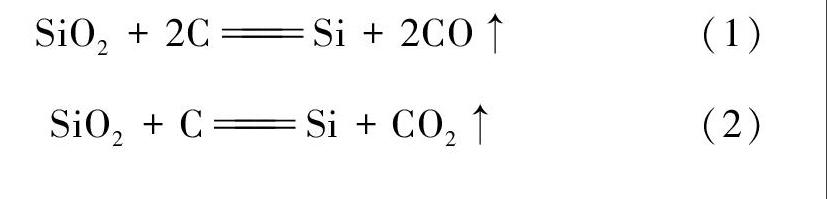

摘要: 從熱力學角度分析C與SiO2反應生成CO而非CO2的原因;指出在實際生產溫度下,Si和SiO2均呈液態,理論上不應引用298K時的生成焓與標準熵;計算了2200K時反應的熱力學函數,并進一步討論了298~2500K溫度范圍內反應焓變與熵變對298K時相應數值的偏離情況,繪制了較精確的ΔrGθm-T圖;發現對于C與SiO2的反應而言,在此溫度范圍內,熱力學函數對298K時相應數值的偏離程度較小。
關鍵詞: C與SiO2反應; 非常溫反應; 物態變化; 熱力學分析
文章編號: 1005-6629(2021)02-0091-08
中圖分類號: G633.8
文獻標識碼: A
1? 問題的提出
在高中元素化合物知識的學習中,學生常常會對一些化學反應產生疑惑,其中一例便是: 為什么C與SiO2反應得到的產物是CO,而不是CO2?對于這一問題,如果教師以“實驗事實就是如此”回應學生,將不利于學生探究與質疑精神的發展,甚至可能給學生留下“化學反應不講理,需要死記硬背”的不良印象。從熱力學角度對該反應展開討論,分析C與SiO2反應生成CO的原因,同時分析不同溫度下反應的焓變與熵變對298K時相應數據的偏離情況,可為從熱力學角度研究非常溫反應,尤其是物質的物態與298K時不同的反應,提供一種思路。
2? C與SiO2的反應
對于C與SiO2反應為什么生成CO這一問題,有些教師一般解釋為: 由于實際生產中C是過量的,即使反應生成了CO2,后者在高溫下也會進一步與C反應,最終生成CO。這樣的解釋乍一看很合理,然而可能會引起學生這樣的認識: 如果是少量C與過量SiO2反應,應該就能生成CO2。實際情況真是如此嗎?
2.1? C與SiO2反應的熱力學分析
化學熱力學研究化學反應的方向和限度問題,對于一個等溫等壓不做非體積功的反應,如果以反應中各物質的濃度或壓力為1mol·kg-1或100kPa為研究狀態,那么可以用標準摩爾反應吉布斯自由能變ΔrGθm(簡稱為反應自由能)判斷反應的自發性。若ΔrGθm<0,表示反應在標準狀態下能正向自發進行;反之,若ΔrGθm>0,則反應在標準狀態下逆向自發進行。ΔrGθm與反應溫度相關,在一定溫度(T)下,ΔrGθm(T)=ΔrHθm(T)-TΔrSθm(T),其中ΔrHθm與ΔrSθm分別為標準摩爾反應焓變(簡稱為反應焓)和標準摩爾反應熵變(簡稱為反應熵),若它們的量值隨溫度變化較小,常用298K時的量值代替。ΔrHθm與ΔrSθm可由反應中各物質的標準摩爾生成焓ΔfHθm(簡稱為生成焓)與標準摩爾熵Sθm(簡稱為標準熵),通過公式ΔrHθm=∑νBΔfHθm(B)與ΔrSθm=∑νBSθm(B)計算得出,式中B表示反應物或生成物,νB表示反應物或生成物在方程式中的計量數,對生成物νB取正值,反應物νB取負值[1]。
對于C與SiO2反應得到何種氧化產物的熱力學分析,即是考察下述反應(1)和(2)的反應自發性。反應中相關物質在298K時的生成焓與標準熵如表1所示注: 本文中所有熱力學數據均取自葉大倫主編《實用無機物熱力學數據手冊(第2版)》[2]。;根據表1不難算得兩個反應的焓變和熵變,進而得到反應自由能的表達式;令ΔrGθm=0,即可得到反應的轉化溫度,如表2所示。
SiO2+2CSi+2CO↑(1)
SiO2+CSi+CO2↑(2)
從表2可看出,兩個反應都是吸熱、熵增的反應,升高溫度有利于反應正向進行。當反應溫度高于1914.2K時,反應(1)(生成CO)在熱力學上能自發進行;當溫度高于2808.0K時,反應(2)(生成CO2)在熱力學上能自發進行。工業上制粗硅的實際生產溫度在1800~2000℃[3],即2073~2273K,超過了反應(1)的轉化溫度,但未達到反應(2)的轉化溫度。故在實際生產條件下,C還原SiO2得到的氧化產物為CO。
將兩個反應的ΔrGθm隨溫度的變化情況繪于圖1,從圖中不難看出,隨著溫度升高,兩個反應的ΔrGθm數值都越來越小,說明反應傾向性逐漸增大。但需要注意的是,僅憑此圖不宜作出如下判斷: 由于同一溫度時,反應生成CO的ΔrGθm始終低于生成CO2的ΔrGθm,
說明反應更傾向于生成CO,因而C還原SiO2始終只能得到CO。這一判斷的問題在于,忽略了ΔrGθm只能用于判斷一個反應自身的反應自發性,而不能用于比較不同反應的傾向性大小。吳國慶教授曾寫文指出[4],不能用Fe3O4的生成自由能ΔfGθm數值比FeO、 Fe2O3更小,來說明Fe在O2中燃燒為何生成Fe3O4,因為不同反應的ΔrGθm之間不具有可比性;而要對比鐵和氧化合生成上述三種氧化物的反應傾向性大小,最簡單的理論模型是考察它們相互轉化反應的自發性,如反應4Fe3O4+O26Fe2O3的ΔrGθm。
那么,反應生成的CO是否有可能進一步還原SiO2而得到CO2呢?不妨考察下述反應(3)的自發性:
SiO2+2COSi+2CO2(3)
由表1不難求得,298K時反應(3)的ΔrHθm=342.43kJ·mol-1, ΔrSθm=7.66J·K-1·mol-1,同樣是吸熱、熵增的反應,但轉化溫度高達44704K,即反應(3)實際上無法發生,故C與SiO2反應生成CO在熱力學上是穩定的。
2.2? 高溫致物態發生變化的反應熱力學分析
仔細審視圖1不難發現問題: 直線不可能無限延伸。根據ΔrGθm=ΔrHθm-TΔrSθm可知,直線的斜率即-ΔrSθm。嚴宣申教授指出[5],不同溫度下反應的ΔrHθm和ΔrSθm近似為定值的條件是各物質的物態應和298K時相同。而隨著反應溫度的提高,Si和SiO2的物態將由固態變為液態,甚至是氣態;因而在物態發生變化后,理論上不應再引用298K時的ΔrHθm和ΔrSθm數值,ΔrGθm-T圖也不會是直線。
事實上,Si和SiO2的熔點分別為1685K和1996K,在實際生產溫度下(2073~2273K)均為液態,因而上述分析中引用298K時的ΔrHθm和ΔrSθm數值并不嚴謹。
在本文引用的《實用無機物熱力學數據手冊》中,可以查到反應中各物質在2200K時的生成焓與標準熵,經計算可得反應的反應焓、反應熵與轉化溫度,如表3所示。
從表3可以看出,2200K時兩個反應的ΔrHθm和ΔrSθm與298K時的數值相比,變化并不大;轉化溫度的差值也不足30K。由于反應(3)(SiO2+2COSi+2CO2)的焓變和熵變可通過蓋斯定律得到: (3)=(2)×2-(1),因而可推斷反應(3)的相應數值也無明顯變化。故2.1的結論在2200K時仍然成立。
這是偶然現象嗎?還是說,由于Si和SiO2在2200K時都呈液態,且一為反應物一為生成物,這種相變引起的物質熱力學函數的變化在計算反應的熱力學函數時被抵消了?是不是當反應中只有一種物質發生相變時,這種差異就會顯著出現呢?要回答這些問題,需要對不同溫度下反應焓變與熵變對298K時數值的偏離情況進行研究。
2.3? 不同溫度下ΔrHθm(T)和ΔrSθm(T)對ΔrHθm(298K)和ΔrSθm(298K)的偏離
當一定溫度范圍內,反應中各物質均不存在物態變化時,根據反應焓、反應熵與溫度的關系,有[6]:
ΔrHθm(T2)=ΔrHθm(T1)+∫T2T1ΔCpdT(1)
ΔrSθm(T2)=ΔrSθm(T1)+∫T2T1ΔCpTdT(2)
式中ΔCp=∑νBCp, m(B), Cp, m(B)表示反應物或生成物的等壓摩爾熱容,νB表示物質在反應中的計量數。
Cp, m、 ΔCp與T的關系可以用經驗式表示[7]:
Cp, m=A1+A2×10-3T+A3×105T-2+A4×
10-6T2(J·K-1·mol-1)(3)
ΔCp=∑νBCp,m(B)=ΔA1+ΔA2×10-3T+ΔA3×
105T-2+ΔA4×10-6T2(4)
式中Ai為常數,ΔAi=∑νBAi(B), i=1~4。
而當溫度范圍內存在物態變化時,由于相變物質Cp, m的變化,及相變焓與相變熵的存在,反應的焓變與熵變需分段計算。
C與SiO2的反應中,各物質的A1~A4數值及相變焓與相變熵如表4所示。取表4中各物質的公共溫度范圍(298~2500K)為研究對象,以物質的A1~A4數值出現變化為依據對公共溫度范圍分段,可算得兩個反應在各溫度段下的ΔA1~ΔA4。
將ΔA1~ΔA4代入∫T2T1ΔCpdT與∫T2T1ΔCpTdT,得到關于T的多項式,運用Origin 2017軟件的函數計算功能,可得積分項在各溫度區間內的數值范圍及變化情況,如表5所示。
物態變化對ΔrHθm和ΔrSθm的影響可通過圖2的反應模型得到: 當生成物發生相變時,
相變焓與相變熵對反應的焓變與熵變有正貢獻;相反,當反應物發生相變時,相變焓與相變熵對反應的焓變與熵變有負貢獻。以計算1000K時反應(1)的ΔrHθm為例: 在298K到1000K的溫度范圍內,在543K時反應物SiO2發生了晶型轉變,若用ΔHCT(SiO2)表示SiO2晶型轉變中的相變焓,則有ΔrHθm(1000K)=ΔrHθm(298K)+∫543298ΔCpdT-ΔHCT(SiO2)+∫1000543ΔC′pdT;反應熵變的計算方法與此類似,不作贅述。
TM(B):A(s)ΔrHθm(TM,1)B(s)
ΔH=0ΔHM(B)
TM(B):A(s)ΔrHθm(TM,2)B(1)
ΔrHθm(TM,2)=ΔrHθm(TM,1)+ΔHM(B)
TM(A):A(s)ΔrHθm(TM,1)B(s)
ΔHM(A)ΔH=0
TM(A):A(1)ΔrHθm(TM,2)B(s)
ΔrHθm(TM,2)=ΔrHθm(TM,1)-ΔHM(A)
注: TM(B)表示B的熔點,ΔHM(B)表示B的相變焓;TM(A)和ΔHM(A)含義類似。相變熵對反應熵變影響的分析與此相同。
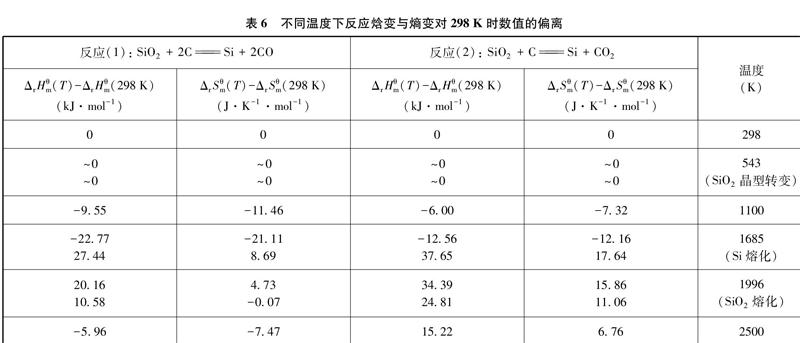
同時考慮積分項與物態變化對ΔrHθm和ΔrSθm的影響,可得不同溫度下反應焓變與熵變對298K時數值的偏離情況,如表6、圖3和圖4所示。
從上述圖表中不難得到以下信息: 對于C還原SiO2的反應而言,不論生成CO還是生成CO2,在溫度較低、各物質物態與298K相同時(298~543K),ΔrHθm和ΔrSθm對298K時數值的偏離很小,可幾乎視為定值;而當反應中僅反應物的物態與298K不同時(543~1685K),隨溫度升高,這種偏離逐漸增大;當反應中生成物也發生物態變化時,這種偏離可能因抵消而減小[圖4中1685K前后反應(1)的情況],也可能反向增大[圖3中1685K前后兩個反應的情況,及圖4中1685K前后反應(2)的情況];而從整體來看,在298~2500K的溫度范圍內,對反應(1)而言,ΔrHθm(T)對ΔrHθm(298K)(687.27kJ·mol-1)的最大偏離值為27.44kJ·mol-1,最大偏離率為4.0%;ΔrSθm(T)對ΔrSθm(298K)(359.04J·K-1·mol-1)的最大偏離值為-21.11J·K-1·mol-1,最大偏離率為5.9%。對反應(2)而言,ΔrHθm(T)對ΔrHθm(298K)(514.85kJ·mol-1)的最大偏離值為37.65kJ·mol-1,最大偏離率為7.3%; ΔrSθm(T)對ΔrSθm(298K)(183.35J·K-1·mol-1)的最大偏離值為17.64J·K-1·mol-1,最大偏離率為9.6%;兩個反應的最大偏離點均位于Si熔化前后,最大偏移率均在10%之內。
同時不難發現,一個反應的焓變與熵變對298K時相應數值的偏離程度未必隨溫度的升高而增大;物態變化也未必導致偏離程度的增大;偏離程度取決于反應的ΔCp及相變情況(包括與298K時的物態相比,存在一次相變還是多次相變,相變物質是反應物還是生成物,相變焓與相變熵的相對大小等),需要具體問題具體分析。
2.4? 不同溫度下反應的ΔrGθm與溫度的關系
將表6中各溫度區間內反應焓變與熵變對298K時相應數值偏離值的均值,作為該溫度區間反應焓變與熵變偏離值的代表。例如,1100~1685K范圍內反應(1)的焓變偏離值,即取表6中1100K和1685K時相應偏離值(-9.55和-22.77)的均值-16.16,此時這種近似處理引入的最大誤差為[(-16.16)-(-22.77)]/687.27=1.0%。
經計算,對兩個反應在各溫度區間內的反應焓變與熵變偏離值做這種均值近似處理
引起的誤差≤2.1%,可以忽略不計。用此種均值近似方法得到的反應焓變、熵變、自由能,與2.1中將反應焓變與熵變視為298K下定值時算得的自由能,前者對后者的偏離值如表7所示,兩種方法得到的ΔrGθm-T對比圖如圖5所示。
從圖5可看出,C與SiO2反應的ΔrGθm-T圖并非是一條直線,但與將反應焓變與熵變視為定值得到的ΔrGθm-T直線圖間的偏離不大;可見,在298~2500K的溫度范圍內,即使物質的物態發生了變化,引用298K時的反應焓變與熵變也不致引起較大偏差。
但需注意的是,這一結論不能無限外推,尤其是當反應中一種物質的物態變為氣態后,
反應熵可能出現明顯的變化,此時ΔrGθm-T圖可能出現明顯的轉折點,見圖6[8][沸點: b.p.(Hg)=630K, b.p.(Mg)=1364K, b.p.(Ca)=1757K]。
3? 結語
熱力學分析表明,C與SiO2反應傾向于生成CO;在實際生產溫度下,生成CO2的反應是非自發的。當Si和SiO2的物態與298K時不同時,理論上不應引用298K時物質的生成焓與標準熵數據。但通過計算發現,對于C與SiO2的反應而言,在298~2500K的溫度范圍內,反應的焓變與熵變對298K時數值的偏離程度不大(10%以內),最大偏離點位于Si熔化前后;同時,該溫度范圍內反應的ΔrGθm-T圖,接近將反應焓變與熵變視為定值得到的ΔrGθm-T直線圖。但這一結論不能無限外推,對于一般的反應而言,這種偏離程度需根據反應的ΔCp及相變情況作具體分析。
參考文獻:
[1][6]傅獻彩, 沈文霞, 姚天揚等. 物理化學·上冊(第5版)[M]. 北京: 高等教育出版社, 2005: 105, 113.
[2][7]葉大倫, 胡建華. 實用無機物熱力學數據手冊(第2版)[M]. 北京: 冶金工業出版社, 2002.
[3]人民教育出版社, 課程教材研究所, 化學課程教材研究開發中心. 化學(必修第二冊)[M]. 北京: 人民教育出版社, 2020: 22.
[4]吳國慶. 鐵絲在氧氣里燃燒的產物[J]. 中學化學教學參考, 2002, (6): 9~10.
[5]嚴宣申. 談化學熱力學狀態函數的運用[J]. 化學教育, 2011, 32(1): 73~77.
[8]嚴宣申. 化學原理選講[M]. 北京: 北京大學出版社, 2012: 35.

