特發性肺纖維化急性加重四例報道并文獻復習
鄒麗君 ,范宇斌 ,蔣國良 ,孟婕
特發性肺纖維化(idiopathic pulmonary fibrosis,IPF)是臨床最常見的一種特發性間質性肺炎,病變局限于肺部,組織病理表現為肺結構明顯受損和纖維化,伴或不伴胸膜下蜂窩樣改變;肺實質呈斑片狀纖維化及出現纖維母細胞灶,患者主要臨床表現為勞力性呼吸困難、干咳、Velcro啰音和杵狀指[1]。IPF主要依據肺部高分辨CT(HRCT)和/或病理活檢進行診斷,典型表現為普通型間質性肺炎(UIP)癥狀。IPF患者肺功能在1個月內急劇惡化稱為IPF急性加重(AEIPF)。美國胸科學會(ATS)、歐洲呼吸學會(ERS)、日本呼吸學會(JRS)、拉丁美洲胸科學會(ALAT)聲明提出,手術可導致AE-IPF發生[1]。參考2016年COLLARD等[2]修訂內容,AE-IPF的診斷標準如下:(1)既往或目前診斷為IPF;(2)出現典型急性呼吸困難癥狀或癥狀惡化時間<1個月;(3)胸部CT檢查提示UIP,并出現新的雙側磨玻璃影伴或不伴實變影:(4)可排除心力衰竭或液體超負荷。有研究表明,AE-IPF患者預后較差,生存期<1年,90 d內死亡率約為50%[3-5]。手術可引發AE-IPF,但目前國內僅報道3例[6-7]。本文通過報道4例AE-IPF患者的診療經過,并結合既往文獻對AE-IPE進行分析,以提高臨床醫師對AE-IPF的認識。
1 病歷簡介
1.1 病例1 患者,女,59歲,因“咳嗽、氣促1年余,再發加重1月余”于2018-12-18就診于中南大學湘雅醫院。患者于2018-10-22因咳嗽、氣促于當地醫院進行胸部HRCT檢查,結果示UIP,見圖1A;2018-10-26行外科胸腔鏡下肺組織活檢,病理結果示IPF,見圖1B。故予以甲潑尼龍片20 mg、1次/d及吡非尼酮進行抗炎、抗纖維化等治療。2018-11-14患者咳嗽、咳痰、氣促明顯加重,無發熱、畏寒、寒戰,為求進一步治療就診于本院。
患者入院時體溫36.5 ℃、脈搏98次/min、呼吸頻率23次/min、血壓118/72 mm Hg(1 mm Hg=0.133 kPa),呈滿月臉,急性病容,雙肺呼吸音粗,可聞及Velcro啰音,杵狀指。2009年曾行膽囊切除術,2015年曾行鼻息肉手術。無不良婚育史,無家族遺傳病史。實驗室檢查:白細胞計數(WBC)10.3×109/L,中性粒細胞百分比(NE%)85.6%,淋巴細胞百分比(LYM%)6.1%;D-二聚體0.1 mg/L(參考范圍<0.50 mg/L),C反應蛋白(CRP)、降鈣素原(PCT)、紅細胞沉降率(ESR)、N末端腦鈉肽前體(NT-proBNP)、肌鈣蛋白、心肌酶譜、1,3-β-D葡聚糖檢測(G試驗)、半乳糖甘露醇聚糖抗原檢測(GM試驗)、風濕及自身免疫性疾病檢查未見明顯異常,多次支氣管灌洗液培養結果陰性,且復查胸部HRCT示雙肺新發彌漫性磨玻璃影,見圖1C,故診斷為AEIPF。予以甲潑尼龍琥珀酸鈉240 mg、1次/d,治療2 d后減量至80 mg、1次/d,持續治療1周,吡非尼酮400 mg、3次/d。2018-12-29,患者復查胸部CT示雙肺磨玻璃影較前吸收、好轉,見圖1D。患者病情穩定,于2018-12-31出院。出院后,患者繼續口服潑尼松(1 mg/kg)并逐漸減量(每2周減量1片,后以5 mg/d維持),6個月后停用,患者2020年8月再發呼吸困難,于當地醫院診斷為急性呼吸窘迫綜合征,最終死亡。
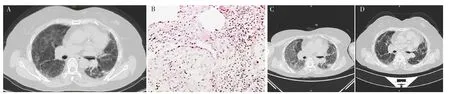
圖1 患者1肺組織病理及胸部HRCT檢查Figure 1 Pathological features of lung biopsy and chest HRCT examination of patient 1
1.2 病例2 患者,男,56歲,因“嘔血、黑便9 d”于2019-09-11就診于中南大學湘雅醫院。患者9 d前無明顯誘因出現嘔血、黑便,于當地醫院進行胃鏡及病理活檢,確診為賁門唇腺鱗癌、胃竇低分化腺癌,故轉入本院進一步治療。患者入院時體溫36.2 ℃,脈搏76次/min,呼吸頻率15次/min,血壓120/85 mm Hg,雙下肺可聞及Velcro啰音。患者2年前確診為IPF,但未進行治療。吸煙史40年,20支/d,未戒煙。婚育史及家族遺傳病史無特殊。胸部HRCT檢查示UIP,見圖2A,余檢查未見異常。2019-09-25,患者行食管癌胃癌根治術;術后第3天,患者出現咳嗽、咳痰、呼吸困難,術后實驗室檢查:WBC 9.2×109/L,NE% 82.8%,LYM%10.5%;D-二聚體0.15 mg/L,CRP、PCT、ESR、G試驗、GM試驗、NT-proBNP、心肌酶譜、肌鈣蛋白未見明顯異常;多次支氣管肺泡灌洗液培養及支氣管灌洗液高通量測序結果均陰性,復查胸部HRCT示雙肺新發廣泛磨玻璃影,見圖2B,考慮AE-IPF。予以環磷酰胺0.2 g、隔天1次+甲潑尼龍琥珀酸鈉240 mg、1次/d+吡非尼酮200 mg、3次/d,但患者呼吸困難無明顯好轉,血氧飽和度逐漸下降,術后第20天氧合指數降至48 mm Hg,故給予氣管插管+機械通氣治療,但患者癥狀及氧合仍無明顯改善。2019-10-22,再次復查胸部HRCT示雙肺磨玻璃影較前進一步擴大,見圖2C。最終患者因呼吸衰竭于2019-10-27死亡。
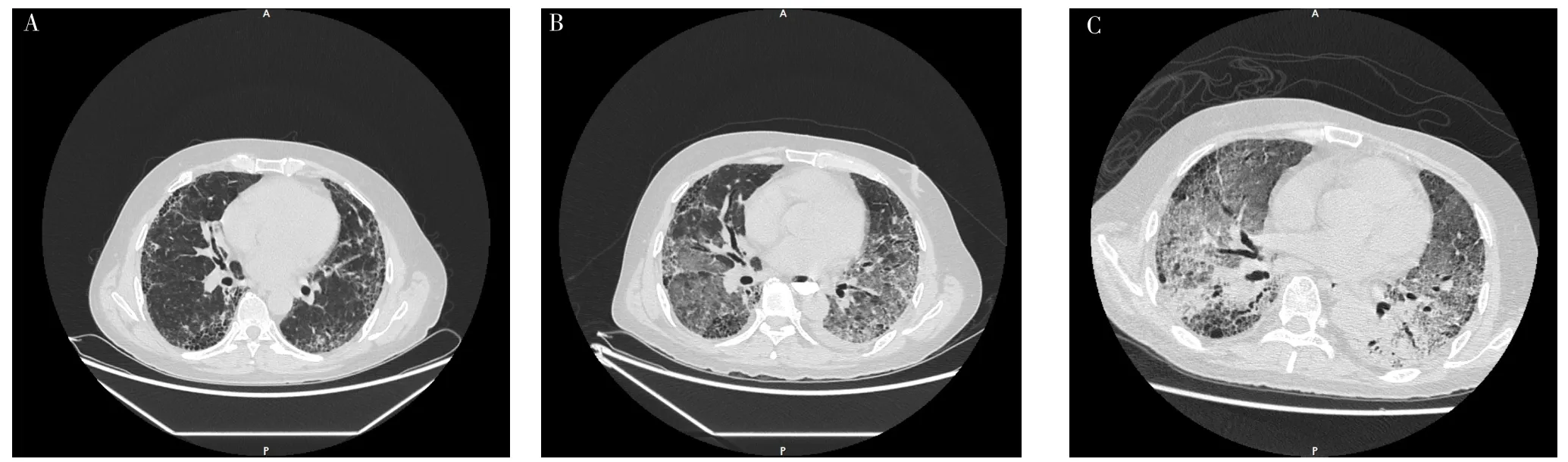
圖2 患者2胸部HRCT檢查Figure 2 Chest HRCT examination of patient 2
1.3 病例3 患者,男,72歲,因“胸痛1年余,發現右上肺腫塊1個月”于2018-10-17就診于中南大學湘雅醫院。患者1年前無明顯誘因出現胸背部間斷鈍痛,以右上部為甚,疼痛尚可忍受,與咳嗽、呼吸無關。伴活動后氣促,偶有咳嗽,無咳痰、咯血、胸悶、心悸等不適,口服止痛藥后緩解。1個月前患者胸痛加重,故就診于本院。患者入院時體溫36.0 ℃、脈搏78次/min、呼吸頻率16次/min、血壓128/87 mm Hg,雙下肺聞及Velcro啰音,杵狀指。既往有IPF病史1年,未用藥治療;吸煙史50年,30支/d,已戒煙1個月。婚育史及家族遺傳病史無特殊。胸部HRCT檢查示雙下肺彌漫性網絡狀、蜂窩狀改變,右上肺團片狀密度增高影,見圖3A、B,考慮肺癌。經皮肺穿刺確診為角化型鱗癌,其他檢查未見明顯異常。2018-10-24,患者行胸腔鏡下右上肺葉切除術,術后第5天患者憋喘明顯并出現呼吸困難。術后實驗室檢查:WBC 10.7×109/L,NE% 76.2%,LYM% 15.8%;D-二聚體 0.08 mg/L,CRP、PCT、ESR、G試驗、GM試驗、NT-proBNP、心肌酶譜、肌鈣蛋白未見明顯異常;多次支氣管肺泡灌洗液培養及支氣管肺泡灌洗液高通量測序結果陰性。復查胸部HRCT示雙肺新增廣泛磨玻璃影,見圖3C,診斷為AE-IPF。予以甲潑尼龍琥珀酸鈉40 mg、1次/d,但患者出現呼吸困難進行性加重,術后第10天氧合指數降至56 mm Hg,故給予氣管插管+呼吸機通氣治療。術后第12天,患者癥狀及氧合有所改善,復查胸部HRCT示雙肺滲出灶吸收,見圖3D。患者于2018-11-10出院,術后隨訪2年,患者病情平穩。
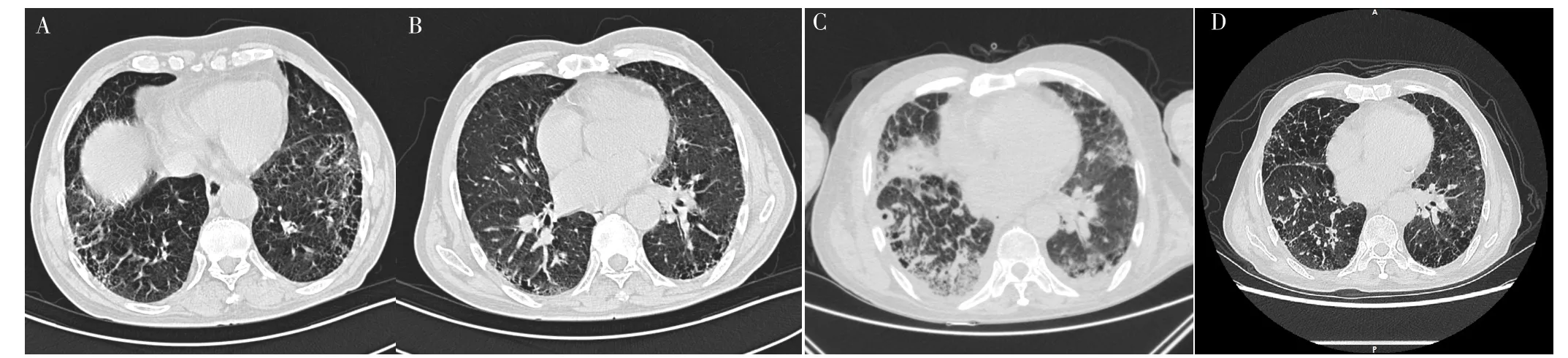
圖3 患者3胸部HRCT檢查Figure 3 Chest HRCT examination of patient 3
1.4 病例4 患者,男,62歲,因“發現肺結節17 d”于2019-05-27就診于中南大學湘雅醫院。患者17 d前體檢時進行胸部CT檢查,結果示右上肺結節,雙下肺胸膜下可見條索影及網格影,見圖4A、B,考慮早期IPF,為求進一步診治就診于本院。患者入院時體溫36.2 ℃、脈搏73次/min、呼吸頻率17次/min、血壓120/77 mm Hg,雙下肺可聞及少量Velcro啰音。既往有糖尿病病史8年、高血壓病史10年。吸煙史40余年,60支/d,已戒煙2個月。婚育史、家族遺傳病史無特殊。血、尿、便常規,肝腎功能,凝血四項,肺功能,心電圖,心臟彩超等檢查無明顯異常,故于2019-05-29行胸腔鏡下右上肺葉切除術。術后第4天,患者出現咳嗽、憋喘、氣促,實驗室檢查:WBC 10×109/L,NE% 74.9%,LYM% 15.1%;D-二聚體 0.09 mg/L,CRP、PCT、ESR、G試驗、GM試驗、NT-proBNP、心肌酶譜、肌鈣蛋白未見明顯異常;多次支氣管肺泡灌洗液培養及支氣管肺泡灌洗液高通量測序結果陰性;復查胸部HRCT示雙下肺網格影和彌漫性磨玻璃影明顯增多,見圖4C,診斷為AE-IPF。故予以甲潑尼龍琥珀酸鈉40 mg、1次/d。患者呼吸困難及低氧血癥無明顯改善,術后第7天氧和指數降至103 mm Hg,故給予氣管插管+呼吸機通氣治療。而后患者癥狀改善,胸部HRCT檢查示磨玻璃影較前吸收,出現蜂窩樣改變,見圖4D。術后隨訪1年6個月,患者存在反復咳嗽、咳痰、氣促,但并未入院治療。
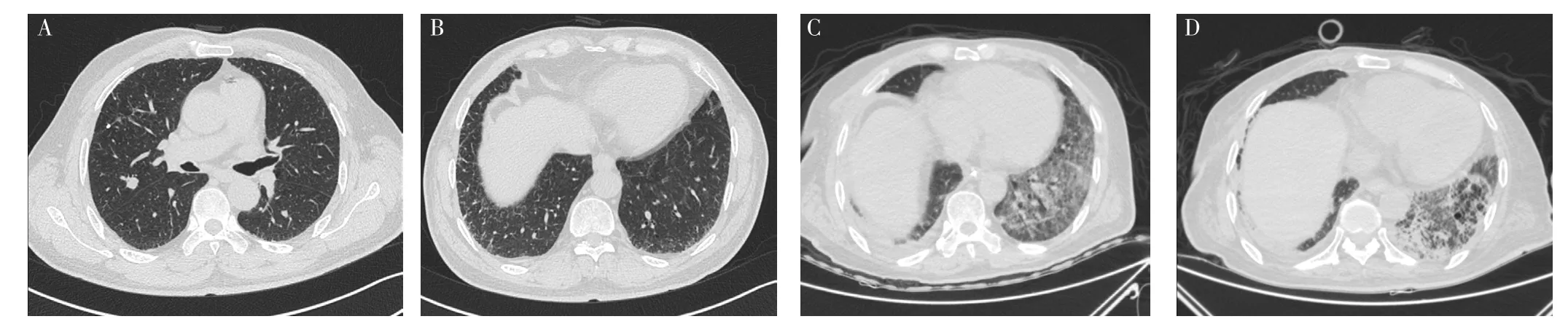
圖4 患者4胸部CT及HRCT檢查Figure 4 Chest CT and HRCT examination of patient 4
2 文獻檢索
以“急性加重”“特發性肺纖維化”“Acute exacerbation of idiopathic pulmonary fibrosis”為關鍵詞,搜索中國知網、萬方知識服務平臺及PubMed數據庫自建庫至2020-12-30公開發表的AE-IPF病例。納入臨床資料較為齊全、符合IPF診斷標準且術后30 d內發生急性加重的病例,并排除有如肺部感染、胃內容物誤吸、空氣污染等明確誘因的病例,同時排除綜述類、臨床資料不全、重復發表的文獻,最終納入13篇文獻[6-18],結合本文4例病例,共納入45例患者,其中男43例,女2例;平均年齡(64.6±8.1)歲;手術類型包括肺部及非肺部手術;急性加重距手術時間為(9.0±8.1)d;死亡33例;死亡患者術后平均生存時間為(45.2±43.2)d,患者基本信息見表1。
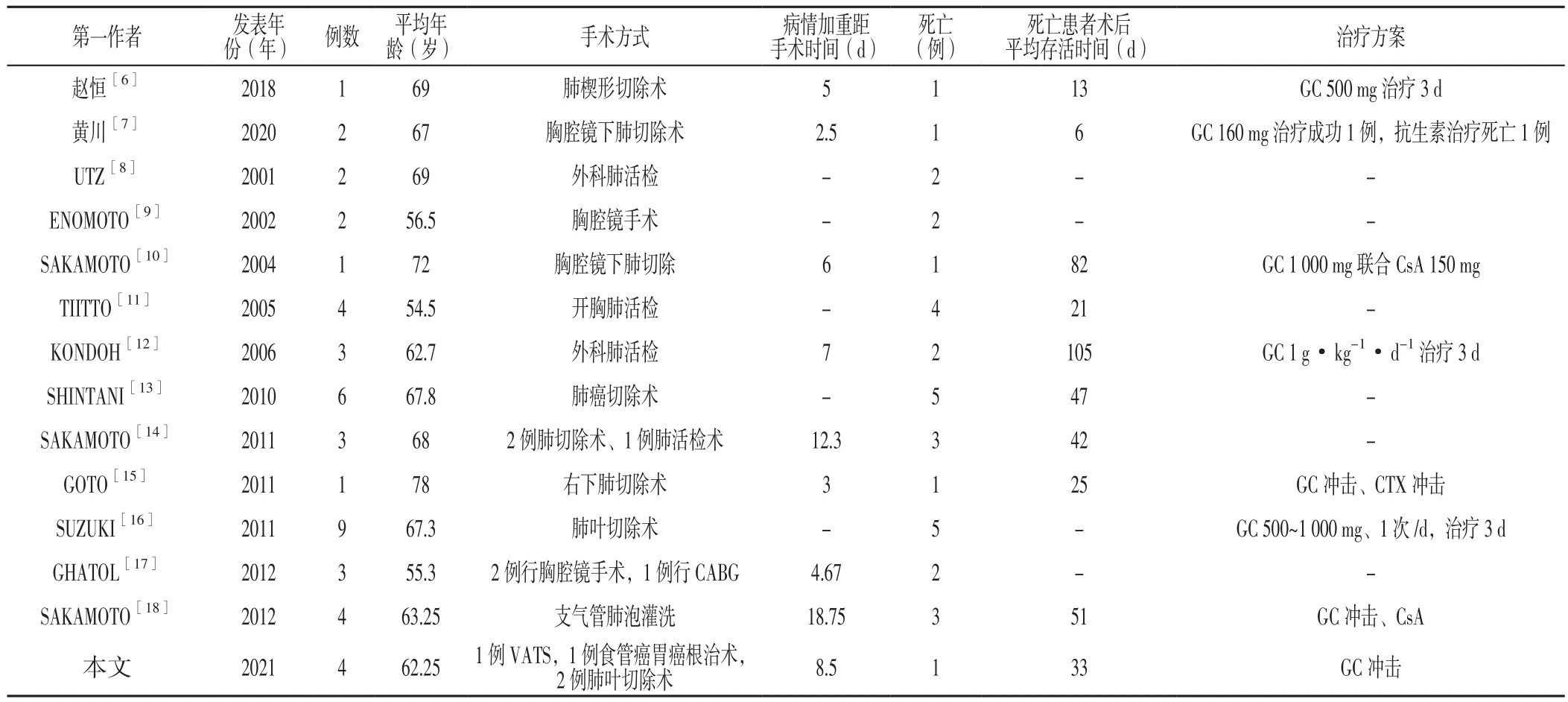
表1 AE-IPF患者基本信息Table 1 Basic information of AE-IPF patients
3 討論
AE-IPF病因不明,臨床表現為消化道癥狀在短期內出現急性、明顯惡化。手術、感染、胃內容物誤吸等可誘發AEIPF,其具體機制不明,可能與術中高氣道壓力對肺泡產生機械損傷有關[12,19]。本組患者1、2、3既往均有IPF病史,患者4于本院首診IPF,術前均未行抗纖維化治療,且4例患者支氣管肺泡灌洗液培養和/或支氣管肺泡灌洗液高通量測序結果均為陰性,故排除肺部感染,胸部影像表現可排除肺不張、肺水腫,且患者在病情加重時心肌酶、D-二聚體水平未升高,可排除心功能不全和肺栓塞的可能;術后1個月內出現明顯呼吸困難、雙肺新增廣泛磨玻璃影,符合手術后AEIPF診斷。本組4例患者中女1例,無吸煙史;男3例,均有吸煙史,吸煙指數均>400;手術類型包括胸腔鏡下肺活檢、肺葉切除術、食管癌胃癌根治術。3例術前胸部CT表現為蜂窩肺,1例表現為網格影及索條影。急性加重新增磨玻璃影類型分為周邊型、多灶型和彌漫型,其中周邊型預后較好,多灶型次之,彌漫型預后最差[20]。本組患者1和患者2術后急性加重磨玻璃影為彌漫型,患者3為周邊型,患者4為多灶型。患者1術后22個月再發AE-IPE死亡,患者2于圍術期死亡,患者3、4存活。患者2死亡可能與基礎肺纖維化程度重、單肺通氣時間長、吸入氧濃度高、新增磨玻璃影范圍大有關。本文文獻復習結果顯示,術后AE-IPF患者多為男性,多數在術后1周左右發病,且預后不良,多數在術后1年內死亡。
目前關于AE-IPF尚無推薦藥物,有學者建議激素大劑量沖擊治療(甲潑尼龍≥0.6 mg/kg或1 000 mg/d,連用3 d),但糖皮質激素對AE-IPF患者預后無明顯改善[21-22]。此外,也可選擇甲潑尼龍聯合免疫抑制劑治療[23]。吡非尼酮為抗肺纖維化藥物,一項Ⅱ期臨床試驗表明,圍術期使用吡非尼酮(前2周600 mg/d,之后1 200 mg/d)可降低IPF患者肺癌術后急性加重發生率[24]。尼達尼布為一種酪氨酸酶抑制劑,可緩解IPF患者的肺纖維化進展及急性加重[25]。其他治療包括抗菌藥物的使用、多黏菌素B血液灌流、抑酸治療等[26-27]。IPF穩定期可行肺移植治療,急性加重狀態下行肺移植風險大,且3年生存率較穩定期移植者低(90%比60%)[28]。應加強術中呼吸道管理,建議在適當麻醉下進行保護性機械通氣[29]。與普通麻醉(PaO2維持100~300 mm Hg)相比,IPF手術時PaO2應盡量維持在100 mm Hg以下,潮氣量控制在7~10 ml/kg,最大吸氣壓控 制在35 mm H2O(1 mm H2O=0.009 8 kPa)以下,這可預防機械通氣引起的肺損傷[29]。圍術期AE-IPF患者應盡量避免有創通氣,建議采用高流量氧療。俯臥位通氣可改善氧合和防止呼吸機引起的肺損傷[30]。
研究表明,預測肺活量百分比<80.6%、一氧化碳彌散量(DLCO)<50%預測值、血清乳酸脫氫酶(LDH)>241 U/L、KL-6≥1 000 U/ml、既往有急性加重史及術前使用過激素類藥物是術后AE-IPF發生的危險因素[13,31]。本組4例患者術前肺功能均正常,患者1術前有激素服用史,2次急性加重后死亡。
AE-IPF臨床特點為術后1個月內患者出現快速進展的呼吸困難,胸部CT表現為在原有IPF影像改變基礎上出現新的、雙肺分布的磨玻璃影或實變影。對于IPF患者應充分做好術前準備及評估,嚴格遵循手術適應證,選擇合適的手術方式,肺部手術應盡量減少肺野損傷范圍。術后嚴密觀察患者生命體征變化,如患者出現氣促不適,應警惕AE-IPF的可能,及早干預治療。可根據影像學評估患者預后,廣泛的磨玻璃影、牽拉性支氣管擴張及蜂窩狀影提示預后不良[32]。目前術后AE-IPF的有效治療方法尚需進一步研究探索。
作者貢獻:鄒麗君、孟婕進行文章的構思與設計;鄒麗君進行文章的可行性分析,撰寫論文;鄒麗君、范宇斌進行文獻/資料收集;鄒麗君、蔣國良進行文獻/資料整理;范宇斌、孟婕進行論文的修訂;蔣國良進行英文的修訂;孟婕負責文章的質量控制及審校,并對文章整體負責、監督管理。
本文無利益沖突。

