缺氧誘導因子-1與惡性腫瘤關系的研究進展
張璐,方岳,牛繼國,陳徹,李海龍,王功臣,張學良,梁艷,呼永華,,張志明
(1.甘肅中醫藥大學第一臨床醫學院,蘭州 730000; 2.甘肅省中醫院采購辦,蘭州 730050; 3.甘肅省腫瘤醫院 a.核醫學科,b.消化腫瘤內一科,蘭州 730050; 4.甘肅中醫藥大學附屬醫院腫瘤科,蘭州 730000)
氧是哺乳動物代謝及生理功能所必需的物質,在細胞能量產生及許多酶的輔助因子和底物反應中起重要作用[1]。當細胞內的總氧分壓小于40 mmHg(1 mmHg=0.133 kPa)時,細胞處于低氧狀態[2]。低氧廣泛存在于細胞及組織中,細胞對組織低氧的反應是生命及疾病發生發展中必不可少的過程,細胞感受和適應組織低氧是通過轉錄因子——缺氧誘導因子(hypoxia inducible factor,HIF)調控。HIF具有HIF-1、HIF-2及HIF-3三種亞型,均由氧調節型α亞基和組成型β亞基構成,α亞基是活性亞基,又分為HIF-1α,HIF-2α和HIF-3α[3]。目前,對HIF-1α和HIF-2α的研究較廣泛,但HIF-3α的作用機制尚不清楚[4]。HIF-2α與HIF-1α的同源性高達48%,HIF-1α幾乎在所有組織中均有表達,而HIF-2α只在內皮細胞、膠質細胞、Ⅱ型肺泡上皮細胞、心肌細胞、腎成纖維細胞、胰腺和十二指腸的間質細胞以及肝細胞中表達,且其在不同腫瘤細胞中的作用尚無定論[5]。由于惡性腫瘤的快速增殖,惡性腫瘤細胞長期處于低氧狀態,HIF-1α進行翻譯后特異性修飾相關腫瘤基因的表達,以適應低氧環境,如乳腺癌、結腸癌、肺癌、胰腺癌、卵巢癌等惡性腫瘤中,HIF-1α的表達量增加,當細胞暴露在低氧環境下,HIF-1α在細胞核內聚集并與相關靶基因結合,結合后的靶基因與惡性腫瘤細胞的增殖、轉移、侵襲以及腫瘤細胞的耐藥性有關[4]。現就HIF-1與惡性腫瘤關系的研究進展予以綜述。
1 HIF-1的結構與作用機制
1.1HIF-1的分子結構 HIF-1是由位于第14號染色體q21-24區的氧調節型α亞基以及位于第1號染色體q21區的組成型β亞基構成的異源二聚體,α亞基是HIF-1特異性的活性亞基,決定了HIF-1的活性,α及β亞基均屬于堿性螺旋-環-螺旋-/PAS(PER-ARNT-SIM)蛋白家族,該蛋白家族具有兩個重要結構:與DNA結合的堿性螺旋-環-螺旋區以及與另一個亞基形成二聚體并結合特異性靶基因的PAS區[1,6]。HIF-1α的N端連接具有激活轉錄作用的反式激活結構域,C端分別可連接具有調節轉錄作用的反式激活結構域和富含脯氨酸/絲氨酸/蘇氨酸的氧依賴降解結構域。在常氧情況下,HIF-1α的氧依賴降解結構域的脯氨酸殘基發生羥基化,導致α亞基破壞,并通過泛素化使HIF-1α降解[6-7]。N端的反式激活結構域具有核定位信號,在低氧情況下,協助HIF-1α與核孔蛋白結合并入核,與位于細胞核內的β亞基形成穩定的異源二聚體[4,7],并與CREB結合蛋白/腺病毒E1A相關蛋白p300結合形成CREB結合蛋白/腺病毒E1A相關蛋白p300復合物,該復合物與DNA低氧反應元件的順式作用元件啟動子區(5′-RCGTG-3′)結合,激活多種信號通路相關基因的表達[8-9]。
1.2HIF-1α的氧調節機制 組織及細胞對氧氣濃度的適應是由HIF-1α誘導相應靶基因來實現的。研究證實,HIF-1α氧依賴途徑主要有兩種,脯氨酸羥化酶和天冬氨酸羥化酶(HIF抑制因子)[10]。在常氧環境下,HIF-1α的脯氨酸殘基發生羥基化,C端的氧依賴降解結構域與腫瘤抑制蛋白結合,HIF-1α亞基泛素化,并經泛素連接蛋白酶復合體途徑降解,HIF-1α的天冬氨酸殘基發生羥基化,抑制HIF-1α與CREB結合蛋白/腺病毒E1A相關蛋白p300結合,阻止HIF-1α的轉錄激活功能[8]。當機體處于低氧狀態時,參與O2、Fe2+和2-氧戊二酸等羥基化的底物和輔助激活劑受到限制,導致HIF-1的羥基化發生衰減。HIF-1α在細胞質中積累,隨后被轉移到細胞核,在細胞核中與HIF-1β亞基形成異二聚體,HIF-1α/β異二聚體與位于O2調控基因內的低氧反應元件的順式作用元件結合,介導細胞/組織適應慢性或急性低氧,見圖1、2[10-11]。
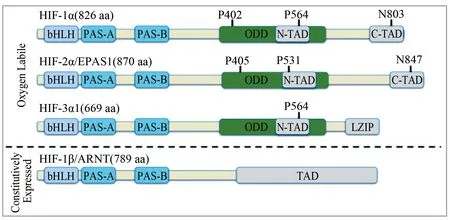
Oxygen Labile:氧不穩定狀態;HIF:缺氧誘導因子;bHLH:堿性螺旋-環-螺旋;PAS:PER-ARNT-SIM家族成員;ODD:氧依賴降解結構域;N-TAD:N端反式激活結構域;C-TAD:C端反式激活結構域;EPAS1:內皮PAS區域蛋白1;LZIP:亮氨酸拉鏈;Constitutively Expressed:持續性表達;ARNT:芳香烴受體核轉位因子;TAD:反式激活結構域
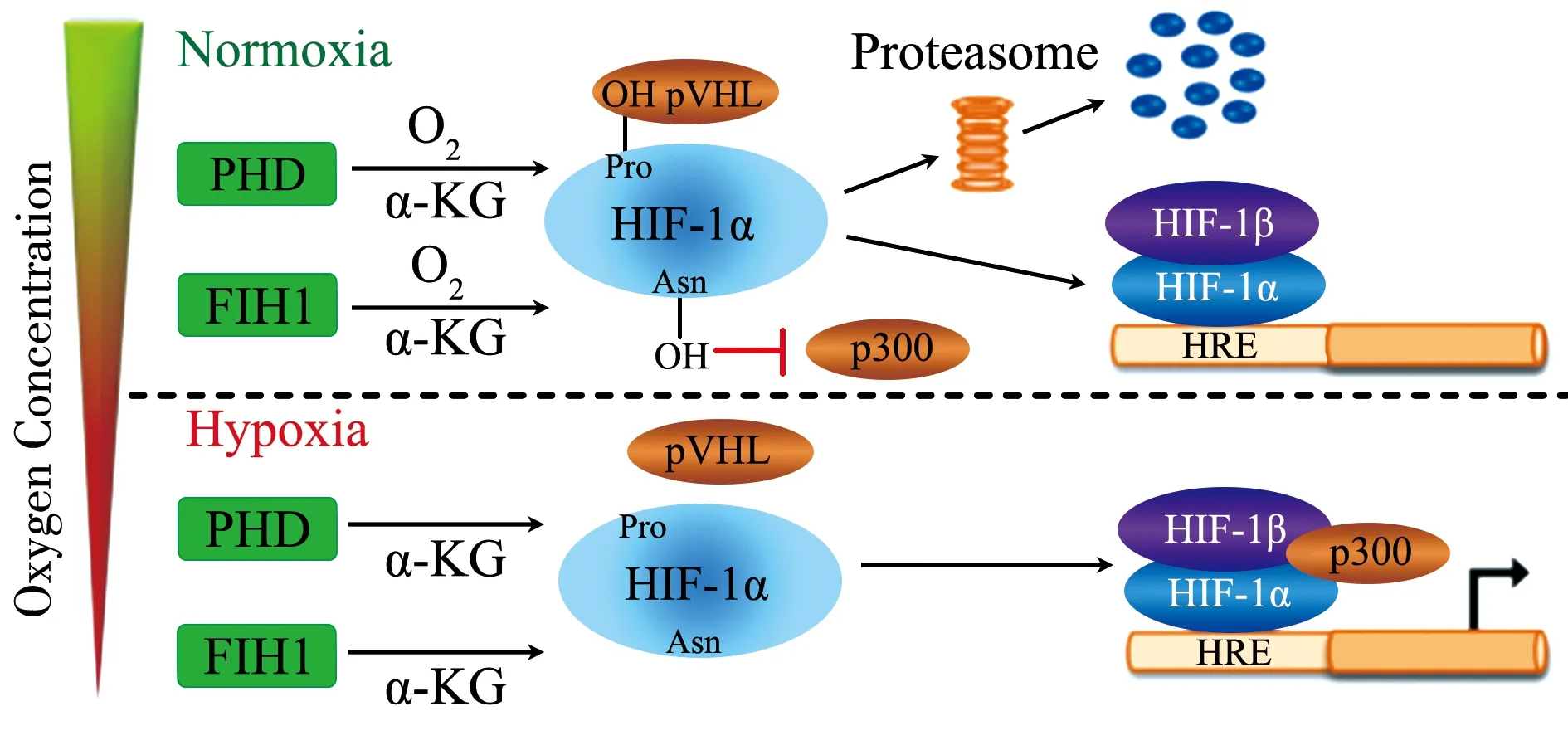
Oxygen Concentration:氧濃度;Normoxia:常氧;Proteasome:蛋白酶體;Hypoxia:缺氧;PHD:脯氨酸羥化酶;FIH1:缺氧誘導因子 1抑制因子;α-KG:α-酮戊二酸;VHL:希佩爾-林道腫瘤抑制蛋白;Pro:脯氨酸;HIF:缺氧誘導因子;Asn:天冬酰胺;HRE:低氧反應元件
2 HIF-1與惡性腫瘤的相互關系
2.1HIF-1促腫瘤的發生、發展 腫瘤的發生是一個復雜的過程,與腫瘤細胞的代謝、細胞因子和細胞之間的相互作用以及腫瘤微環境密切相關。腫瘤細胞的快速增殖和血液供應的缺乏導致腫瘤內部低氧,腫瘤細胞為了適應低氧的微環境,需要激活最重要的調節途徑——HIF[12]。在實體腫瘤中,腫瘤細胞表達HIF-1轉錄因子,誘導腫瘤發生過程中相關因子的表達,包括細胞外基質重構、血管生成、細胞遷移、細胞轉移、上皮-間充質轉化、耐藥性和腫瘤干細胞的維持[13]。多項研究表明,腫瘤細胞內低氧能夠促進血管生成、糖酵解、細胞侵襲、細胞存活和免疫逃避,最終導致腫瘤的發生和轉移[14-16]。
2.1.1HIF-1與腫瘤的促血管生成 在低氧狀態下,腫瘤細胞、內皮細胞和調節性T細胞等介導腫瘤血管生成因子釋放[17]。HIF-1是誘導腫瘤血管生成的重要調節因子,參與血管通透性、內皮細胞增殖、基膜降解、出芽、細胞遷移和管狀結構生成,從而形成新生血管[18]。相關研究顯示,HIF-1調節多種血管生長因子表達的編碼基因,包括血管生成素1和2、血管內皮生長因子(vascular endothelial growth factor,VEGF)、基質衍生因子-1、血小板源性生長因子B和胎盤生長因子[19]。Wang等[20]的實驗研究證實,低氧誘導的HIF-1α在4T1小鼠乳腺癌的細胞壞死區可通過上調促血管生成因子促進新生血管的異常生成。
腫瘤血管形成是一個多基因、多信號通路調控的復雜過程,血管生成導致血管密度增大和氧彌散距離減小[21],腫瘤低氧微環境中HIF-1調節血管生成受腫瘤組織耗氧量增加和氧彌散距離減少的影響[22]。值得注意的是,在暴露于低氧應激的內皮中,HIF-1控制對低氧的初始或急性適應至關重要,并能夠促進原始血管網絡的形成,而HIF-2和HIF-3則在長時間的氧耗盡后開始表達,促進并維持脈管系統的成熟和穩定[23]。
2.1.2HIF-1與腫瘤的轉移、侵襲 腫瘤細胞的惡性程度表現為腫瘤細胞的無限增殖能力和轉移特性。腫瘤細胞快速增殖,其需氧量亦增加,但由于氧氣彌散的減少,腫瘤細胞處于低氧微環境[21],低氧是腫瘤微環境的顯著特征之一,能夠促進并提高腫瘤的侵襲性[24]。在低氧微環境中,腫瘤干/祖細胞及其子代通過誘導低氧區血管形成化較差的腫瘤細胞產生更具侵略性和生存優勢的基因表型,腫瘤干細胞/祖細胞及其后代在疾病進展和轉移過程中常發生低氧,同時HIF-1α和HIF-2α的表達上調和活性增強。在腫瘤細胞中,HIF的上調可以發生在原發性腫瘤、繼發性腫瘤、轉移性前列腺癌、乳腺癌的低氧區、白血病細胞以及低氧狀態下的骨內膜[25]。當氧分壓降低時,HIF-1激活并上調相關細胞因子及信號通路,刺激并增強腫瘤轉移。HIF-1通過DNA芯片技術研究證明,超過2%的人類基因受到HIF-1的直接或間接調控[21]。相關研究顯示,腫瘤組織中HIF-1α的高表達增加了腫瘤細胞的侵襲能力,并誘導了鈣黏蛋白的丟失[26],腫瘤侵襲及轉移范圍主要由HIF-1調控的基質金屬蛋白酶及賴氨酸氧化酶決定,基質金屬蛋白酶及賴氨酸氧化酶能夠減少或重塑細胞外基質[27],同時腫瘤轉移和侵襲能力高度依賴于腫瘤-基質的相互作用,如細胞外基質重塑和上皮-間充質轉化[28],HIF-1的靶基因包括提高血管通透性的因子,如VEGF通過提高血管通透性使腫瘤局部微環境發生變化,有利于腫瘤細胞的滲出及轉移。已有研究表明,可通過調節結直腸癌、卵巢癌、胰腺癌、肝癌、胃癌組織中的HIF-1α水平,降低癌細胞的遷移和侵襲能力[29-31]。
2.1.3HIF-1在腫瘤中與微RNA(microRNA,miRNA)的相互作用 miRNA是一類大約由22個核苷酸組成的非編碼調控的單鏈小分子RNA,可與靶基因的3′非翻譯區結合,通過與靶基因信使RNA(messenger RNA,mRNA)堿基配對,進而引導沉默復合體,降解mRNA并阻止mRNA轉錄,影響蛋白質的表達水平,從而抑制基因的表達[32]。miRNA是基因轉錄后水平的重要調控因子,可以調節大約50%的蛋白質編碼基因的活性[33]。研究證實,miRNA是HIF-1的重要調節介質,同時HIF-1又可誘導特異性miRNA(即低氧相關miRNA)的表達[34-35]。HIF-1誘導的miRNA可影響腫瘤細胞的增殖、侵襲、轉移等多種生物學行為。在許多實體瘤中,miRNA的啟動子攜帶了HIF-1α的結合位點。在低氧環境下,miR-210顯著上調,上調后的miR-210通過抑制甘油-3-磷酸脫氫酶1的活性來增加HIF-1α的穩定性,miR-210和HIF-1α形成正反饋[36]。微陣列數據表明,miRNA在低氧過程中具有上調或下調兩種作用形式[32,37]。Joshi等[29]研究顯示,在上皮性卵巢癌中,下調后的miR-199a通過上調HIF-1α的表達量激活賴氨酰氧化酶,賴氨酰氧化酶通過調節細胞外基質的穩定性影響腫瘤的微環境,促進腫瘤的轉移。在低氧條件下,部分miRNA起原癌/抑癌基因通過HIF-1α誘導的miR-382直接靶向作用于人第10號染色體缺失的磷酸酶及張力蛋白同源基因,并通過抑制人第10號染色體缺失的磷酸酶及張力蛋白同源基因促進腫瘤血管的生成[37]。因此,HIF能夠正向或負向調節腫瘤細胞中miRNA的含量,并通過相關酶的作用間接促進腫瘤的發生發展或直接調控腫瘤相關基因的表達,從而使腫瘤細胞的生物學行為發生變化。
2.2HIF-1在惡性腫瘤治療中的作用
2.2.1HIF-1的抑制劑 HIF在惡性腫瘤的血管生成、侵襲及轉移等發生發展中起重要的調控作用,其相關抑制劑的研究對于腫瘤的治療具有重要意義。大多數HIF抑制劑的靶向目標為HIF-1α和HIF-2α,HIF抑制劑主要通過以下作用機制抑制其活性:①影響HIF-α mRNA或抑制HIF-α蛋白合成。EZN-2968又稱RO 7070179,是一種含有16個與人HIF-1α mRNA 100%互補的核苷酸殘基的反義寡核苷酸,也是一種HIF-1α特異性的靶向劑,以劑量依賴性方式下調HIF-1α mRNA,可在5 nmol/L濃度下完全抑制HIF-1α mRNA的產生,EZN-2968的Ⅰ期臨床試驗表明,EZN-2968降低了HIF-1α亞基和靶基因的mRNA水平[38-39]。伏立諾他是一種組蛋白脫氫酶抑制劑,通過抑制組蛋白脫氫酶9降低HIF-1α亞基的蛋白質水平,阻斷腫瘤血管生成,目前已被美國食品藥品管理局批準用于治療皮膚T細胞淋巴瘤[40]。②抑制HIF-α亞基與HIF-β亞基形成的異二聚體。吖啶黃能夠直接結合HIF-α的PAS結構域,抑制HIF-1α與HIF-β形成異二聚體,使HIF無法發揮作用[41]。③抑制HIF與DNA結合,HIF通過結合DNA上的低氧反應元件的順式作用元件,在轉錄水平上激活靶基因。棘霉素是從一種鏈霉菌中分離的小分子抗生素,可特異性地與HIF-1和VEGF啟動子區的HIF-1α的結合位點序列(5′- TACGTG-3′)結合,從而抑制低氧誘導VEGF的表達[42]。蒽環類和阿霉素可通過抑制HIF-1α與DNA的結合降低HIF-1α的活性[10]。④抑制HIF轉錄復合物形成。硼替佐米和兩性霉素通過增強天冬氨酸羥化酶和HIF-1或C端反式激活結構域之間的相互作用來阻止P300的募集,進而從功能上抑制HIF-1α的作用[10]。
2.2.2磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/Akt)/哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信號通路抑制劑 PI3K/Akt/mTOR信號通路是影響細胞生長發育及調控的重要途徑,惡性腫瘤細胞中的PI3K被激活,并在細胞膜上產生磷脂酰肌醇三磷酸酯,磷脂酰肌醇三磷酸酯作為第二信使激活Akt,活化的Akt使mTOR磷酸化,調節腫瘤細胞的增殖、轉移及侵襲[43]。在低氧狀態下,低氧作為刺激因素激活了PI3K/Akt/mTOR信號通路,導致HIF-1α表達上調,促進惡性腫瘤的發生發展,其中mTOR是調節HIF-1的核心因子,雷帕霉素是mTOR的第一代抑制劑,但并不直接抑制mTOR活性,而是與FK506結合蛋白12和mTORC1中的FK506結合蛋白12雷帕霉素結構域結合形成三元復合物,發揮變構抑制劑的作用[44]。研究發現,雷帕霉素以濃度依賴方式抑制多種腫瘤組織和動物模型中腫瘤細胞的生長,如乳腺癌、胰腺癌、黑素瘤、小細胞肺癌和肝癌。大豆抗毒素是一種新型的PI3K/Akt/mTOR信號通路抑制劑,通過阻斷PI3K/Akt/mTOR信號通路抑制HIF-1α翻譯,并阻止HIF-1α和熱激蛋白(heat shock protein,HSP)90結合,降低HIF-1的穩定性[45]。肉桂醛是中藥肉桂的主要活性成分,具有降糖、減肥、抗菌及抗腫瘤等功能[46]。研究發現,肉桂醛通過抑制PI3K/Akt/mTOR信號通路降低HIF-1α蛋白的合成,從而抑制由低氧誘導的血管生成和轉移[47]。
2.2.3HSP降低HIF-1的穩定性 在溫度升高、低氧、缺血再灌注損傷、病毒感染、營養不良、氧化應激等狀態下,HSP的合成和表達量增多,其可參與多種客戶蛋白折疊并促進蛋白質成熟,保護客戶蛋白免受降解,維持蛋白穩定性[48]。HIF-1α是HSP的客戶蛋白之一,在腫瘤細胞中,HSP90與HIF-1α的PAS結構域結合,起到穩定HIF-1α的作用[49]。同時,在惡性腫瘤細胞中,高表達的HIF-1α能刺激HSP90α的分泌,并促進腫瘤細胞的侵襲和轉移[50],因此抑制HSP90能夠降低HIF-1α的穩定性,促使HIF-1α蛋白降解,HSP90α分泌減少,抑制腫瘤細胞的侵襲與轉移。相關研究顯示,17-丙烯氨基-去甲氧基-格爾德霉素通過抑制HSP90影響HIF-1α的穩定性,HIF-1α表達量下降,致使侵襲相關蛋白基質金屬蛋白酶2和VEGF的表達量降低,從而抑制甲狀腺未分化癌細胞的侵襲能力[51]。AT-533是一種新型的HSP90抑制劑,可通過阻斷HIF-1α/VEGF/VEGF受體2信號通路抑制乳腺癌的生長[52]。由此可見,HSP90作為分子伴侶對客戶蛋白HIF-1α起到穩定作用,使用HSP90相關抑制劑能夠抑制表達HIF-1α的惡性腫瘤的細胞增殖、轉移及侵襲。
2.2.4HIF-1增強化療藥物的耐藥性 腫瘤化療藥物的耐藥性是影響臨床腫瘤療效的主要因素,也是大多數晚期腫瘤患者和不可手術患者治療失敗的主要原因。氧氣對抗癌藥物活性具有一定的影響,化療藥物在低氧環境下對腫瘤細胞的作用降低。有研究顯示,低氧條件下的某些腫瘤細胞的基因表型會發生改變,使腫瘤細胞適應低氧微環境并對化療藥物產生耐藥性,如依托泊苷、阿霉素。關于HIF-1介導的耐藥機制還包括上調葡萄糖以及氧調節蛋白的表達,DNA過度復制,細胞周期阻滯,細胞代謝改變和遺傳不穩定性[53]。此外,耐藥低氧誘導基因在抗腫瘤藥物的耐藥中也起到關鍵作用。HIF-1介導并調節藥物外排,并能夠在低氧環境下激活多重耐藥基因1,多重耐藥基因1編碼膜內P-糖蛋白,P-糖蛋白屬于ATP結合盒轉運蛋白家族,可作為藥物外排泵,在一定范圍內降低細胞內化療藥物的濃度[54]。低氧也是細胞自噬的驅動因素,低氧誘導的自噬與耐藥之間存在一定的聯系。自噬是腫瘤細胞對化療誘導細胞凋亡的保護性反應,能夠促使受損細胞的降解[55]。例如,在對順鉑的反應中,低氧增強順鉑誘導的HIF-1自噬作用,抑制肺癌細胞對順鉑的敏感性[56]。低氧狀態下,通過激活HIF-1α/B細胞淋巴瘤/白血病-2/腺病毒E1B 19 000相互作用蛋白3/自噬相關基因1信號通路增強細胞自噬能力,從而介導膀胱癌對吉西他濱化療產生耐藥[57]。除內在調控因素外,HIF-1介導腫瘤細胞的耐藥機制還存在一定的外在因素。相關證據表明,程序性細胞死亡受體1/程序性細胞死亡配體1(ligand of programmed death 1,PD-L1)也可導致腫瘤細胞對常規化療藥物產生耐藥性。PD-L1是程序性細胞死亡受體1的主要配體,在髓系、淋巴細胞、正常上皮細胞和癌癥組織中均有表達。PD-L1在腫瘤中的高表達與腫瘤細胞免疫逃避密切相關,并且有助于抑制細胞凋亡[58-59]。Noman等[60]的實驗證實,在低氧條件下,HIF-1可直接結合PD-L1近端啟動子上具有轉錄活性的HIF-1α的結合位點,上調PD-L1表達。
2.2.5HIF-1降低放療的敏感性 目前,放療已成為惡性腫瘤治療的重要手段之一,約70%的腫瘤患者治療過程需要放療的干預,40%的腫瘤患者通過放療達到治愈[61]。放療在臨床中的應用廣泛,但在治療過程中可能產生放療敏感性抵抗等,影響臨床療效。研究顯示,低氧可以通過抑制Akt/mTOR/p70核糖體S6蛋白激酶途徑增強電離輻射誘導的自噬,從而增強放射抵抗性[62]。Luo等[63]研究發現,沉默神經膠質瘤中的HIF-1α能夠增強患者對放療的敏感性,提高療效。
3 小 結
HIF-1作為低氧條件下的重要轉錄因子,在惡性腫瘤細胞中高表達,并與腫瘤的生物學行為密切相關。HIF-1參與促進腫瘤血管的生成,并可增強腫瘤細胞的侵襲及轉移能力,鑒于HIF-1與腫瘤的廣泛聯系,HIF-1能夠作為惡性腫瘤治療過程中的藥物靶點,通過藥物的抑制作用降低或阻止腫瘤細胞增殖、侵襲和轉移等特性,提高惡性腫瘤的治療效果。在低氧狀態下,腫瘤細胞通過改變基因表型、影響葡萄糖代謝、細胞凋亡和自噬等途徑,刺激腫瘤細胞對化療藥物產生耐藥性,增加了治療的難度,對于放療患者,HIF-1可以通過抑制Akt/mTOR/p70核糖體S6蛋白激酶信號通路降低放療的敏感性。因此利用有效藥物降低低氧狀態下腫瘤細胞HIF-1的表達,有助于降低患者對放化療的抵抗性,起到協同增敏的作用。HIF-1α的高表達可能成為預示胃癌不良預后的指標之一[64],隨著對HIF-1的結構、功能、調控機制以及在腫瘤中作用的深入研究,將為惡性腫瘤的預防與治療開辟新的方向。

