血清PGⅠ、GS-17及TNF-α水平與幽門螺桿菌感染消化性潰瘍相關性研究
劉東濤,李 兵,孫 坤
消化性潰瘍(peptic ulcer, PU)是指胃腸道黏膜在某種情況下被胃酸和(或)胃蛋白酶消化而造成的潰瘍,臨床上以上腹部疼痛、反胃和反酸等為主要癥狀[1-2]。PU主要包括胃潰瘍和十二指腸潰瘍,胃酸和(或)胃蛋白酶的消化作用是潰瘍形成的基本因素。幽門螺桿菌(helicobacter pylori, HP)是PU主要致病菌,占80%以上[3]。HP感染可損傷胃黏膜屏障,進而造成PU。既往研究證實,胃泌素(gastrin, GS)釋放增多可造成胃酸分泌增加,胃酸分泌增加可導致胃蛋白酶原Ⅰ(pepsinogen Ⅰ, PGⅠ)分泌增多[4]。另有研究發現,HP感染PU患者血清中腫瘤壞死因子-α(tumor necrosis factor-α, TNF-α)水平顯著上升,可作為診斷HP感染PU的重要指標[5]。本研究分析血清PGⅠ、胃泌素-17(gastrin-17, GS-17)及TNF-α水平與HP感染PU的相關性,以期為臨床診斷HP感染PU提供新思路。
1 資料與方法
1.1一般資料 選取2019年4月—2020年5月崇州市人民醫院收治的符合納入及排除標準的PU 132例的臨床資料。132例均因上消化道癥狀就診,其中胃潰瘍59例,十二指腸潰瘍73例。根據有無HP感染將PU 132例分為HP感染PU組(75例)和無HP感染PU組(57例)兩組。HP感染PU組中胃潰瘍29例,十二指腸潰瘍46例;無HP感染PU組中胃潰瘍30例,十二指腸潰瘍27例。另選取同期在該院進行體檢的健康體檢者47例作為健康體檢組(均行實驗室或胃鏡檢查,皆無HP感染和PU)。3組性別、年齡、體質量指數及合并疾病比較差異均無統計學意義(P>0.05),見表1,具有可比性。本研究經醫院醫學倫理委員會批準同意執行。

表1 有無HP感染PU和健康體檢者3組一般資料比較
1.2納入及排除標準 納入標準:①PU 132例均經胃鏡活組織病理檢查證實PU及有無HP感染;②皆臨床資料完整;③無其他惡性疾病;④入組前15 d無抑酸劑、抗生素和胃黏膜保護劑使用史;⑤患者和(或)其家屬均簽署相關知情同意書。排除標準:①近6個月內出現腦血管疾病者;②合并免疫系統和血液系統疾病者;③過敏體質者;④合并胃食管腫瘤或胃食管反流病者。
1.3檢測方法 血清PGⅠ、GS-17及TNF-α水平均采用酶聯免疫吸附試驗法檢測,PGⅠ和GS-17試劑盒購自上海西唐生物科技有限公司,TNF-α試劑盒購自美國 R&D公司。所有入組者檢查前禁食8 h以上,于清晨空腹抽取3 ml靜脈血,抗凝、離心,隨后將分離的血清置-20℃保存。試驗時取出血清,置于37℃溫浴箱中進行孵化,同時將PGⅠ、GS-17及TNF-α試劑盒分別取出,等到其溫度升至28℃為止,配制標準品液,接著加洗滌液,建立標準曲線并加樣,將反應板利用透明膠密封保存,然后洗板4~7次,將50 μl第一抗體工作液置于37℃反應板上60 min,再次洗板后,將100 μl酶標抗體工作液置于37℃反應板上60 min,接著再洗板,再將100 μl底物液置于37℃溫浴箱中反應10 min,同時在反應板上加50 μl終止液,最后將反應板置于酶標儀里。將波長設定為450 nm,測吸光度值,將所測得吸光度值減去空白值,得出數值作為計算的數值;根據所測得樣品吸光度值在標準曲線圖上查出相應血清PGⅠ、GS-17及TNF-α水平。
1.4觀察指標 比較HP感染PU組、無HP感染PU組和健康體檢組3組血清PGⅠ、GS-17及TNF-α水平,HP感染PU組和無HP感染PU組不同潰瘍類型患者血清PGⅠ、GS-17及TNF-α水平;采用Logistic回歸分析探討血清PGⅠ、GS-17及TNF-α水平與HP感染PU的關系;采用受試者工作特征(ROC)曲線分析血清PGⅠ、GS-17、TNF-α檢測及三者聯合檢測對HP感染PU的診斷價值。
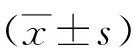
2 結果
2.1HP感染PU組、無HP感染PU組和健康體檢組血清PGⅠ、GS-17及TNF-α水平比較 HP感染PU組、無HP感染PU組和健康對照組3組血清PGⅠ、GS-17及TNF-α水平總體比較差異均有統計學意義(P<0.01)。HP感染PU組和無HP感染PU組血清PGⅠ、GS-17和TNF-α水平均高于健康體檢組,差異具有統計學意義(HP感染PU組:t=31.693、P<0.001,t=32.687、P<0.001,t=30.420、P<0.001;無HP感染PU組:t=13.395、P<0.001,t=41.622、P<0.001,t=14.625,P<0.001)。HP感染PU組血清PGⅠ、GS-17和TNF-α水平高于無HP感染PU組,差異有統計學意義(t=28.820、P<0.001,t=18.028、P<0.001,t=26.075、P<0.001),見表2。
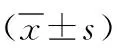
表2 有無HP感染PU和健康體檢者3組血清PGⅠ、GS-17及TNF-α水平比較
2.2HP感染PU組和無HP感染PU組不同潰瘍類型患者血清PGⅠ、GS-17和TNF-α水平比較 HP感染PU組胃潰瘍患者血清GS-17水平低于十二指腸潰瘍患者,差異有統計學意義(P<0.01);胃潰瘍患者和十二指腸潰瘍患者血清PGⅠ和TNF-α水平比較差異均無統計學意義(P>0.05)。無HP感染PU組胃潰瘍患者和十二指腸潰瘍患者血清PGⅠ、GS-17和TNF-α水平比較差異均無統計學意義(P>0.05)。HP感染PU組胃潰瘍患者血清PGⅠ、GS-17和TNF-α水平均高于無HP感染PU組胃潰瘍患者,差異有統計學意義(t=13.659、P<0.001,t=13.139、P<0.001,t=17.363、P<0.001)。HP感染PU組十二指腸潰瘍患者血清PGⅠ、GS-17和TNF-α水平亦均高于無HP感染PU組十二指腸潰瘍患者,差異有統計學意義(t=12.978、P<0.001,t=29.996、P<0.001,t=16.336、P<0.001)。見表3。
2.3血清PGⅠ、GS-17及TNF-α水平與HP感染PU關系 以HP感染PU為因變量,血清PGⅠ、GS-17及TNF-α水平為自變量行Logistic回歸分析, 結果顯示血清PGⅠ>70 U/ml、GS-17>55 pg/ml及TNF-α>10 ng/ml是HP感染PU的危險因素(P<0.01)。見表4。
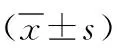
表3 HP感染PU組和無HP感染PU組不同潰瘍類型患者血清PGⅠ、GS-17及TNF-α水平比較

表4 血清PGⅠ、GS-17及TNF-α水平與HP感染PU關系的Logistic回歸分析結果
2.4血清PGⅠ、GS-17、TNF-α檢測及三者聯合檢測對HP感染PU診斷價值 ROC曲線分析結果顯示,血清PGⅠ、GS-17、TNF-α檢測及三者聯合檢測對HP感染PU診斷價值的曲線下面積分別為0.747、0.732、0.801及0.829,三者聯合檢測對HP感染PU的診斷價值最佳,見圖1、表5。

圖1 血清PGⅠ、GS-17、TNF-α檢測及三者聯合檢測對HP感染PU診斷價值的ROC曲線

表5 血清PGⅠ、GS-17、TNF-α檢測及三者聯合檢測對HP感染PU診斷價值的ROC曲線分析結果
3 討論
PU是一種慢性消化系統疾病,好發于胃及十二指腸,大部分PU患者是因HP感染所致[6]。胃部黏膜HP感染時,會改變正常黏膜防御因素和侵襲因素平衡。Eisdorfer等[7]研究指出,HP感染PU是發生食管癌和胃癌的獨立危險因素。目前,國際癌癥研究會認為HP感染是胃癌的重要致癌因素之一[8]。根除HP感染或使HP感染由陽轉陰是臨床上治療HP感染PU的主要原則。
胃蛋白酶原是胃蛋白酶的活性前體,在pH<5.0時活化為胃蛋白酶,可反映胃黏膜的形態及功能[9]。根據其生化和免疫化學特征可分為PGⅠ和胃蛋白酶原Ⅱ,主要由胃黏膜泌酸腺上主細胞分泌,進入胃腔后在酸性環境中活化形成胃蛋白酶,對消化道黏膜組織可產生自身消化作用[10]。HP感染早期可引起慢性淺表性胃炎、胃潰瘍及十二指腸潰瘍等,后期可導致慢性萎縮性胃炎和癌前病變等,HP感染PU在不斷發展過程中會伴有胃蛋白酶原變化[11-12]。Yang等[8]報道發現,HP感染PU患者胃酸分泌會增強,而胃酸的酸性程度與PGⅠ的活性關系密切。有學者通過對日本人群HP 感染慢性萎縮性胃炎和胃癌關系的研究發現,血清PGⅠ水平受HP 感染的影響,血清HP 抗體陽性患者PGⅠ水平明顯高于血清HP 抗體陰性患者[13]。GS-17由胃竇G細胞分泌,可以直接反映胃竇部黏膜健康狀況,和胃酸分泌成負反饋機制,可間接評估胃體部黏膜健康狀況[14]。有學者研究發現,HP感染后可分解尿酸產生氨或鹽酸,刺激胃壁組織引起生長抑素分泌不足,并使GS-17分泌增加[15]。TNF-α由單核-吞噬細胞系統產生及分泌,是炎癥反應的起始因子,可刺激機體合成大量的促炎因子,引起炎性細胞移動,同時使胃黏膜局部微血管處于內凝血狀態,導致胃黏膜損傷[16]。Nishida等[17]研究發現,TNF-α在HP感染PU患者中的表達高于無HP感染PU患者。Bagheri等[18]研究則表明,TNF-α水平升高可作為不同菌型HP感染PU的重要診斷指標。本研究結果顯示,HP感染PU組和無HP感染PU組血清PGⅠ、GS-17和TNF-α水平均高于健康體檢組,HP感染PU組血清PGⅠ、GS-17和TNF-α水平高于無HP感染PU組,差異有統計學意義。表明血清PGⅠ、GS-17及TNF-α水平升高與HP感染PU有關。
HP感染是誘發PU的重要危險因素之一。本研究結果顯示,HP感染PU組胃潰瘍和十二指腸潰瘍患者血清PGⅠ、GS-17和TNF-α水平均高于無HP感染PU組胃潰瘍和十二指腸潰瘍患者,差異有統計學意義;Logistic回歸分析結果顯示,血清PGⅠ>70 U/ml、GS-17>55 pg/ml及TNF-α>10 ng/ml是HP感染PU的危險因素。表明血清PGⅠ、GS-17和TNF-α水平與HP感染PU有一定相關性。這可能是由于HP感染后可分解尿素產生氨或鹽酸,刺激胃壁組織增加GS-17分泌,同時刺激炎性因子釋放而加重胃壁黏膜損傷,而GS-17分泌增加可進一步引起胃酸分泌增多,PGⅠ釋放增加,進而加重對胃壁黏膜組織的損傷,形成一個惡性循環[19]。
本研究進一步采用ROC曲線分析血清PGⅠ、GS-17、TNF-α檢測及三者聯合檢測對HP感染PU的診斷價值,結果顯示血清PGⅠ、GS-17、TNF-α檢測及三者聯合檢測對HP感染PU診斷價值的曲線下面積分別為0.747、0.732、0.801及0.829,三者聯合檢測對HP感染PU的診斷價值最佳。提示血清PGⅠ、GS-17和TNF-α三者聯合檢測可作為診斷HP感染PU的有效手段。
綜上所述,血清PGⅠ、GS-17及TNF-α水平升高與HP感染PU有一定相關性,三者聯合檢測對HP感染PU的診斷價值最佳。但由于本研究納入樣本量較少,試驗結果難免存在偏倚,后續需擴大樣本量進一步研究,以獲得更為準確的試驗結果。

