不同標本前處理方法對新型冠狀病毒核酸檢測結果的影響*
張相猛,徐秋芳,施怡茹,盧曉蕓,趙錦江,徐瑞芳
上海市青浦區疾病預防控制中心微生物檢驗科,上海 201700
由新型冠狀病毒(SARS-CoV-2)感染所致的新型冠狀病毒肺炎(COVID-19)在全球大范圍的暴發、流行[1]。人感染SARS-CoV-2后常出現乏力和呼吸道癥狀,如發熱、咳嗽、氣促和呼吸困難等[2]。SARS-CoV-2傳染力強,易造成聚集性感染,其常規檢測方法為實時熒光定量PCR[3],主要針對SARS-CoV-2基因組中開放讀碼框1ab(ORF1ab)和核衣殼蛋白(N)基因進行檢測[4]。SARS-CoV-2屬于β屬冠狀病毒,對紫外線和熱敏感,現在普遍認為56 ℃ 30 min、乙醚、75%乙醇等均可有效滅活SARS-CoV-2[5-6]。根據《新型冠狀病毒肺炎實驗室檢測技術指南》[7],感染性材料或活病毒應在采用可靠的方法滅活后在生物安全二級實驗室進行核酸檢測,但是指南對具體滅活方法并沒有進行明確規定。目前,SARS-CoV-2核酸檢測假陰性率過高,滅活對病毒檢出率的影響不容忽視。
1 材料與方法
1.1標本來源 選取本院SARS-CoV-2核酸檢測結果為陽性的18份未滅活咽拭子標本為研究對象。
1.2儀器與試劑 數顯電熱恒溫水浴鍋(上海浦東榮豐科學儀器有限公司)、干浴鍋(上海藍豹實驗儀器有限公司)、全自動核酸提取儀(江蘇碩世科技股份有限公司)、LightCycle 480Ⅱ實時熒光定量PCR儀(瑞士羅氏公司)。SARS-CoV-2核酸檢測試劑盒(雙重熒光PCR法,上海之江生物科技股份有限公司,批號:20200303)。
1.3方法
1.3.1標本處理 將所有標本均勻分成7份,每份體積為250 μL;分別采用56 ℃金屬浴30 min、56 ℃金屬浴60 min、56 ℃水浴30 min、56 ℃水浴60 min、化學裂解15 min、化學裂解30 min 6種方法進行標本前處理;每份標本均設置對照(不做任何處理)。
1.3.2核酸檢測 采用全自動核酸提取儀進行核酸提取。按照SARS-CoV-2核酸檢測試劑盒說明書配制好核酸檢測體系,加樣后置于LightCycle 480Ⅱ實時熒光定量PCR儀上,45 ℃、10 min,95 ℃、15 s,58 ℃、30 s,循環40次。在58 ℃進行單點熒光檢測,熒光通道選擇FAM、HEX/VIC/JOE和CY5通道,分別檢測ORF1ab基因、N基因和內源性基因MNBH,內源性基因為參照基因。此次實驗中各反應孔內源性基因Ct值均符合試劑盒說明書判定要求,因此其Ct值不在文中具體列出。
1.3.3結果判定 靶標檢測結果判定標準:擴增曲線不呈S型,Ct值>39.00或Ct值空白為陰性;擴增曲線呈S型,且Ct值≤39.00為陽性。SARS-CoV-2核酸檢測陽性結果判定標準:需滿足以下2個條件中的任意1個,(1)同一份標本中SARS-CoV-2 2個靶標(ORF1ab、N基因)實時熒光定量PCR檢測結果均為陽性;如果出現單靶標陽性的檢測結果,則需重新采樣、重新檢測,如果仍為單靶標陽性,判定為陽性。(2)兩種類型標本實時熒光定量PCR檢測結果同時出現單靶標陽性,或同種類型標本兩次采樣檢測中均出現單靶標陽性的檢測結果,可判定為陽性[7]。
1.4統計學處理 采用SPSS21.0軟件進行數據分析。計數資料以例數或百分率表示;不符合正態分布的計量資料以M(P25,P75)表示,多組間比較采用Kruskal-WallisH檢驗。以P<0.05為差異有統計學意義。
2 結 果
2.1不同標本前處理方法下ORF1ab基因檢測結果 不進行標本前處理時ORF1ab基因檢出率為100.00%。經56 ℃水浴30 min、56 ℃水浴60 min處理后,ORF1ab基因檢出率分別為94.44%、100.00%。經56 ℃水浴30 min處理與不處理檢測值的差值為1.13(-0.37,2.55),經56 ℃水浴60 min處理與不處理檢測值的差值為0.25(-1.81,0.79)。經化學裂解15 min、化學裂解30 min處理后,ORF1ab基因檢出率分別為77.78%、50.00%。經化學裂解15 min處理與不處理檢測值的差值為2.94(2.43,4.17),經化學裂解30 min處理與不處理檢測值的差值為4.30(3.55,5.52)。經56 ℃金屬浴30 min、56 ℃金屬浴60 min處理后,ORF1ab基因檢出率分別為83.33%、77.78%。經56 ℃金屬浴30 min處理與不處理檢測值的差值為2.01(0.43,4.80),經56 ℃金屬浴60 min處理與不處理檢測值的差值為1.75(-0.44,4.20)。不同標本前處理方法與不處理檢測值的差值之間差異有統計學意義(H=39.26,P<0.05)。見表1。

表1 不同標本前處理方法下ORF1ab基因檢測結果
2.2不同標本前處理方法下N基因檢測結果 不進行標本前處理時N基因檢出率為100.00%。經56 ℃水浴30 min、56 ℃水浴60 min處理后,N基因檢出率均為100.00%。經56 ℃水浴30 min處理與不處理檢測值的差值為0.80(-0.01,2.71),經56 ℃水浴60 min處理與不處理檢測值的差值為0.39(-1.10,0.80)。經化學裂解15 min、化學裂解30 min處理后,N基因檢出率分別為77.78%、61.11%。經化學裂解15 min處理與不處理檢測值的差值為2.63(0.83,3.36),經化學裂解30 min處理與不處理檢測值的差值為4.40(3.19,6.23)。經56 ℃金屬浴30 min、56 ℃金屬浴60 min處理后,N基因檢出率分別為88.89%、77.78%。經56 ℃金屬浴30 min處理與不處理檢測值的差值為2.09(-0.09,3.42),經56 ℃金屬浴60 min處理與不處理檢測值的差值為0.63(-1.83,6.59)。不同標本前處理方法與不處理檢測值的差值之間差異有統計學意義(H=27.32,P<0.05)。見表2。
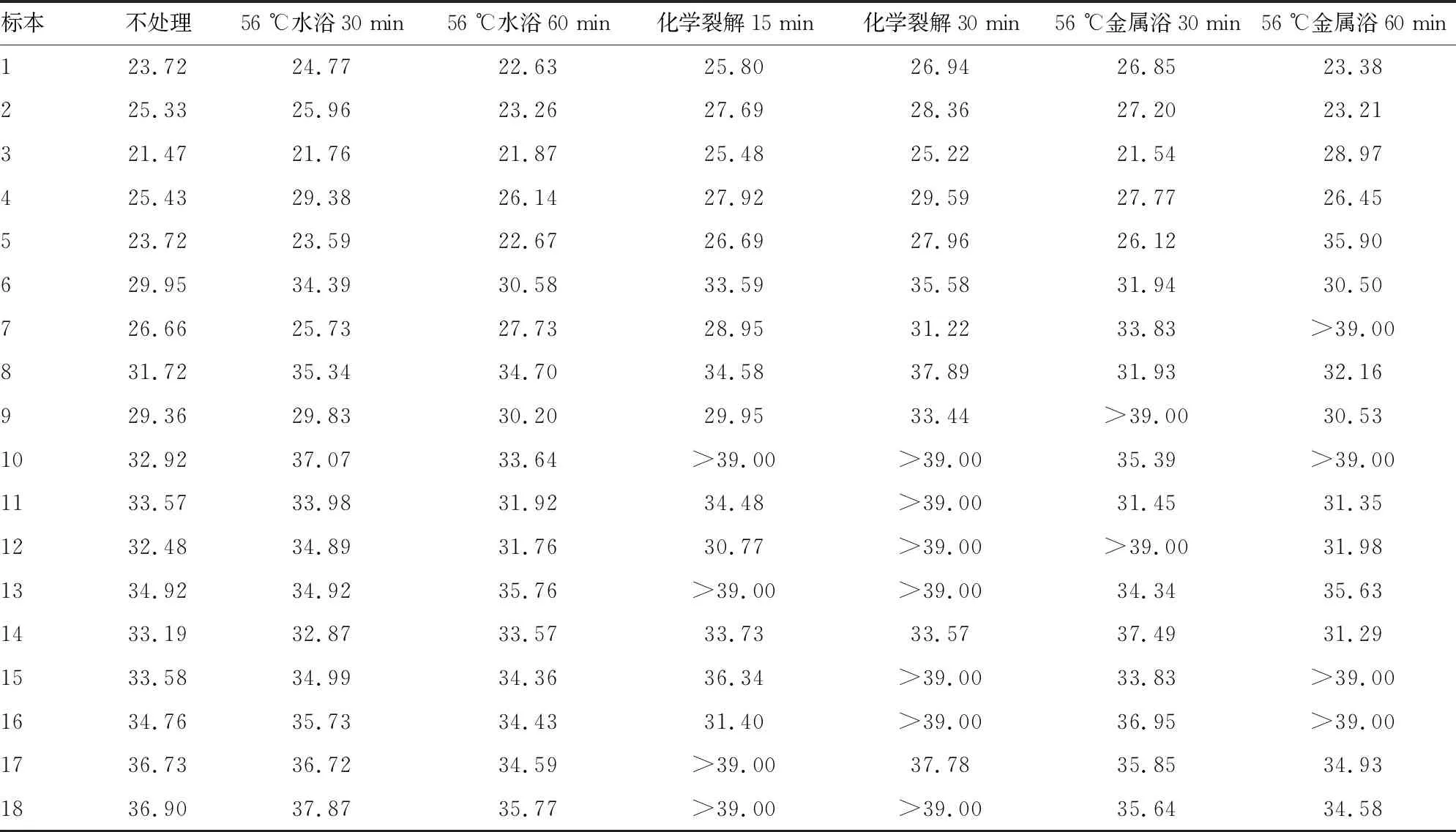
表2 不同標本前處理方法下N基因檢測結果
2.3不同標本前處理方法下SARS-CoV-2核酸檢測結果 18份標本不進行標本前處理時雙靶標檢測結果均為陽性。1份標本經56 ℃水浴30 min處理后出現單靶標陽性,假陰性率為0.00%(0/18);經56 ℃水浴60 min處理后18份標本雙靶標檢測結果均為陽性,假陰性率為0.00%(0/18)。經化學裂解15 min處理后出現2份標本雙靶標陰性,3份標本單靶標陽性,假陰性率為11.11%(2/18);經化學裂解30 min處理后出現7份標本雙靶標陰性,2份標本單靶標陽性,假陰性率為38.89%(7/18)。經56 ℃金屬浴30 min處理后出現1份標本雙靶標陰性,3份標本單靶標陽性,假陰性率均為5.56%(1/18);經56 ℃金屬浴60 min處理后出現1份標本雙靶標陰性,6份標本單靶標陽性,假陰性率為5.56%(1/18)。見表3。

表3 不同標本前處理方法下SARS-CoV-2核酸檢測結果(ORF1ab基因/N基因)
3 討 論
由于SARS-CoV-2傳染性強,因此在進行標本核酸提取前需進行滅活處理,但是滅活過程可能會造成病毒核酸降解,從而導致檢測結果出現假陰性[8]。
本研究中,ORF1ab與N基因經56 ℃水浴30 min處理與不處理檢測值的差值,經56 ℃水浴60 min處理與不處理檢測值的差值均較低,且假陰性率均為0.00%,說明經56 ℃水浴處理后標本檢測值最接近不處理時的檢測值,且對SARS-CoV-2核酸檢測結果的判定影響最小。本研究中56 ℃水浴60 min對檢測值的影響小于56 ℃水浴30 min,考慮可能與以下因素有關:將大批量標本放置于水浴鍋中加熱時,水浴時間太短會導致標本內部溫度不均勻,可能會影響病毒核酸的提取和PCR擴增[8],而延長水浴時間至60 min則可使標本受熱更均勻,溫度更接近或達到56 ℃。但有研究使用56 ℃水浴30 min處理咽拭子標本,發現該處理方法對SARS-CoV-2核酸檢測結果無明顯影響[9],但是該研究所檢測的陽性標本ORF1ab和N基因的Ct值為19~30,未能覆蓋病毒含量較低的標本,而本研究中陽性標本ORF1ab和N基因的Ct值為21.47~36.95,提示該結論同樣適用低病毒含量的標本。本研究56 ℃金屬浴30 min、56 ℃金屬浴60 min、化學裂解15 min、化學裂解30 min這4種標本前處理方法均出現了假陰性結果。56 ℃金屬浴處理后標本ORF1ab、N基因檢測值較不處理時有明顯變化,ORF1ab、N基因的檢出率也均低于不處理時的檢出率。該結果與華中科技大學同濟醫學院附屬同濟醫院檢驗科所得出的56 ℃金屬浴60 min滅活不影響呼吸道標本SARS-CoV-2核酸檢測結果的結論不一致[10]。對于56 ℃金屬浴和56 ℃水浴處理后結果不同的現象,考慮可能與升溫介質和升溫速度不同有關[9],具體原因目前尚未得到實驗驗證。而經化學裂解處理后標本檢測值較不處理時的檢測值有較大變化,且假陰性率高,其原因可能是標本經長時間裂解后,釋放的SARS-CoV-2核酸被RNA酶降解。
綜上所述,SARS-CoV-2核酸檢測的標本前處理方法應首選56 ℃水浴60 min和56 ℃水浴30 min,即使在病毒含量較低的標本中,經過該方法處理,病毒核酸依然能被檢出。而化學裂解法對標本核酸檢測結果影響最大,容易出現假陰性結果,不建議在日常實驗中使用。為減少標本前處理過程中可能導致的實驗室感染,應選擇水浴鍋這類穩定的加熱裝置讓標本均勻受熱,通過分散放置標本或適當延長加熱時間等措施使標本溫度達到56 ℃,確保SARS-CoV-2滅活達到實驗室安全要求。

