COPD合并2型糖尿病患者血清及呼出氣冷凝液中hs-CRP、IL-6的水平變化及臨床意義*
何海艷,吳丹丹,朱曼旎,馬 航,呂學東
南通大學第二附屬醫院呼吸內科,江蘇南通 226001
慢性阻塞性肺疾病(COPD)是一種嚴重危害人類健康的疾病,其特征是持續性氣流受限,病因與氣道及肺部對有害氣體和顆粒產生的異常炎性反應有關。除了肺功能異常外,COPD還可累及多種肺外器官和組織[1]。糖尿病是COPD最常見的合并癥,和COPD的不良預后密切相關。研究發現,與未合并糖尿病的COPD患者相比,合并糖尿病的患者2年死亡風險明顯升高[2]。本研究通過觀察COPD合并2型糖尿病(T2DM)患者的臨床特征、肺功能,以及血清、呼出氣冷凝液(EBC)中超敏C反應蛋白(hs-CRP)和白細胞介素-6(IL-6)的水平變化,探討炎性反應在COPD合并T2DM患者中的作用。
1 資料與方法
1.1一般資料 選取2018年1月至2019年3月在本院呼吸與危重癥醫學科門診就診的穩定期COPD患者64例為研究對象。按照是否合并T2DM分為COPD合并T2DM組和單純COPD組。COPD合并T2DM組33例,其中男18例,女15例;平均年齡(69.0±6.3)歲;病程(16.3±5.5)年。單純COPD組31例,其中男17例,女14例;平均年齡(69.6±5.1)歲;病程(15.1±5.8)年。納入標準:COPD與T2DM均符合相關診斷標準;年齡>18歲。排除標準:近期使用過糖皮質激素或抗菌藥物;合并其他肺部疾病、嚴重肝腎功能不全、感染性疾病、自身免疫性疾病、惡性腫瘤及血液系統疾病等。兩組年齡、性別、病程等一般資料比較,差異均無統計學意義(P>0.05)。所有患者均簽署知情同意書。本研究經本院醫學倫理委員會批準通過。
1.2方法
1.2.1肺功能及血氣分析指標檢測 采用肺功能儀檢測第1秒用力呼氣容積(FEV1)、用力肺活量(FVC)。抽取橈動脈血3 mL,用血氣分析儀檢測動脈血氧分壓(PaO2)和動脈血二氧化碳分壓(PaCO2)水平。
1.2.2心臟彩超檢查 采用彩色多普勒超聲診斷儀檢測三尖瓣最大返流速度(V),根據簡化伯努利公式計算肺動脈收縮壓(PASP)=4V2+右心房壓。右心房增大時PASP=4V2+10,右心房無增大時PASP=4V2+5,PASP>40 mm Hg認為存在肺動脈高壓。
1.2.3血清及EBC的收集及保存 采用德國JAEGER公司生產的EBC收集器收集EBC。首先安裝好收集管,將收集器預冷20 min,收集前讓受試者漱口,清潔口腔,常規帶鼻夾,通過咬口器平靜呼吸20 min。將收集的呼出氣冷凝物融化后移至 Ep管內,置人-70 ℃冰箱保存待測。抽取空腹肘靜脈血5 mL,室溫靜置 1 h后2 000 r/min離心15 min,吸取血清于Ep管中,-70 ℃冰箱保存待測。
1.2.4炎癥因子檢測 采用酶聯免疫吸附試驗(ELISA)檢測血清及EBC中的hs-CRP及IL-6水平。hs-CRP試劑盒購自森貝伽生物科技有限公司,IL-6試劑盒購自上海恪敏生物科技有限公司。
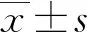
2 結 果
2.1兩組COPD病情比較 單純COPD組合并肺動脈高壓、1年內急性加重的人數比例低于COPD合并T2DM組,差異有統計學意義(P<0.05)。見表1。

表1 兩組COPD病情比較[n(%)]
2.2兩組肺功能及血氣分析指標比較 與單純COPD組比較,COPD合并T2DM組FEV1、FVC水平均明顯下降,差異有統計學意義(P<0.05)。兩組PaO2、PaCO2水平比較,差異無統計學意義(P>0.05)。見表2。

表2 兩組肺功能及血氣分析指標比較
2.3兩組血清及EBC中炎癥因子水平比較 與單純COPD組比較,COPD合并T2DM組血清及EBC中hs-CRP、IL-6水平明顯升高,差異有統計學意義(P<0.05)。見表3。

表3 兩組血清及EBC中炎癥因子水平比較
3 討 論
COPD最常見的危險因素是吸煙,其他危險因素包括遺傳因素、空氣污染、粉塵暴露及反復下呼吸道感染等。近年來研究表明,糖尿病也是引起COPD的危險因素[3]。肺部有豐富的肺泡毛細血管網,容易成為糖尿病微血管病變的累及部位。此外,COPD患者由于長期使用糖皮質激素及活動量下降,易導致肥胖,這些因素使得COPD患者易合并代謝綜合征和糖尿病。糖尿病作為COPD的合并癥與患者的疾病進展和不良預后相關,其可對肺部結構、炎性反應及細菌防御等方面產生影響。據報道,COPD合并糖尿病患者的病死率明顯高于未合并糖尿病患者,在調整年齡、性別、GOLD分級、合并癥等因素后,COPD合并糖尿病患者的2年病死率是非糖尿病COPD患者的1.62倍[4]。
COPD合并糖尿病的機制目前尚不明確,但炎性反應在COPD和糖尿病的發生中均起重要作用。RONA等[5]研究發現,COPD和T2DM之間有著相同的炎癥機制,二者的炎性反應均是由中性粒細胞、巨噬細胞及輔助性T細胞介導的。IL-6是一種具有多種生物學效應的細胞因子,參與COPD患者的全身炎性反應。CRP為急性時相反應蛋白,是全身炎性反應的主要標志物。研究表明,在COPD患者外周血中CRP、IL-6水平明顯升高,同時CRP、IL-6也被認為是胰島素抵抗和T2DM發生的預測因子[6-7]。在本研究中,COPD合并T2DM組血清CRP及IL-6水平明顯高于單純COPD組,提示炎癥因子水平升高在COPD合并T2DM的發病機制中起重要作用。除了全身系統炎癥外,COPD的主要發病機制還包括氣道、肺實質和肺血管的慢性炎癥。EBC是一種不干擾呼吸道生理或病理過程的用于檢測呼吸道生化成分的新型標本類型。EBC中的相關指標檢測是近年來出現的評價氣道炎癥、氧化應激和進行病理、生理診斷的先進手段。對EBC中炎癥因子的檢測可反映呼吸道局部的炎癥狀態[8]。本研究發現,COPD合并T2DM組EBC中CRP及IL-6水平明顯高于單純COPD組,提示COPD合并T2DM時不但系統性炎性反應增強,呼吸道局部的炎性反應也明顯增強,這與PEKALA等[9]的研究結果類似。
肺功能是判斷COPD患者病情嚴重程度的重要指標。糖尿病是一種慢性代謝性疾病,可引起多個靶器官損害,如糖尿病神經病變、腎臟病變、心血管病變和視網膜病變等,而這些靶器官損害的基本病理改變是微血管病變。肺也是一個微血管非常豐富的器官,因此也易受糖尿病的影響。研究表明,COPD合并T2DM與和肺功能下降有顯著相關性[10]。LANGE等[11]研究發現,糖尿病和FVC的快速下降有關,這提示糖尿病患者可能存在限制性通氣功能障礙。KAPOOR等[12]研究顯示,T2DM患者FEV1、FEV1/FVC、FVC水平均較健康人群明顯下降,進一步表明T2DM患者還存在阻塞性通氣功能障礙。本研究中,與單純COPD組相比,COPD合并T2DM組FEV1及FVC水平均明顯下降,提示COPD合并T2DM患者不但存在阻塞性通氣功能障礙,還存在限制性通氣功能障礙。雖然目前COPD合并T2DM患者肺功能快速下降的機制尚不清楚,但考慮加重的系統性炎性反應及呼吸道局部的炎性反應可能在其中起重要作用。增強的炎性反應可導致肺實質的破壞及小氣道的病變,這些均可引起肺通氣功能障礙。既往研究表明,T2DM可導致胸壁和支氣管樹蛋白的糖基化,肺結締組織膠原蛋白多肽間交聯的增加,以及肺毛細血管基底膜的增厚,這些病理改變亦可導致肺功能的下降[13]。
COPD合并T2DM患者增強的炎性反應還導致了更多的并發癥和頻繁的急性加重。本研究中,和單純COPD組相比,COPD合并T2DM組合并肺動脈高壓的人數比例明顯增高。目前,關于肺動脈高壓的病因學分類中并未提及高血糖的潛在作用,然而有證據表明糖尿病是肺動脈高壓的獨立預測因子[14]。英國的一項調查顯示,在50歲以上的肺動脈高壓患者中23%合并糖尿病,高于健康人群的糖尿病發病率,表明糖尿病和肺動脈高壓之間存在聯系[15]。高血糖和胰島素抵抗可影響肺動脈高壓形成的多條信號通路,如高血糖可抑制內皮細胞一氧化氮合酶,從而減少內皮細胞一氧化氮(NO)的生成[16];高血糖還可激活內皮細胞中的蛋白激酶C,進一步減少NO的產生,同時增加內皮素、腫瘤壞死因子-β水平;此外,局部高血糖和因此產生的氧化應激和炎性反應增加了毛細血管的通透性[17]。以上因素共同參與了肺動脈高壓的發生和發展。本研究中,COPD合并T2DM組1年內急性加重人數比例明顯高于單純COPD組,這可能與炎性反應增強及呼吸道局部高血糖水平更利用病原體的生長、繁殖,呼吸道局部免疫防御功能減弱有關。
綜上所述,炎性反應在COPD合并T2DM中起重要作用。COPD合并T2DM患者肺功能下降更明顯,更易合并肺動脈高壓,病情急性加重也更頻繁。提示臨床更好地控制血糖可延緩肺功能下降,減輕COPD患者的炎性反應。

