EPA、DHA改善神經系統的幾種間接機制研究進展
張德勇 許曉路
(浙江樹人大學生物與環境工程學院,杭州 310015)
ω-3多不飽和脂肪酸(ω-3 PUFA)在促進神經系統健康方面的功效已經被反復證實,其中研究最多的兩種分子是二十碳五烯酸(Ecosapentaenoic acid,EPA)和二十二碳六烯酸(Docosahexaenoic acid,DHA)。它們還被嘗試應用于治療阿爾茨海默病(Alzheimer disease,AD)、帕金森病(Parkinson′s disease,PD)等神經退行性疾病的治療,且確實能發揮一定的療效[1,2]。但對于EPA、DHA保護神經系統的分子機制,目前所知有限。簡單來說,其機制涉及到直接機制和間接機制兩個方面。
直接機制方面,主要體現在DHA、EPA(尤其是DHA)本身就是神經細胞的重要組成成分。DHA是腦中最主要的ω-3 PUFA,占腦PUFA的40%。因此,DHA本身對細胞膜的酰基鏈順序、膜流動性、相行為、壓縮、滲透性、融合、觸發器和蛋白質活性等諸多物理特性有直接的影響,還可驅動膽固醇耗盡區的生成。但是值得注意的是,從含量占比看,EPA的重要性似乎遠不如DHA,EPA在腦中的含量通常比DHA低250~300倍。二者在腦磷脂中的結合部位也不同,DHA主要結合到磷脂酰乙醇胺(PE)和磷脂酰絲氨酸(PS),而EPA更傾向于結合到磷脂酰肌醇(PI)[3]。但是越來越多的研究顯示,EPA、DHA對神經系統的保護作用更多是通過各種復雜的間接機制來發揮作用的,包括調控神經干細胞分化、調控突觸蛋白表達、抗氧化應激、調節炎癥平衡等,而且很多時候還是先轉化成一些衍生物再發揮作用的。本文對近年來在這些間接機制方面的研究做一個簡要回顧。
1 EPA、DHA促進神經干細胞分化的機制
有大量體內、體外實驗顯示ω-3 PUFA能促進神經干細胞向神經元的分化,但早期的研究未意識到對不同種類的ω-3 PUFA也需要進一步精細區分。對比DHA和EPA的效應,1 μmol/L的DHA和EPA均促進了神經干細胞的分化,且促進程度比較接近。然而,二者在機制方面,所針對的細胞周期相關轉錄因子卻似乎有所不同。EPA顯著提高了Hes1的含量,而DHA卻降低了其含量。Hes1是一種抑制型轉錄因子,它抑制神經干細胞的分化,促進其增殖。此外,限制EPA導致了Hes6升高,后者與Hes1形成正反饋回路,促進神經元分化[4]。Mandhair等[5]研究表明EPA和DHA對神經發生的影響機制是不完全一致的,在其研究中,10 mol/L的EPA顯著促進了神經元增殖,而10 mol/L的DHA則抑制了其增殖,但是抑制神經元增殖可以理解為與促進其分化具備同等作用[5]。EPA和DHA在調節神經干細胞命運中的發揮的作用可能是基于在它們通過協作,維系bHLH (basic helix-loop-helix) 轉錄因子使其處于適當的表達水平。
添加EPA和DHA被觀察到對神經干細胞的發育具有調節作用,但目前尚不清楚其機制是否基于EPA、DHA的直接作用。研究顯示,一些衍生物可能參與了這個過程,如DHA-EA(N-二十二碳六烯醇乙醇胺,又稱突觸胺)能通過激活“PKA/cAMP反應元件結合蛋白”而誘導神經干細胞分化[6]。此外,DHA氧化后的衍生物NPD1也被證明能促進胚胎干細胞的神經分化[7]。
2 EPA、DHA促進突觸生成、改善突觸傳遞的機制
DHA對大鼠嗜鉻細胞瘤-12(PC-12)細胞突起生成的長度和復雜性、大鼠胚胎海馬的原代培養、大鼠胚胎皮層神經元等均有促進效應。除了促進神經突起的生長外,DHA還促進了大鼠海馬神經元的突觸形成[8]。Robson等直接比較了DHA、EPA對幼年(出生后第3天和第9天)、成年(2—4個月)和老年(18—20個月)大鼠的初級感覺神經元的軸突促進效應。EPA、DHA在發育期都能促進神經突起的生長;但對于老齡大鼠,則只有DHA能產生正向作用[9]。
DHA、EPA的這些效應可能與突觸蛋白的表達有密切關聯。用DHA處理后,突觸蛋白如突觸素、突觸前密度蛋白95等的表達水平有所增加,這些蛋白是有助于改善突觸傳遞功能的[10,11]。Cao等[12]研究也證實DHA能促進大鼠海馬神經元的突觸蛋白和谷氨酸受體的表達。在大鼠生長期,DHA長期缺乏可導致突觸蛋白以及NMDA受體、AMPA受體表達量的降低。懷孕期母鼠ω-3 PUFA的缺乏可導致子鼠海馬NMDA受體的亞單位NR1、NR2A和NR2B表達量的下降。
PUFA的某些衍生物可能也參與了促進突觸發生的機制。例如DHA-EA (N-二十二碳六烯醇酰胺,又稱突觸酰胺、突觸胺)能促進神經元突觸的形成。在GPR110 KO小鼠大腦中的突觸蛋白表達和突觸數量可顯著降低,消除了DHA-EA還誘導神經源性分化和神經突增生,表明了DHA-EA/GPR110 信號可能為神經發生和突觸形成的重要機制。DHA-EA還能促進蛋白激酶A底物的磷酸化,從而激活cAMP反應元件結合蛋白(CREB)信號通路,而CREB在突觸形成方面具有重要的調節作用。
3 EPA、DHA的抗氧化應激效應
神經系統中的DHA可以清除自由基、避免脂蛋白的過氧化、抑制氧化應激,緩解炎癥反應和腦神經細胞凋亡。氧化應激開始時,未酯化的DHA經磷脂酶A2游離出來,代謝成二十烷類,其中的神經保護素protectin D1是氧化應激反應中引起凋亡的產物和COX2的抑制劑[13]。
4 EPA、DHA對炎癥的調節作用
PUFA 從細胞膜磷脂池中游離出來后可代謝生成百余種脂類炎癥調節介質。一般而言,源于ω-6 PUFA的衍生物往往具有促炎癥效應,而源于ω-3 PUFA的衍生物則往往具有抗炎作用(但是仍有某些分子呈現微弱的促炎效應),加上二者的代謝存在對酶系的競爭,因此可以視為二者從兩個相反的方面共同協調機體的炎癥平衡。由于ω-6 PUFA不在本文討論范圍,在此僅僅討論一下源于EPA、DHA這兩種ω-3 PUFA的脂質炎癥調節介質。在治療神經退行性疾病的研究中多項研究顯示,這些炎癥介質的調節作用也是EPA、DHA發揮保護神經作用的重要機制。如圖1、圖2及表1所示,游離的EPA、DHA在環氧合酶(Cyclooxygenase,COX)、脂氧合酶(Lipoxygenase,LOX)和細胞色素P450混合功能氧化酶(CYP450)三種酶系的催化下,可以轉化成一系列的炎癥介質分子,包括前列腺素(PG)、白三烯(LT)、消退素(Rv)、神經保護素(NPD)、環氧二十碳四烯酸(EEQs)、環氧二十碳五烯酸(EDPs)、親電脂肪酸氧合衍生物(EFOX)、maresins(MaR)等。
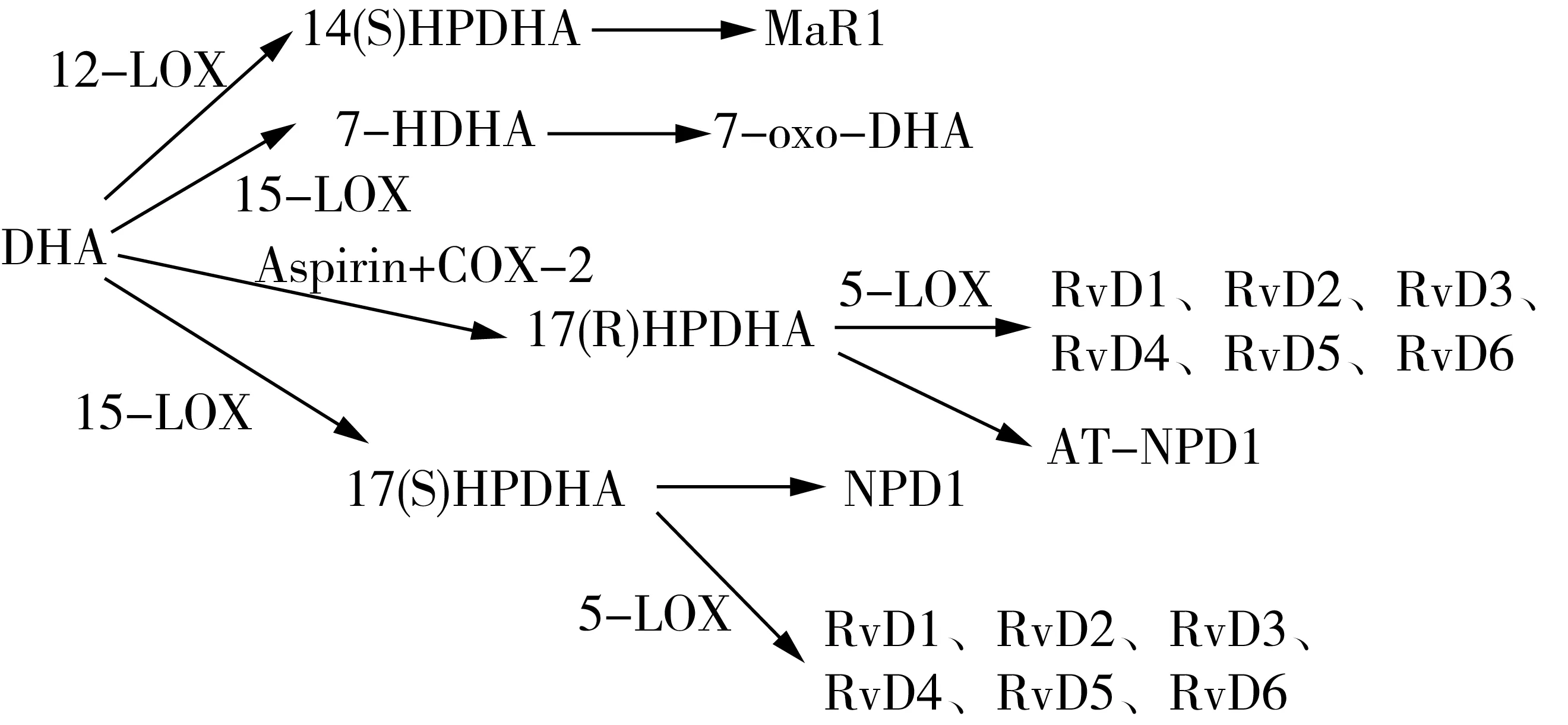
圖2 DHA幾類衍生物的代謝生成途徑[8]
4.1 前列腺素
如圖1、表1所示,EPA可代謝生成某些3系列的前列腺素(PG),但3系列的PG總體而言,對炎癥的調節效應較為微弱,其中某些類別如PGG3、PGH3尤其短暫,會快速轉化成下游的各種其他種類的PG分子。就炎癥調節效應而言,3系列的PG發揮的是促炎癥效應,但是活性微弱,遠不如2系列的PG(由ARA代謝而來)。如PGE2對COX-2 基因表達以及IL-6 生成的誘導作用非常顯著,而PGE3的作用就非常微弱。值得注意的是,3系列的PG仍屬于促炎癥介質,與消退素等其他介質分子相反,這使得EPA、DHA的衍生物對炎癥的調節效應其實是呈現出了雙向調節效應,只不過總體以消退效應為主。再從整體角度看,EPA還與ARA等其他脂肪酸競爭了酶,降低了其他促炎介質的產生,又間接發揮了緩解炎癥的效應,因此其調節效應是多樣化的。
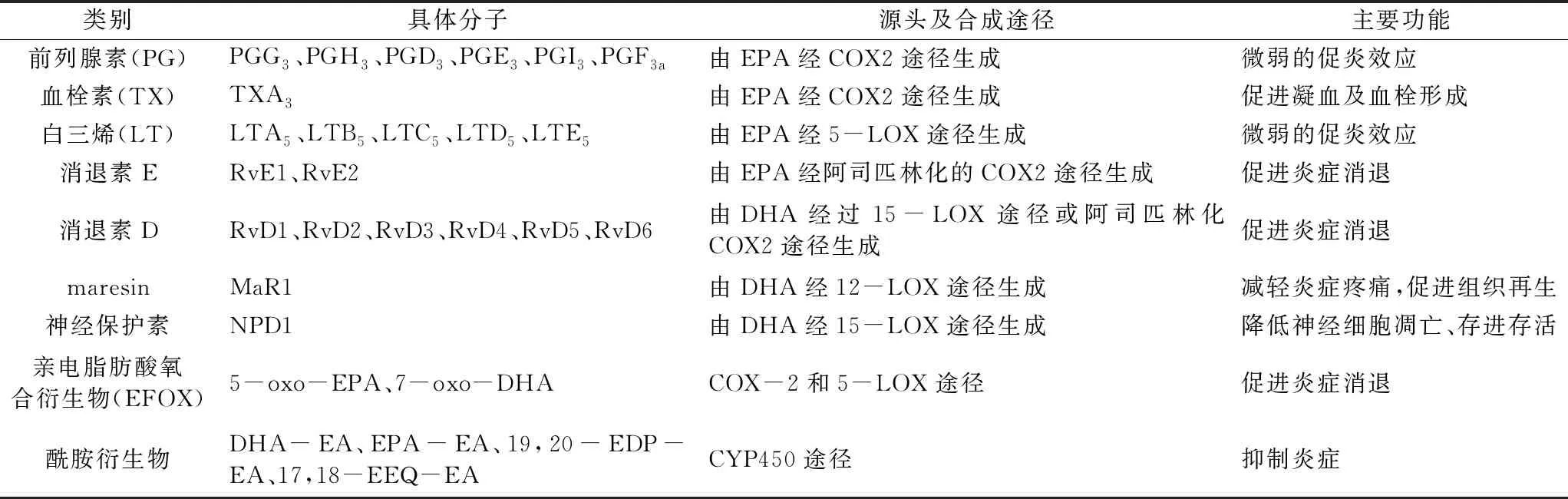
表1 由EPA、DHA衍生的幾種炎癥介質分子
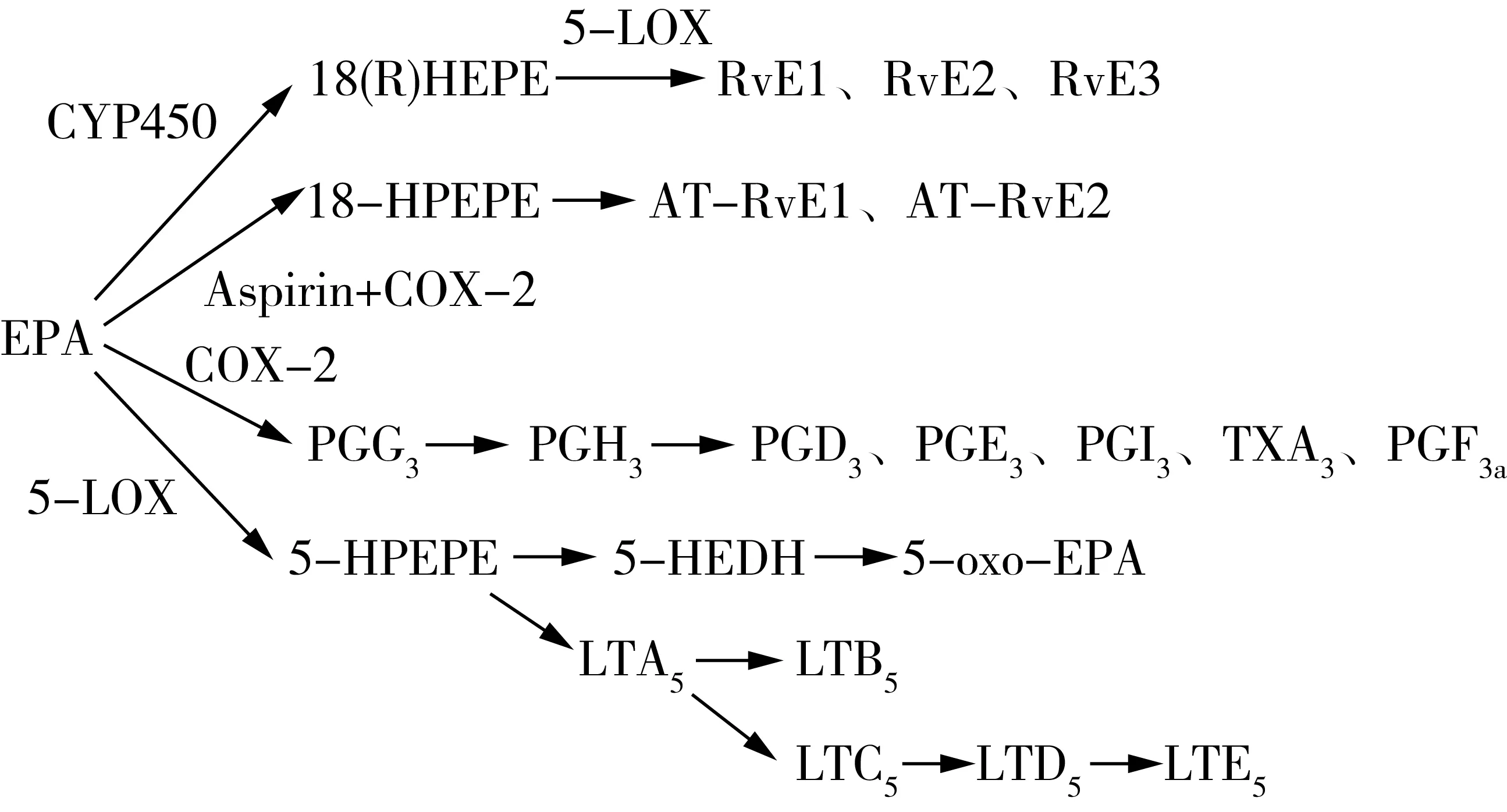
圖1 EPA幾類衍生物的代謝生成途徑[8]
4.2 白三烯
EPA經5-LOX 途徑生成5 系列的白三烯(LT),具有一定的促炎效應。但是與前列腺素的情況差不多,5系列的LT對炎癥的促進性的調節作用也是較為微弱的,遠不像其他系列的LT那么顯著。例如4系列的LT有明顯的促炎癥效應,LTB4對中性粒細胞的趨化作用較LTB5高出10~100 倍,高水平的LTB4被認為是腦動脈硬化所致進展性缺血性腦卒中的危險因素之一[14]。當然,從更宏觀的角度看,機體代謝生成5系列LT與生成其他系列的LT本身是存在酶的競爭關系的,從這個角度看,生成3系列LT本身緩解了其他更強烈的促炎LT的生成,又對炎癥起到一定的緩解效應,因此其效應應該從多個角度來綜合看待。
4.3 消退素
消退素(Resolvin,Rv)包括源于EPA的RvE系列(RvE1、RvE2)和源于DHA的RvD系列(RvD1、RvD2、RvD3、RvD4、RvD5 和RvD6),它們由一般是由LOX酶或酰基化的COX-2酶催化而生成[15]。消退素可通過多個方面發揮強大的抗炎活性,其中最主要的包括調節炎癥細胞的趨化性和吞噬能力,以及控制多種促炎癥介質(如前列腺素PG、白三烯LT等)的表達和活性[12-15]。近年來對消退素信號途徑和受體的研究取得較大進展。現有研究主要集中在RvE1、RvE2、RvD1、RvD2、RvD3和RvD5幾種消退素的信號途徑,發現它們的受體屬于跨膜G蛋白偶聯受體(GPCRs),并通過這一途徑發揮消退效應。共發現4種消退素受體分子:D消退素受體1(DRV1/GPR32)、D消退素受體2(DRV2/GPR18)、脂蛋白和甲酰肽受體2(ALX/FPR2)和趨化因子樣受體1(CMKLR1,亦稱ERV1/ChemR23)[16]。
RvE1與ERV1/ChemR23結合后可激活下游通路,產生的結果包括中性粒細胞凋亡被促進、巨噬細胞介導的吞噬作用增強、炎癥細胞NF-κB信號傳導被抑制、促炎細胞因子的產生減少[17,18]。與RvE1相比,RvE2介導的促消退效應更傾向于針對中性粒細胞。然而,RvE1和RvE2是否共享同樣的受體和信號途徑尚不清楚[16,17]。RvD系列消退素能結合DRV1/GPR32、DRV2/GPR18和ALX/FPR2,但對3種不同的受體分子的親和力大小并非一成不變的。RvD1通過ALX/FPR2和DRV1/GPR32傳輸信號,RvD2通過DRV2/GPR18途徑傳輸信號,RvD3通過ALX/FPR2和DRV1/GPR32傳輸信號,RvD5通過DRV1/GPR32傳輸信號[16]。ALX/FPR2途徑的激活產生的結果是抑制p38絲裂原活化蛋白激酶(MAPK)的磷酸化,抵消中性粒細胞和巨噬細胞遷移和產生促炎癥介質的能力[18]。DRV1/GPR32信號不僅促進巨噬細胞介導的吞噬作用和巨噬細胞向預分解表型的極化,而且還通過阻止T細胞向Th1和Th17表型分化和促進調節性T細胞的生成來調節適應性免疫應答。另外,RvD2-DRV2/GPR18軸除了參與調節中性粒細胞浸潤能力和巨噬細胞介導的吞噬功能外,似乎在調節小膠質細胞功能方面發揮著關鍵作用[16]。
RvE1特異性結合孤兒受體ERV1/ChemR23和BLT1(一個白三烯B4受體),而RvD1特異性結合DRV1/GPR32和ALX(一個脂蛋白A4受體)。這種特異性可能決定了源于EPA和源于DHA的SPM發揮各自獨特的效應。值得注意的是,同一種消退素受體也可以因環境變化、激動劑的存在等原因而激活不同的下游信號通路。而且除了消退素等促消退介質,一些促炎介質也可能激活消退素受體,但導致的生物反應傳導卻可能是不同、甚至完全反向的。例如,chemerin和lipoxin A4可分別作為ERV1/ChemR23和ALX/FPR2的促炎配體[16]。此外,一些消退素也可能與其他受體結合,超出其特定的GPCRs,從而促進多途徑的促分解作用。例如,RvE1可作為白三烯B受體1(BLT1)的部分激動劑,抑制白三烯誘導的白細胞促炎信號[19]。因此,消退素及其受體在參與炎癥平衡方面除了主要的促分解效應,還有許多復雜微妙的不同效應存在,還有許多疑問有待進一步研究。
4.4 保護素
在DHA的衍生物中,還有一類神經保護素protectins。就保護神經系統的角度而言,其中最值得關注的是神經保護蛋白D1(NPD1,10R-17S-二羥基-二十二碳六烯酸),NPD1可因氧化應激、癲癇、腦缺血-再灌注以及有神經營養素存在等情況下迅速生成,往往在神經損傷反應中啟動大量合成,對腦損傷、暴露于β淀粉樣肽的大腦有保護作用,被看好未來能應用于許多神經相關疾病的治療[20]。關于NPD1在衰老和阿爾茨海默病(AD)大腦中的腦細胞存活和修復中的作用方面也取得了較大進展,如戴頌陽發現其通過抑制GSK-3β活性在AD病人中發揮神經保護作用,抑制GSK-3β活性后可以降低Aβ42的表達、降低Tau蛋白過度異常磷酸化水平、降低細胞凋亡率、改善自噬活性等諸多神經保護作用[21]。
至于EPA衍生的SPMs,尚未發現有明確的神經保護素或類似分子,其神經保護作用情況尚有待進一步探索。
4.5 Maresins
Maresins(MaR)是近年來新發現的一種炎癥因子,尚無統一的翻譯名稱,本文采用英文原名。Maresins是由巨噬細胞中的DHA在12-LOX酶的催化下生成。目前發現的maresins主要包括3 種,即maresin1、maresin2、maresin-LS,其中maresin-LS又可分為maresin-L1 和maresin-L2。它們分別在炎癥消退階段由內源性DHA 通過脂加氧酶、可溶性環氧化物水解酶和細胞色素P450 等一系列酶促反應合成的一類含多羥和多不飽和共軛雙鍵分子,其碳鏈長度均為22C,包含6個雙鍵。根據其羥基的位置及構象、雙鍵位置及構象的不同而命名不同[22]。
Maresin1 可通過限制中性粒細胞浸潤、增強巨噬細胞吞噬凋亡中性粒細胞及壞死細胞、抑制促炎介質的產生、抑制核因子κB (nuclear factor κB,NF-κB) 的活性、促進調節性T 細胞的從頭合成、提高細胞內cAMP水平,使炎癥消退,并且能發揮減緩炎性疼痛、促進組織再生等效應。Maresin1 對巨噬細胞的影響,除了抑制其產生促炎性介質,還能導致細胞表型由經典活化型轉變為炎癥消退型,從而促進凋亡細胞的吞噬作用、加速炎癥消退。Maresins的炎癥調節效應在全身各處能發揮廣泛的作用,其中也包括在神經系統中,可能是其保護神經系統的機制之一。在各種急、慢性炎癥引起人體組織的紅腫熱痛、組織損傷時,瞬時受體電位香草酸亞型1(Transient receptor potential family vanilloid subtype 1,TRPV1)表達于初級感覺神經元并在介導疼痛和受傷后痛覺過敏中起重要作用。在小鼠上的一項研究通過在小鼠足底注射辣椒素引起炎性疼痛時注射Maresin1,發現Maresin1 能劑量依賴性地抑制發生在神經元的TRPV1電流,阻斷辣椒素誘導的內向電流,從而減輕小鼠炎癥性疼痛[22]。另外還有研究顯示,maresin1能減輕小鼠腹腔注射化療劑長春新堿(Vincristine, Oncovin,VCR)引起的化療后神經性疼痛[22]。在渦蟲(一種身體受傷后能夠快速再生的低等無脊椎生物)上面的研究發現,當人工切除其前部并暴露于促消退介質分子中時,此時maresin1 的生物合成被迅速激活,并顯著刺激了組織的再生,而且其效應呈現劑量依賴性[22]。這些結果表明,maresin1 為促進器官組織再生及減輕炎性疼痛提供了新的代謝途徑
4.6 親電脂肪酸氧合衍生物(EFOX)
親電脂肪酸氧合衍生物(EFOX)是一類由COX-2和5-LOX合成的、源自EPA和DHA的新型脂類抗炎介質分子,包括5-oxo-EPA和7-oxo-DHA[23]。EFOXs被證明具有廣泛的抗氧化作用和抗炎作用,包括作為核轉錄因子的激動劑、過氧化物酶體增殖物激活受體γ(PPARγ),激活Nrf2依賴的抗氧化反應,抑制細胞因子的產生和誘導的NO活化巨噬細胞中的表達。有研究顯示,連續4個月每天補充1g EPA和0.4g DHA顯著增加了5-oxo-EPA和7-oxo-DHA的形成,與源于DHA的消退素的產生趨勢相似,顯示了它們遵循統一途徑;而且,COX-2的阿司匹林乙酰化也顯著增加了EFOXs的產生,進一步顯示出其合成途徑。盡管EFOX的研究尚且較為有限,每種EFOS分子各自的效應尚待精確區分,但上述發現至少表明,在EPA、DHA發揮抗炎和促炎癥消退作用方面,不能忽視這些新發現的介質所起到的貢獻[8]。
4.7 酰胺類衍生物的抗炎作用
DHA-EA、EPA-EA分別是DHA和EPA酰胺衍生物,在分化脂肪細胞中的研究顯示,補充DHA-EA可減少促炎性細胞因子白細胞介素6(IL-6)、單核細胞趨化蛋白1(MCP-1)等的產生[24]。在大腦小膠質細胞中,DHA-EA和EPA-EA還可以被進一步環氧化變成環氧二十碳五烯酸-乙醇酰胺(19,20-EDP-EA)、環氧二十碳四烯酸-乙醇酰胺(17,18-EEQ-EA)。McDougle等在小膠質細胞上證實了19,20-EDP-EA 和17,18-EEQ-EA均可抑制促炎生物標記物IL-6 及NO的產生,同時促進了抗炎細胞因子白細胞介素10(IL-10)的生成,表明它們參與了炎癥調控,發揮抑制炎癥的效應[25,26]。
5 EPA、DHA對微管蛋白的調節效應
Serrano-Garcia等研究發現DHA還可以通過調節微管蛋白發揮神經保護作用。微管蛋白是細胞骨架中的微管的主要結構單元,對神經元的生長、形態、運輸和極性等起著至關重要的作用。該研究發現魚藤酮可使α-微管蛋白降低,而用DHA預處理則可降低魚藤酮對微管蛋白的不良影響,發揮保護作用[27]。
6 展望
雖然PUFA早就被發現有益于神經系統的健康,但早期對其作用機制的認識較為籠統,既未意識到需要精確區分不同種類的PUFA分子所具有的不同效應,也未意識到其各類代謝衍生物在促進神經系統健康中的具體參與程度。如上所述,近年來的研究在鎖定了EPA、DHA等具體PUFA分子之后,進一步加大了對其代謝衍生物的關注、研究。尤其是神經保護素、消退素、Maresins等對神經系統健康起到重要調節作用的分子更是成為了近年來的研究熱點。這些研究有助于揭示PUFA在保護神經系統健康方面以往被忽略的一些重要的間接機制,也有助于將來更精確、更科學地將PUFA或其某些衍生物應用于治療AD、PD等神經退行性疾病。

