靈芝抑制腫瘤微環境中Treg細胞功能的機制
李 芳, 余夢瑤, 江 南, 賀黎銘, 姚 珂, 羅 霞
(四川省中醫藥科學院菌類藥材研究所, 菌類藥材系統研究與開發實驗室, 中藥材品質及創新中藥研究四川省重點實驗室, 成都 610041)
1 引 言
靈芝是我國傳統的補益中藥,具有扶正固本的作用,現代藥理研究表明靈芝具有抑制腫瘤[1]和免疫調節作用[2],近年來常被用于腫瘤放化療的輔助治療.靈芝多糖和三萜是其主要藥效成分,多糖對體外培養的腫瘤細胞無直接抑制作用,其抑瘤作用與免疫調節密切相關:促進樹突細胞成熟和分化[3],增強巨噬細胞的吞噬功能[4],促進自然殺傷細胞活性[5]等;而靈芝三萜類成分主要通過直接毒殺腫瘤細胞而發揮抗腫瘤作用[6],二者抗腫瘤作用沒有直接的可比性,但適宜的配伍能有效提高抗腫瘤作用[7].
調節性T細胞(Treg細胞)是以CD4+CD25+FOXP3+為特征的T淋巴細胞亞群,是體內重要的免疫負調控細胞,是腫瘤免疫逃逸的關鍵因素[8].研究發現靈芝孢子多糖能有效抑制Treg細胞功能.但是靈芝子實體三萜、多糖配伍是否能有效提高對Treg細胞功能的抑制作用,目前尚無相關的研究報道.本研究利用前期研究獲得的最佳抑瘤配伍劑量[7],開展該方面的深入研究,有利于進一步闡釋靈芝抗腫瘤的作用機制.
2 材料與方法
2.1 主要試劑
二甲亞砜(DMSO)、透明質酸酶、DNA酶Ⅰ、膠原酶Ⅳ、牛血清白蛋白(BSA),購自sigma公司.小鼠腫瘤浸潤組織淋巴細胞分離液購自上海研謹生物科技有限公司.CD3-PerCP-Cy5.5、CD4-FITC、CD25-APC、foxp3-PE流式抗體購自BD生物科技公司.Foxp3染色固定透膜液購自invitrogen公司.UNlQ-10柱式Trizol總RNA抽提試劑盒,購自生工生物工程股份有限公司.瓊脂糖B、4S Red Plus 核酸染色劑、2X SG Fast qPCR Master Mix購自BBI公司;GeneRuler DNA Ladder Mix、反轉錄試劑盒,購自Thermo Scientific公司.ELISA試劑盒均購自上海茁彩生物科技有限公司;兔抗FOXP3多克隆抗體購自美國R&D公司.多聚甲醛購自國藥集團化學試劑有限公司.蘇木素購自北京百靈威科技有限公司.中性樹膠購自中國上海懿洋儀器有限公司.其余常用化學試劑購自成都科龍化工試劑廠.
2.2 方 法
2.2.1 實驗動物造模和分組 Km(昆明種)小鼠,SPF級,雄性,體重18~22 g,由四川省中醫藥科學院動物中心提供,動物生產證號:SCXK(川)2013-19,飼養于SPF級動物房.靈芝多糖和三萜從赤芝子實體中提取獲得.H22細胞株購自中科院細胞所,于小鼠腹腔內傳代保存.每只小鼠右側腋窩皮下準確接種H22細胞 2×106個,接種次日,小鼠隨機分成對照組、三萜組、多糖組和配伍組,每組20只,分別以溶劑、靈芝三萜(90 mg/kg)、多糖(43 mg/kg)及多糖三萜(90 mg/kg+43 mg/kg)配伍腹腔注射給藥,連續給藥15 d,從第3 d起每2 d檢測一次腫瘤直徑,末次給藥結束后頸椎脫臼處死小鼠,分離腋下腫瘤稱重,計算抑瘤率和體積(0.52×長×寬2),繪制腫瘤生長曲線.
2.2.2 靈芝多糖和三萜的提取 按照《中國藥典2015版》中靈芝多糖和三萜提取和含量測定方法操作[9],采用Sevag法除去提取物中的蛋白質后對靈芝多糖和三萜含量進行測定。
2.2.3 流式細胞術檢測Treg細胞數量 解剖小鼠腫瘤組織,用RPMI1640培養基洗去血污.稱取1 g左右的腫瘤組織,加入4 mL酶解液,用眼科剪剪碎至2~5 mm3大小,置37 ℃酶解2 h.取酶解液,以200目不銹鋼網過濾,除去未酶解完全的組織塊.取玻璃試管,加入5 mL小鼠腫瘤浸潤淋巴細胞分離液,離心后獲得淋巴細胞.洗滌淋巴細胞兩次后加入CD3、CD4、CD25抗體室溫避光孵育30 min后離心5 min,棄上清.加入1 mL染色緩沖液,重懸細胞,400~600 g離心5 min,棄上清.完成表面抗原染色后的細胞,再加入1 mL Foxp3染色固定透膜液,室溫孵育1 h.加入透膜緩沖液重懸細胞,離心后棄上清,加入FOXP3抗體染色后上流式細胞儀檢測.
2.2.4 熒光定量PCR檢測mRNA水平 按15~25 mg小鼠腫瘤組織加入0.5 mL Trizol用勻漿器勻漿處理,獲得的勻漿液按柱式 Trizol 總RNA抽提試劑盒操作步驟進行總RNA提取,按照反轉錄試劑盒說明書將RNA逆轉錄為cDNA.PCR反應體系:2×SybrGreen qPCR Master Mix 10 μL、正反引物各0.4 μL、cDNA模板2 μL、ddH2O 7.2 μL.PCR循環條件:95 ℃預變性3 min,95 ℃ 5 s,60 ℃ 30 s,45個循環.為保證結果的精確性,重復三次每個反應.
引物序列:
GAPDH-F:5′-GGTTGTCTCCTGCGACTTCA-3′,
GAPDH-R:5′-TGGTCCAGGGTTTCTTACTCC-3′;
CCL22-F:5′-TCTCGTCCTTCTTGCTGTGG-3′,
CCL22-R:5′-GCAGAGGGTGACGGATGTAGT-3′;
CCR4-F:5′-CATCTCGGATTTGCTGTTCG-3′,
CCR4-R:5′-CTGGTGATGACGCCATAGGT-3′;
FOXP3-F:5′-TGGTTTACTCGCATGTTCGC-3′,
FOXP3-R:5′-AACTCAAATTCATCTACGGTCCA-3′.
2.2.5 ELISA法檢測細胞因子含量 將小鼠腫瘤組織研磨成細胞懸液,離心后取上清,然后按試劑盒說明書進行具體操作.用酶標儀在450 nm波長下測定吸光度(OD值),計算樣品濃度.
2.2.6 免疫組化染色法檢測腫瘤組織中FOXP3蛋白的表達 處死小鼠,解剖下腫瘤組織,放入4%多聚甲醛溶液中,固定48 h,常規梯度酒精脫水,石蠟包埋,制備組織切片.脫蠟后的切片放入染色缸,3%甲醇雙氧水室溫10 min;PBS洗3次,每次5 min;將切片浸入0.01 mol/L檸檬酸鹽緩沖液(pH 6.0),微波爐中高火加熱至沸騰后斷電,間隔5 min后,反復1次,冷卻后,PBS洗2次,每次5 min;滴加山羊血清封閉液,室溫20 min;滴加一抗,4 ℃過夜;滴加生物素化二抗,37 ℃30 min;PBS水洗3次,每次5 min;DAB顯色:使用DAB顯色試劑盒,混勻試劑后滴加到切片上,室溫顯色,鏡下控制反映時間2 min,蒸餾水洗滌;蘇木素輕度復染,脫水,透明,中性樹膠封片.采用顯微成像系統拍照后,以Image pro plus6.0軟件對陽性表達區域進行累積光密度(IOD)分析.

3 結果與分析
3.1 靈芝多糖和三萜的含量測定
3.1.1 靈芝多糖含量 按中國藥典中硫酸蒽酮法檢測,靈芝多糖標準曲線測定結果如下:

圖1 多糖標準曲線Fig.1 Polysaccharide standard curve
根據樣品吸光度由公式y=8.6905x+0.2176計算出提取物樣品中多糖含量為481.90 mg/g.
3.1.2 靈芝三萜含量 按中國藥典中方法檢測,靈芝三萜標準曲線測定結果如下:
根據樣品吸光度由公式y=12.634x+0.0106計算出提取物中三萜含量為434.40 mg/g.

圖2 三萜標準曲線Fig.2 Triterpene standard curve
3.2 H22荷瘤小鼠瘤體生長情況
小鼠處死后立即解剖下腫瘤組織,稱重,各組小鼠瘤重及腫瘤體積分別見表1和圖3.與對照組相比,各給藥組解剖下的小鼠瘤重都明顯更輕,其中靈芝多糖組具有顯著性差異(P<0.05),配伍組具有極顯著性差異(P<0.01);配伍組抑瘤率明顯高于多糖組和三萜組,差異具有統計學意義(P<0.05,P<0.01).各給藥組腫瘤體積均較對照組減小(P<0.05,P<0.01),配伍組腫瘤體積明顯小于多糖組和三萜組,差異具有統計學意義(圖 1,P<0.05,P<0.01).表明靈芝多糖和三萜均能抑制小鼠H22瘤體生長,二者配伍給藥能增強抑瘤作用.
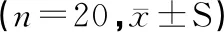
表1 小鼠瘤體重量及抑瘤率
圖3 腫瘤生長曲線圖
3.3 靈芝對小鼠腫瘤微環境中Treg細胞數量的影響
經流式細胞法測定小鼠腫瘤組織中Treg細胞(CD4+CD25+foxp3+)在CD4+細胞中的比例,統計結果如表 2所示,流式結果圖見圖4.與對照組相比,各給藥組小鼠腫瘤微環境中Treg細胞比例均有所降低,差異具有統計學意義(P<0.05,P<0.01);配伍組Treg細胞比例明顯低于三萜組和多糖組,差異具有統計學意義(P<0.05).結果表明,靈芝多糖和三萜均能降低腫瘤微環境中Treg細胞比例,二者配伍給藥具有協同效應.
表2 小鼠腫瘤微環境中Treg細胞比例
3.4 Treg細胞趨化相關關鍵基因的RT-PCR檢測
經檢測小鼠腫瘤微環境中Treg 細胞趨化相關關鍵基因:趨化因子CCL22及其受體CCR4和FOXP3在腫瘤組織中的表達,結果如圖5所示.與對照組相比,靈芝三萜組和多糖組中相關基因的表達無明顯變化,配伍組相關基因的表達明顯降低,差異具有統計學意義(P<0.01),配伍組的CCL22、CCR4和FOXP3基因表達水平都明顯低于三萜組和多糖組,差異具有統計學意義(P<0.01).結果表明,靈芝三萜、多糖配伍給藥能降低Treg 細胞趨化相關關鍵基因的表達,減少Treg細胞向腫瘤微環境中趨化.

圖4 小鼠腫瘤微環境中Treg細胞比例流式圖Fig.4 FACS analyses of Treg cell ratio in mouse tumor microenvironment

圖5 腫瘤微環境中基因表達分析圖
3.5 腫瘤微環境中細胞因子水平
經檢測腫瘤組織中細胞因子IL-10、TGF-β1和IL-2含量,統計結果如圖6所示.與對照組相比,各給藥組的IL-10和TGF-β1的含量均有所降低,其中多糖組和配伍組差異具有統計學意義(P<0.05);配伍組IL-10和TGF-β1水平明顯低于三萜組和多糖組,差異具有統計學意義(P<0.05).與對照組相比,各給藥組的IL-2的含量均有所降低,多糖組和配伍組差異具有統計學意義,配伍組IL-2水平明顯高于三萜組和多糖組(P<0.05).結果表明,靈芝三萜和多糖均能降低IL-10和TGF-β1水平,同時增加IL-2水平.
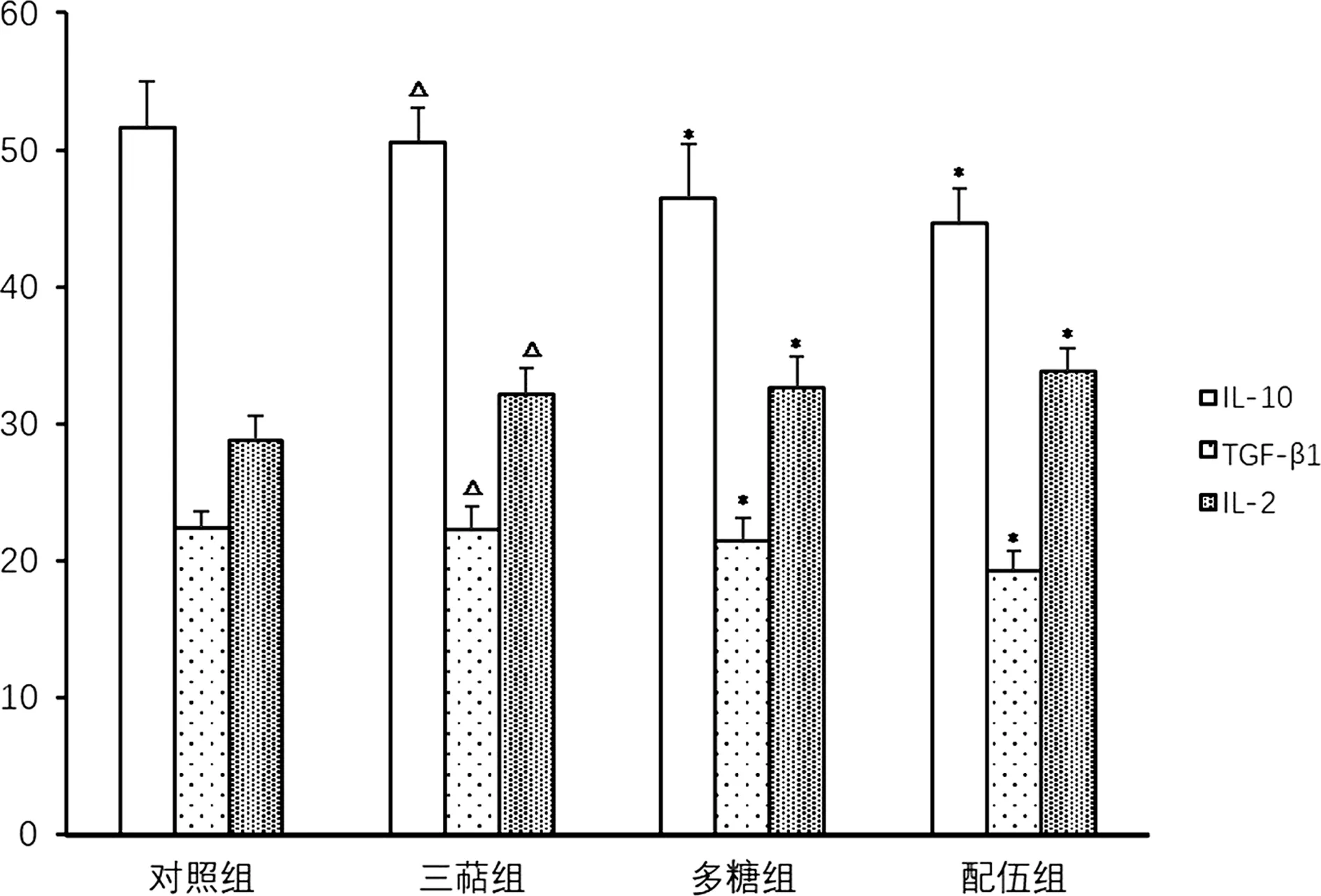
圖6 小鼠腫瘤組織中細胞因子含量
3.6 腫瘤微環境中FOXP3蛋白表達水平
各組腫瘤組織中FOXP3陰性細胞呈藍色,底物呈白色,陽性細胞呈黃色或棕黃色,FOXP3陽性產物主要分布在細胞核、細胞質及細胞間質.與對照組相比,各給藥組FOXP3均呈現較弱的表達水平(圖7).
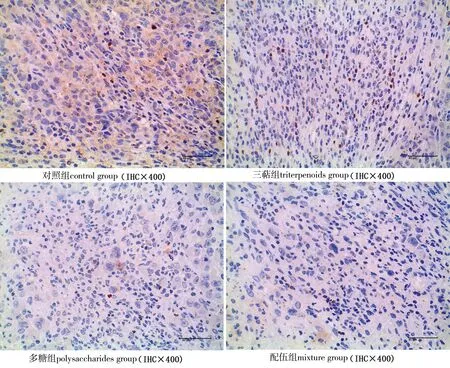
圖7 小鼠腫瘤微環境中FOXP3蛋白表達Fig.7 Expression of FOXP3 protein in mouse tumor microenvironment
平均光密度統計結果(表 3)顯示,與對照組相比,各給藥組小鼠腫瘤組織FOXP3蛋白含量均有降低,其中三萜組和配伍組差異具有統計學意義(P<0.05,P<0.01);配伍組小鼠腫瘤組織FOXP3蛋白含量明顯低于三萜組和多糖組,其中多糖組與配伍組差異具有統計學意義(P<0.05).結果表明,靈芝三萜和多糖均能降低小鼠腫瘤組織中FOXP3蛋白的表達,二者配伍給藥具有協同效果.
表3 小鼠腫瘤組織FoxP3平均光密度統計結果
靈芝多糖類制劑近年來常被用于臨床腫瘤患者放化療的輔助治療,在提高患者對放化療的耐受性、增強免疫、減輕副反應等方面的效果都已被臨床初步證實[10-11],而靈芝三萜類成分目前尚無臨床應用報道.靈芝多糖、三萜配伍使用能顯著提高抑瘤效果,目前已在動物實驗得到證實[12],在獲得靈芝多糖、三萜抗腫瘤最佳配伍劑量的基礎上,開展二者配伍使用的內在機制研究,可為靈芝輔助治療腫瘤提供理論依據與指導.
腫瘤微環境(TME)是支持腫瘤產生、生長和轉移的復雜腫瘤生態系統,包含腫瘤細胞、成纖維細胞、免疫細胞、細胞間質、微血管以及浸潤其中的生物分子[13].近年在TME中發現了新的靶點,可以幫助指導和改善各種癌癥治療的作用,特別是通過增強宿主抗腫瘤免疫反應而起作用的免疫療法[14],是近年免疫治療研究熱點.Treg細胞是腫瘤微環境中一類免疫負調控細胞,主要是CD4+CD25+FOXP3+細胞,原本在胸腺、骨髓、淋巴結以及外周血中自然產生,經趨化因子CCL22與其受體CCR4的結合,將其趨化至腫瘤微環境中[15].Treg細胞能夠直接接觸抑制靶細胞活性,通過分泌IL-10及TGF-β等細胞因子抑制Th細胞的增殖分化及其分泌細胞因子,抑制效應細胞的免疫應答,是腫瘤免疫逃逸的關鍵因素[16].
Sun等[17]的體外實驗研究發現,靈芝孢子多糖可使B16F10黑素瘤細胞培養液中的IL-10及TGF-β生成顯著減少,有效抑制Treg細胞活性.Li等[18]研究表明,靈芝多糖能顯著抑制肝癌小鼠腫瘤生長,抑制腫瘤微環境中FOXP3的表達,減少Treg細胞向腫瘤組織中募集,消除Treg 細胞的免疫抑制,使腫瘤微環境中免疫平衡偏向效應性T細胞.本研究發現靈芝子實體多糖同樣能減少IL-10、TGF-β生成及FOXP3的表達,Treg細胞向腫瘤組織中募集,三萜本身無此作用,但通過三萜、多糖配伍使用后作用效果增強,因此,三萜能協同增強多糖對腫瘤微環境中Treg細胞功能抑制效應.
靈芝三萜能快速增強機體抗腫瘤免疫活性,促進肺癌小鼠機體產生白介素-2(IL-2),并提高自然殺傷(NK)細胞的免疫活性[19].Treg細胞主要表面抗原CD25,是白介素2受體α鏈(IL-2Rα),能競爭性與IL-2結合,使腫瘤微環境中效應T細胞因為缺乏IL-2受到抑制[20].本研究發現靈芝三萜及配伍均提高了腫瘤微環境中IL-2水平,三萜可能通過增加IL-2的分泌或解除Treg細胞引起的IL-2競爭,對多糖抑制Treg細胞功效起到協同作用.
綜上所述,本研究從腫瘤微環境中Treg細胞數量、特異蛋白表達、趨化因子mRNA水平及細胞因子水平等方面分別考察靈芝多糖、三萜對Treg細胞功能的影響研究,確認了靈芝三萜、多糖對腫瘤微環境中Treg細胞功能的抑制作用,有利于促進機體抗腫瘤免疫.

