鋰電解過程中雜質元素的電化學行為
王世棟,葉秀深,李 權,火 焱,李明珍,張慧芳,龐全世,吳志堅
(1.中國科學院青海鹽湖研究所,中國科學院鹽湖資源綜合高效利用重點實驗室,青海西寧810008;2.青海省鹽湖資源化學重點實驗室;3.青海金昆侖鋰業有限公司)
鋰是世界上最輕的金屬,電位最負(-3.043 V),其理論比容量高達3 860 mA·h/g, 因此由鋰作為電子受體或供體設計的電池的比能量最高, 被認為是最理想的負極材料。 由于鋰優異的儲能性能,被稱為“二十一世紀的能源金屬”,戰略地位顯著[1-2]。 國內外金屬鋰的生產方法有熔鹽電解法和金屬熱還
原法, 目前工業上普遍采用氯化鋰-氯化鉀熔鹽電解法。在熔鹽電解法制備金屬鋰過程中,影響金屬鋰產品質量的雜質主要為Mg、Ca、Na、Fe 等,因MgCl2、CaCl2、NaCl、FeCl3的 分 解 電 位 小 于LiCl 的 分 解 電位,電解過程中原料中的Mg、Ca、Na、Fe 將全部進入產品。 研究金屬鋰及雜質元素從熔鹽體系中析出的電化學行為, 明晰其在陰極析出的電位范圍及控制步驟,得出熔鹽電解過程中的反應機理,對熔鹽電解制備金屬鋰優化工藝條件、 提高電流效率和降低生產能耗具有重要的理論和現實意義[3-4]。 本文通過電化學方法研究了雜質在50%LiCl-50%KCl 熔鹽體系中的還原過程,討論了雜質對電解過程的影響。
1 實驗部分
實驗所用原料均為分析純化學試劑。 電解質體系按50%LiCl-50%KCl 進行配比(其中50%LiCl-50%KCl 在500 ℃下的密度經RT-4 熔體測試儀測定為1.55 g/cm3),稱量50 g KCl、50 g LiCl 及少量雜質放入Φ60 mm×60 mm 的剛玉坩堝中, 將坩堝放入電阻爐中加熱至500 ℃熔化, 并在此溫度下保溫進行實驗。 以Φ6 mm 的光譜純石墨棒為對電極,Φ1 mm 的鉬絲為工作電極和準參比電極,工作電極面積為0.165 cm2,所有電位均以鉬電極為參比,采用AUTOLAB PGSTAT128N 電化學工作站進行測量。測試前,每個電極用SiC 紙進行徹底拋光,用乙醇進行超聲波清洗,然后擦干。
2 實驗結果分析
2.1 電解過程中MgCl2 的電化學行為
圖1a 為500 ℃時LiCl-KCl 熔鹽體系中加入MgCl2前后的循環伏安曲線,掃描速度為0.1 V/s。 曲線1 為空白體系的循環伏安曲線,陰極信號B 是金屬鋰的沉積,在反向掃描方向,陽極峰B′對應于鋰的溶解, 鋰離子開始發生還原反應析出金屬鋰的電位為-2.299 V,在金屬鋰析出之前,沒有其他還原電流出現。 曲線2 為添加1%MgCl2后的循環伏安曲線,在-1.748 V 檢測到還原信號峰A 對應于Mg2+的還原; 在-2.148 V 出現的峰值C 對應于鋰在鎂上(鎂預先沉積在鉬電極上)欠電位沉積形成鎂鋰合金;隨后出現的峰B/B′為鋰的沉積和溶解。在陽極掃描方向,峰C′和A′分別為鎂鋰合金中鋰和鎂的陽極氧化峰。 這表明在電解質體系中若存在少量的無水氯化鎂,在電解過程中首先析出金屬鎂,然后是金屬鋰的欠電位沉積形成鎂鋰合金, 最后才是金屬鋰的析出, 鋰離子開始發生還原反應析出金屬鋰的電位為-2.239 V。
圖1b 為500 ℃含1%MgCl2的LiCl-KCl 熔鹽在鉬電極上不同掃描速度下的循環伏安曲線。 其氧化還原峰電流IA′/IA大于1, 表面產物Mg 部分可溶[5]。圖1c 為500 ℃含1%MgCl2的LiCl-KCl 熔鹽中陰極峰電流隨掃描速度平方根的變化關系。由圖1c 可以看到,陰極峰值電流Ip與掃描速度的平方根呈線性關系,表明Mg2+的還原電極過程受擴散控制,這與文獻的研究結果一致[5-8]。 根據直線的斜率可以用Berzins-Delahay 方程計算擴散系數[6]:

式(1)中,n 為 電 子 轉 移 數;F 為 法 拉 第 常 數,96 485 C/mol;R 為氣體常數,8.314 J/(mol·K);T 為絕對溫度,K;S 為電極面積,cm2;C0為電活性物質的濃度,mol/cm3;D 為擴散系數,cm2/s;v 為電位掃描速度,V/s。 經計算Mg2+的擴散系數為1.44×10-5cm2/s,與文獻報道值為同一個數量級, 差異主要與準確確定活性電極區域的難度有關[5-8]。
2.2 電解過程中CaCl2 的電化學行為
圖2 為500 ℃時LiCl-KCl 熔鹽體系中加入CaCl2前后的循環伏安曲線,掃描速度為0.1 V/s。曲線1 為空白體系的循環伏安曲線,陰極信號B 和陽極信號B′對應于金屬鋰的沉積和溶解。 曲線2 為添加1%CaCl2后的循環伏安曲線,其與曲線1 一樣,只有一組B/B′信號峰。由于Ca 與Li 的析出電位非常接近,陰極信號B 應是液態Ca-Li 合金的沉積, 鈣和鋰的共沉積電位為-2.266 V 略大于鋰金屬的沉積電位-2.299 V[9]。
當兩種金屬離子的沉積電位相等時, 電解時發生共沉積,如下式:

式中,E1和E2為電解時離子1 和離子2 在陰極上的沉積電位,V。

式中,Er為相應離子的平衡電位,V;η為離子的超電勢,V。
在可逆或準可逆情況下, 離子的平衡電位符合Nernst 方程:

式(5)為離子的沉積電位E(V)與析出電位E0(V)、活度α(mol/cm3)以及析出時在陰極材料上超電勢η(V)的關系。
單純考慮熱力學方程(Nernst 方程),即只考慮濃度的變化是否能實現鈣鋰合金的共電沉積。 500 ℃時,Ca2+和Li+的標準電極電位為:E0Ca=-3.534 V,E0Li=-3.646 V。
設定η1=η2且遠遠小于1,不予考慮,同時假定離子的活度系數γCa2+=γLi+,令ECa=ELi,即:

經計算, 電解質體系中CLi=0.018 3 mol/cm3,則CCa=1.14×10-5mol/cm3,CaCl2在電解質體系中的質量分數為0.08%, 說明電解質體系中有微量的Ca2+即發生鈣鋰共沉積。
2.3 電解過程中NaCl 的電化學行為
圖3a 為500 ℃時LiCl-KCl 熔鹽體系中加入NaCl 前后的循環伏安曲線,掃描速度為0.1 V/s。 曲線1 為空白體系的循環伏安曲線,曲線2 為添加1%NaCl 后的循環伏安曲線,曲線3 為添加15%NaCl后的循環伏安曲線。 實驗結果表明,曲線2 和曲線3與曲線1 一樣,只有一組B/B′信號峰。由于Na 與Li的析出電位也非常接近, 本文對電解過程中是否共電沉積析出鈉鋰合金進行了分析。
500 ℃時,Na+和Li+的標準電極電位為:E0Na=-3.519 V,E0Li=-3.646 V。 設定η1=η2且遠遠小于1,不予考慮,同時假定離子的活度系數γNa+=γLi+,令ENa=ELi,即:

經計算,電解質體系中CLi=0.018 3 mol/cm3,則CNa=2.71×10-3mol/cm3,NaCl 在電解質體系中的質量分數為10.22%,說明電解質體系中的NaCl 質量分數達到10.22%才發生鈉鋰共沉積。由于Na 與Li 的析出電位非常接近,見圖3a,含15%NaCl 的LiCl-KCl 熔鹽循環伏安曲線只發現鈉鋰合金的析出峰。
圖3b 為金屬鋰中鈉含量隨NaCl 添加量的變化關系圖,可以看出,隨著電解質體系中NaCl 含量的增加,金屬鋰中的鈉含量有較大的增加,幾乎呈線性變化。 這是由于金屬鋰非常活潑,有強的還原性,假定金屬鋰中的鈉是由金屬鋰還原而來的, 如式(10)所示:
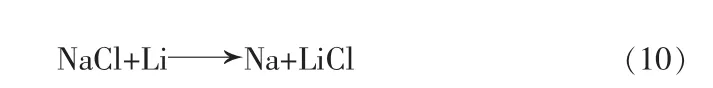

圖3 LiCl-KCl 熔鹽體系中加入NaCl 前后的循環伏安曲線(a)和金屬鋰中鈉含量隨NaCl 添加量的變化(b)Fig.3 Cyclic voltammetry curves performed in LiCl-KCl melt before/after adding NaCl(a)and relationship between Na content in Li metal with addition of NaCl(b)
根據表1 反應過程中各物質的熱力學數據可以求得反應的吉布斯自由能:

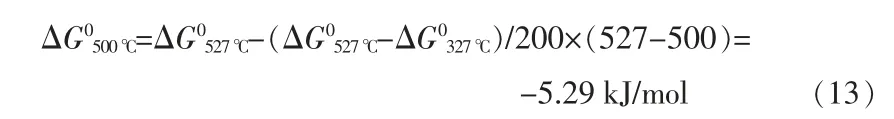
經計算,在500 ℃下,反應的ΔG0500℃<0,反應可以自發進行,所以熔鹽體系中微量的NaCl 可以被金屬鋰還原成金屬鈉。

表1 Na,Li 及其氯化物的熱力學數據[10]Table 1 Thermodynamic data of Na,Li and their chlorides
2.4 電解過程中FeCl3 的電化學行為
圖4a 為500 ℃時LiCl-KCl 熔鹽體系中加入FeCl3前后的循環伏安曲線,掃描速度為0.1 V/s。 曲線1 為空白體系的循環伏安曲線,陰極信號B 和陽極信號B′對應于金屬鋰的沉積和溶解。 曲線2 為添加1%FeCl3后的循環伏安曲線,在-0.75 V 檢測到還原信號峰A 對應于Fe3+的還原, 隨后出現的峰B/B′為Li 的沉積和溶解。 在陽極掃描方向,峰A′為還原Fe 的溶解峰[11-12],C′峰值是由于氯氣的形成導致了附近熔體中離子濃度的變化, 增加了周圍離子的還原速率,增大了電流[13-15]。 加入1%FeCl3后,熔鹽體系Li 的析出電流急劇降低,這是由于Fe3+在陰極被還原成海綿鐵使陰極鈍化引起的[11-12]。
圖4b 為500 ℃含1%FeCl3的LiCl-KCl 熔鹽在鉬電極上不同掃描速度下的循環伏安曲線。圖4c 為500 ℃含1%FeCl3的LiCl-KCl 熔鹽中陰極峰電流隨掃描速度平方根的變化關系。 由圖4c 可以看到,陰極峰值電流Ip與掃描速度的平方根呈線性關系,表明Fe3+的還原電極過程受擴散控制,這與文獻的研究結果一致。 根據直線的斜率可以用式(1)的Berzins-Delahay 方程計算擴散系數,經計算Fe3+的擴散系數為3.14×10-5cm2/s,與文獻報道值接近[11-14]。
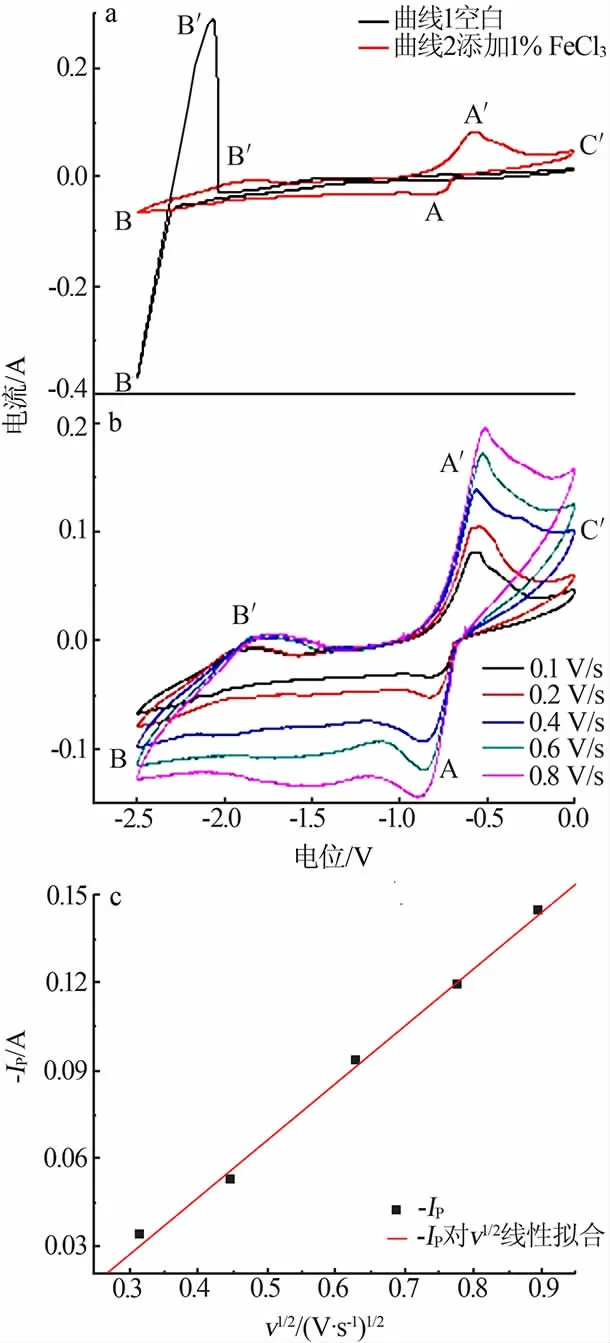
圖4 LiCl-KCl 熔鹽體系中加入FeCl3 前后的循環伏安曲線(a)、不同掃描速度下的循環伏安曲線(b)以及陰極峰電流隨掃描速度平方根的變化關系(c)Fig.4 Cyclic voltammetry curves performed in LiCl-KCl melt before/after adding FeCl3(a),cyclic voltammetry curves at different scanning rates(b)and relationship between peak cathode current and square root of scanning rate(c)
3 結論
通 過 對 鋰 電 解 過 程 中 雜 質MgCl2、CaCl2、NaCl、FeCl3在LiCl-KCl 熔體中的電化學行為的研究,主要獲得以下結論。
1)雜質元素Mg 將優先于Li 在陰極析出,并與金屬鋰合金化形成合金。 其中Mg2+的還原電極過程受擴散控制,擴散系數為1.44×10-5cm2/s。 2)電解質體系中有微量的Ca2+即發生鈣鋰共沉積,由于Ca 與Li 的析出電位非常接近,循環伏安曲線只發現鈣鋰合金的析出峰。 3)在含少量NaCl 的熔鹽體系中,雜質元素Na 被Li 還原并形成合金, 隨著電解質體系中NaCl 含量的增加,金屬鋰中的鈉含量有較大的增加,幾乎呈線性變化。 只有當電解質體系中的NaCl質量分數達到10.22%才發生鈉鋰共沉積, 由于Na與Li 的析出電位非常接近,循環伏安曲線只發現鈉鋰合金的析出峰。 4)雜質元素Fe 優先于Li 在陰極析出,由于Fe3+在陰極被還原成海綿鐵使陰極鈍化,引起熔鹽體系Li 的析出電流急劇降低。 Fe3+的還原電極過程受擴散控制,擴散系數為3.14×10-5cm2/s。5)雜質元素Mg、Ca、Na、Fe 對鋰電解的電化學過程都有影響,在電解過程中均會進入金屬鋰產品,影響產品質量, 尤其是Fe 會引起電解過程電流的下降,導致電解無法進行。

