不同濃度氧化石墨烯對人牙周膜干細胞增殖及成骨分化的影響
張元杰,吳佩玲,王倩云,買熱葉木姑·艾沙,阮曉慧
(新疆醫科大學第二附屬醫院口腔科,烏魯木齊 830063;*通訊作者,E-mail:295923650@qq.com)
牙周病是口腔中常見的炎癥性疾病之一,導致牙槽骨吸收,最終使牙齒脫落,所以在牙周病的治療中,恢復缺損的牙槽骨依舊是研究的熱點內容之一。近年來,隨著對新型支架材料和干細胞的研究,為牙周組織再生提供了新的思路。GO因其優異的理化性質,成為組織工程領域研究與應用的熱點。其作為石墨烯的衍生物之一,具有良好的生物相容性和親水性[1],高的機械強度,大的接觸面積等特性[2],在組織工程領域展現出應用潛力。國內外學者研究發現,GO超過一定濃度對細胞產生毒性作用[3-6],但對低濃度GO是否能夠促進間充質干細胞增殖與成骨分化得出的結論不同[7]。
hPDLSCs作為牙源性干細胞的一種,具有多向分化潛能,本課題組[8,9]前期研究發現,hPDLSCs表現出了明顯的增殖和成骨分化能力,是牙周組織再生的理想的種子細胞。本研究擬通過體外實驗,將hPDLSCs與不同濃度GO共培養,探討GO對hPDLSCs的增殖及成骨分化能力的作用。
1 材料和方法
1.1 主要試劑和儀器
氧化石墨烯分散液(江蘇先鋒納米);澳洲胎牛血清(Gibco,美國);維生素C;β-甘油磷酸鈉;地塞米松;茜素紅染色液(索萊寶生物,北京);細胞計數試劑盒(博士德生物,武漢);逆轉錄試劑盒(Thermo,美國);實時熒光定量聚合酶鏈反應試劑盒(QIAGEN,德國)。
實時熒光定量PCR儀(Life-Tech,美國);酶標儀(Thermo,美國);熒光倒置顯微鏡(Leica,德國);超凈工作臺(蘇州凈化);恒溫水浴箱(上海一恒科技);正置顯微鏡;倒置顯微鏡(Leica,德國);低溫高速離心機(Eppendorf,德國)。
1.2 氧化石墨烯(graphene oxide,GO)完全培養基的制備
配制0,0.1,0.5,2.5,12.5,62.5 μg/ml GO完全培養基(含10%FBS的α-MEM培養基)和0,0.1,0.5,2.5 μg/ml GO成骨誘導液(10% FBS、10 mmol/L β-甘油酸鈉、50 mg/L維生素C及10 nmol/L地塞米松的α-MEM培養基)。
1.3 hPDLSCs復蘇、培養及傳代
hPDLSCs由課題組前期構建,復蘇第2代凍存hPDLSC,放入培養條件為37 ℃、體積分數5%CO2、飽和濕度的恒溫箱進行培養,待細胞匯合度為80%-90%時,用2.5 g/L胰蛋白酶消化及傳代,采用第3-4代細胞進行實驗。
1.4 倒置顯微鏡觀察hPDLSCs的細胞形態
將hPDLSCs用2.5 g/L胰蛋白酶常規消化為細胞懸液,進行細胞計數,將細胞密度調整為1×103/孔,接種于6孔板中,24 h細胞貼壁后分別加入不同GO濃度完全培養基對細胞培養,于恒溫箱培養72 h,倒置顯微鏡下觀察細胞形態。
1.5 細胞計數試劑盒法(CCK-8)檢測hPDLSCs增殖
將對數生長期的hPDLSCs常規消化為細胞懸液,以1×103/孔的密度接種于4塊96孔培養板中,置于恒溫箱中培養24 h。待細胞貼壁后,棄去原培養基,換為不同GO濃度完全培養基對細胞培養,每組設置3個復孔。分別在1,3,5,7 d隨機取出一塊96孔板終止培養,用磷酸鹽緩沖液清洗3次,加入10 μl CCK-8液,置于恒溫箱中孵育2 h,在推薦波長490 nm下測定吸光度(OD),另設波長630 nm為參考波長。
1.6 hPDLSCs成骨分化能力的測定
1.6.1 茜素紅染色法檢測hPDLSCs礦化情況 將對數生長期的hPDLSCs常規消化為細胞懸液,以1×105個/孔的濃度接種于6孔板,在恒溫箱進行培養。待細胞匯合度達到50%-60%棄去原培養基,換為含0,0.1,0.5,2.5 μg/ml GO的成骨誘導液對細胞培養,每3 d換液1次,培養到第14天時行茜素紅染色,于倒置顯微鏡下觀察各組礦化結節的形成情況。
1.6.2 實時熒光定量PCR檢測成骨標志基因的表達 將對數生長期的hPDLSCs常規消化制成細胞懸液,以2×105個/孔的濃度接種于6孔板,換為含0,0.1,0.5,2.5 μg/ml GO成骨誘導液對細胞培養。14 d后終止培養,Trizol裂解、提取細胞總RNA并測定濃度與純度,將所提取的RNA逆轉錄為cDNA,采用熒光定量試劑盒對成骨標志基因進行定量,分別檢測堿性磷酸酶(alkaline phosphatase,ALP)、骨鈣蛋白(ostecalcin,OCN)、Runt相關轉錄因子2(Runt-related transcription factor 2,Runx2)的表達,求各組2-ΔΔCt值,并進行統計學分析。

表1 實時熒光定量PCR目的基因引物序列
1.7 統計學方法
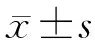
2 結果
2.1 GO對hPDLSCs形態的影響
加入不同濃度的GO完全培養基培養72 h后,采用PBS清洗3次。鏡下觀察,除0 μg/ml組外,各濃度組均有GO顆粒的沉積,12.5,62.5 μg/ml GO培養基中GO顆粒較多,并與細胞緊緊黏附至皿底。0.1,0.5,2.5,12.5 μg/ml GO完全培養基中細胞形態立體飽滿,呈長梭形,輪廓清晰,與0 μg/ml組無明顯差異。62.5 μg/ml GO完全培養基中細胞折光度降低,立體感消失,呈現扁平并發生皺縮(見圖1)。
A.0 μg/ml GO組;B.0.1 μg/ml GO組;C.0.5 μg/ml GO組;D.2.5 μg/ml GO組;E.12.5 μg/ml GO組;F.62.5 μg/ml GO組圖1 不同濃度GO培養的hPDLSCs形態學觀察 (×50)Figure 1 Morphological observation of hPDLSCs cultured with different concentrations of GO (×50)
2.2 GO對hPDLSCs增殖影響
加入不同濃度的GO完全培養基培養,分別在1,3,5,7 d隨機取出一塊96孔板進行CCK-8檢測。結果顯示:第1,3,5,7天,0.1,0.5,2.5,12.5 μg/ml GO對hPDLSCs增殖無影響,與0 μg/ml相比,差異無統計學意義(P>0.05)。第1,3天,62.5 μg/ml GO對hPDLSCs增殖無影響(P>0.05),但從第5天起,62.5 μg/ml GO抑制hPDLSCs增殖,差異具有統計學意義(P<0.001,見圖2,表2)。
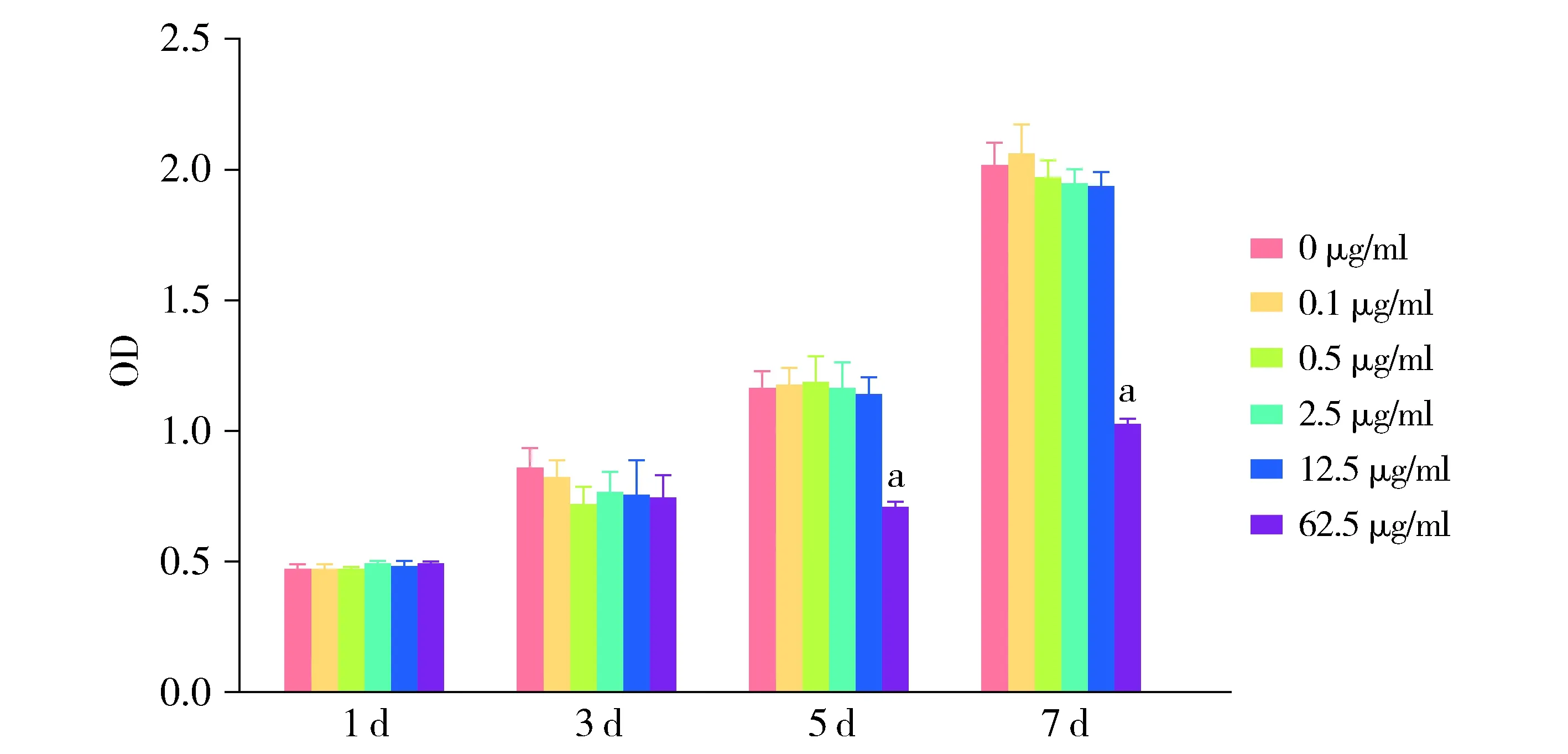
與0 μg/ml比較,aP<0.001圖2 GO對hPDLSCs增殖影響Figure 2 The effect of GO on the proliferation of hPDLSCs
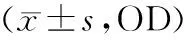
表2 CCK-8測定GO培養不同時間對hPDLSCs增殖影響
2.3 GO對hPDLSCs成骨能力的影響
2.3.1 茜素紅染色結果 不同濃度GO成骨誘導液對hPDLSCs進行成骨誘導14 d,進行茜素紅染色。結果顯示,0 μg/ml GO組礦化結節數量多、染色深、且形成的范圍較廣泛,隨著GO濃度的增大,礦化結節數量逐漸減少且范圍較小(見圖3)。
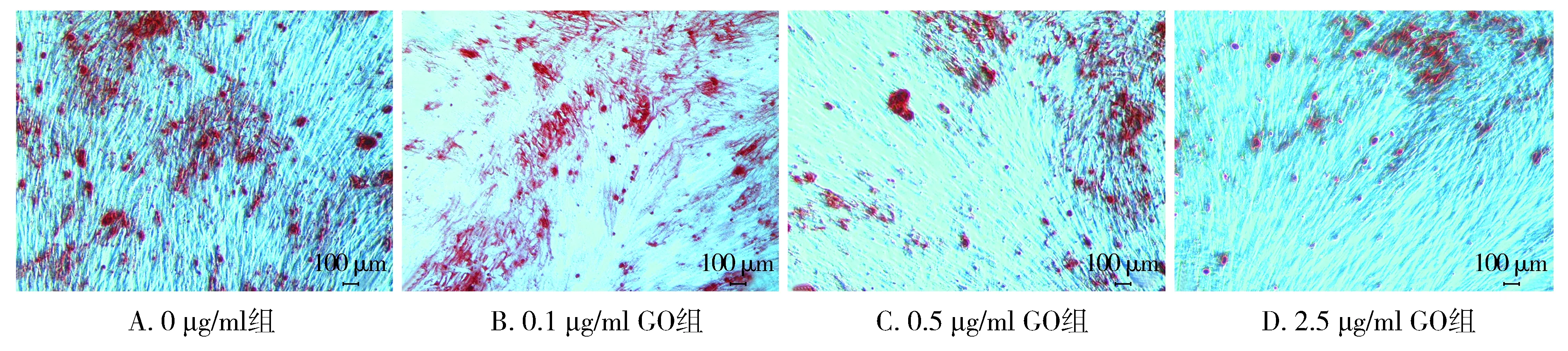
圖3 不同濃度GO培養hPDLSC茜素紅染色 (×50)Figure 3 Alizarin red staining of hPDLSC cultured with different concentrations of GO (×50)
2.3.2 成骨標志基因表達結果 對hPDLSCs成骨誘導14 d,實時熒光定量PCR檢測成骨基因ALP、Runx2、OCN的表達。結果顯示,與0 μg/ml相比,ALP表達量隨著GO濃度的增高逐漸降低,差異具有統計學意義(P<0.001)。在0.1,0.5 μg/ml GO成骨誘導液中的Runx2表達量下降(P<0.05),隨著GO濃度增高至2.5 μg/ml,Runx2表達量顯著下降(P<0.001)。OCN表達量在0.1,0.5 μg/ml GO成骨誘導液中與0 μg/ml相比無差異(P>0.05),在2.5 μg/ml GO成骨誘導液中明顯下降(P<0.001,見圖4)。

與0 μg/ml比較,*P<0.05,***P<0.001圖4 GO對hPDLSCs成骨基因表達的影響Figure 4 The effect of GO on the expression of hPDLSCs osteogenic genes
3 討論
石墨烯及其衍生物中,GO是生物醫學應用中有潛力的材料之一[10]。與其他材料相比,GO具有較大的表面積,易于被不同的官能團修飾[11],在生物醫學領域有很大潛能,但GO表現出的毒性和生物安全性依舊需要引起重視[12,13]。
本實驗從細胞形態、細胞增殖及細胞成骨分化方面探討不同濃度GO對hPDLSCs的影響。倒置顯微鏡觀察表明,0.1,0.5,2.5,12.5 μg/ml GO完全培養基中細胞形態飽滿,呈長梭形,輪廓清晰,與對照(0 μg/ml)無明顯差異;而62.5 μg/ml GO完全培養基中GO顆粒與細胞緊密黏附于皿底,細胞呈現扁平并發生皺縮,折光度降低,立體感消失。國內學者研究發現高濃度GO對大鼠骨髓間充質干細胞形態同樣有顯著影響,可使細胞伸展性下降,折光率降低。這些細胞形態的變化與氧化石墨烯的濃度呈正相關[14]。Olteanu等[3]通過激光共聚焦顯微鏡觀察也發現40 μg/ml GO導致人牙囊干細胞骨架收縮,微管結構受損。由此可見,高濃度GO對細胞形態有顯著影響。
細胞增殖實驗表明,培養第1,3,5,7天,0.1,0.5,2.5,12.5 μg/ml GO對hPDLSCs增殖無影響(P>0.05),在第5,7天,62.5 μg/ml GO完全培養基抑制hPDLSCs增殖,差異具有統計學意義(P<0.001)。國外學者研究發現,GO對人成纖維細胞毒性表現為濃度依賴性,GO濃度小于20 μg/ml對細胞無影響,高于50 μg/ml表現出明顯的細胞毒性,并且可以進入細胞質和細胞核,降低細胞黏附[15]。Wu等[16]將人角膜上皮細胞培養12.5-100 μg/ml GO培養基中,隨著時間跟濃度的增加,細胞活力降低,與本實驗的研究結果相一致。
本實驗通過茜素紅染色與檢測成骨基因表達情況研究不同濃度GO對hPDLSCs成骨分化能力的影響。對hPDLSCs成骨誘導14 d后,茜素紅染色顯示,不同濃度GO成骨誘導液培養后,各濃度組均有礦化結節生成,0 μg/ml GO組礦化結節數量多、染色較深,且形成的范圍較廣泛,隨著GO濃度的增大,礦化結節數量逐漸減少且范圍較小。實時熒光定量PCR檢測結果顯示,與0 μg/ml GO組相比,隨著GO濃度的增高,ALP、Runx2表達量逐漸降低,差異具有統計學意義(P<0.05或P<0.001),OCN在2.5 μg/ml GO成骨誘導液組表達有顯著差異(P<0.001)。
關于GO對細胞增殖及成骨的影響,較為一致的觀點是高濃度GO存在細胞毒性[17]。但較低濃度GO對細胞增殖及成骨的影響,國內外學者得出不同的結論。王潔等[13]發現低濃度GO對大鼠骨髓間充質干細胞的增殖無促進作用。魏常博等[7]發現GO濃度為0.1,0.5 μg/m以促進人乳牙牙髓干細胞的黏附和增殖能力,并且可以促進成骨相關蛋白表達,這與我們的研究結果相反。其原因可能與GO有關。研究表明,在制備GO過程中,不同氧化時間和溫度、不同類型和濃度的氧化劑會極大地影響其結構性能,進而導致氧化水平不同、雜質含量不同的GO作用于同一細胞系后會產生不同結果[18]。同時,本實驗在細胞增殖與成骨誘導過程中,所設定的濃度梯度不適宜hPDLSCs的增殖及成骨分化,同時培養時間過長可能引起hPDLSCs成骨分化能力減弱。也可能是由于GO與細胞在培養皿中黏附,培養過程中多次換液造成GO富集,導致濃度改變。其具體抑制原因尚不清楚,還需要進一步實驗明確。
本研究將hPDLSCs與不同濃度GO培養基共培養,結果表明隨著GO濃度增高和培養時間增加,hPDLSCs的增殖及成骨能力受到抑制,表現出劑量和時間依賴性。在未來的研究中,如何使其更有利于干細胞的增殖與分化,更好地引導牙周組織再生,仍需要進一步探究。

