基于廣泛靶向代謝組學的不同顏色棉花花瓣中類黃酮成分差異分析
李秋琳,李燕,陳偉,姚金波,朱守鴻,袁黎,張永山
(中國農業科學院棉花研究所/ 棉花生物學國家重點實驗室,河南 安陽 455000)
植物花瓣是花冠的一個重要組成部分,植物花瓣顏色不僅是植物重要的觀賞性狀之一,而且具有吸引昆蟲授粉繁衍后代的功能[1]。 在遺傳因素、光照、溫度、液泡的pH、植物激素、色素、金屬離子含量、植物細胞內環境和花瓣的內部或表層結構(表皮細胞、斑紋)等的影響下,花瓣呈現出各種顏色[2-3]。 植物花瓣顏色的形成受多種代謝產物影響,其中主要有類黃酮、類胡蘿卜素、花青素和生物堿等色素[4-5]。
類黃酮屬于植物次級代謝產物,是一種多酚物質[6]。根據邁維代謝數據庫的分類標準,類黃酮類化合物可以分為10 類:黃酮、二氫黃酮、二氫黃酮醇、黃烷醇類、查耳酮、異黃酮、黃酮醇、花青素(不含糖基的花色苷)、黃酮碳糖苷、二氫異黃酮[7]。其中,查耳酮和橙酮主要控制深黃色花色的形成,黃酮、黃烷醇和黃烷酮類主要控制淡黃色或接近白色的花色形成,花色苷在紅、粉紅、藍、紫和紫紅色等花瓣顏色的形成中起主要作用[8-9]。在植物生長發育過程中, 類黃酮化合物除了與花、葉、莖、果實和種子的顏色形成相關,還有以下功能:(1)減少紫外線對植物的傷害,如山奈素能吸收紫外線,減少輻射對植物的傷害[10];(2)作為植物與微生物間的信號分子,如毛地黃黃酮和芹菜苷配基參與豆科植物與根瘤菌發生固氮作用時的信號傳導[11-12];(3)參與調節植物生長素的響應[13];(4)具有類似外激素的功能,吸引昆蟲授粉[14]。此外,類黃酮化合物在醫療保健領域也有廣泛的應用價值,據報道多酚類物質能夠調節動物體內的氧化應激反應、緩解炎癥,黃酮能清除細胞中超氧陰離子自由基、羥基自由基和脂質過氧自由基[15-17]。
棉花是紡織原料——纖維的重要來源。 棉花種類多種多樣,花瓣顏色也各有差異,有深紅色、紅色、水紅色、粉色、淺粉色、黃色、粉黃色、橙色、各種中間色以及不同顏色的鑲嵌型[18-19]。棉花花瓣顏色既是典型的形態標記,又是重要的遺傳分類指標[20]。棉花花瓣內的類黃酮物質具有藥用價值[21]。因此,本研究以海7124(H7124,花瓣黃色,屬海島棉,Gossypium barbadenseL.),TM-1(花瓣乳白色,屬陸地棉,G. hirsutumL.)和石系亞1 號(花瓣白色,屬亞洲棉,G.arboreumL.)3 個材料的花瓣為研究對象,首先測定這3 個材料花瓣中的類黃酮類次級代謝產物,然后利用超高效液相色譜-串聯質譜技術Ultra performance liquid chromatography-tandem mass spectrometry, UPLC-MS/MS對類黃酮進行組分鑒定及定量分析,再結合多元統計分析這3 個棉花材料花瓣中類黃酮類代謝物含量變化情況及其參與的代謝途徑,為揭示棉花花瓣中類黃酮物質組成及顏色差異,了解棉花花瓣顏色變化機制及其代謝途徑奠定理論基礎。
1 材料與方法
1.1 樣品采集及提取
樣品采集:在開花當天,分別摘取海7124 黃色花、TM-1 乳白色花和石系亞1 號白色花約20朵,放冰盒遮光保存立即帶回室內,將去除花基斑部分的花瓣(同時避免沾染花粉)保存于20 mL離心管再放置于液氮中冷凍(每份樣品約5 g,分別取3 個生物學重復), 最后置于-80 ℃超低溫冰箱保存備用。
類黃酮提取:(1) 將3 組樣品放置于凍干機(Scientz-100F)中真空冷凍干燥;(2)利用研磨儀(MM 400,Retsch)研磨(30 Hz,1.5 min)至粉末狀;(3)稱取100 mg 的粉末,溶解于1.2 mL 70%(體積分數)甲醇提取液中;(4)每30 min 將樣品混合液渦旋一次,持續30 s,重復渦旋6 次,然后將樣品混合液置于4 ℃冰箱過夜;(5)將樣品離心(轉速12 000 r·min-1,10 min)后,吸取上清液,用微孔濾膜(孔徑0.22 μm)過濾上清液,并保存于進樣瓶中,用于LC-MS/MS[22]分析。
1.2 樣品測定
類黃酮類代謝物檢測的液相條件主要包括:(1) 色譜柱:Agilent SB-C18 1.8 μm,2.1 mm×100 mm。(2)流動相:A 相為超純水(加入0.1%的甲酸),B 相為乙腈(加入0.1%的甲酸)。 (3)洗脫梯度:0.00 min B 相比例為5%;9.00 min 內B 相比例線性增加到95%, 并在95%維持1 min;10.00-11.10 min,B 相比例降為5%,并以5%平衡至14.00 min;(4)流速0.35 mL·min-1;柱溫40 ℃;進樣量4 μL。
類黃酮類代謝物檢測是在三重四極桿線性離子阱質譜儀(Q TRAP),AB4500 Q TRAP UPLCMS/MS 系統上獲得的,該系統配備了ESI Turbo離子噴霧接口,可由Analyst 1.6.3 軟件(AB Sciex)控制運行正負兩種離子模式。 電噴霧離子源(Electrospray ionization,ESI) 操作參數如下:離子源,渦輪噴霧;源溫度550 ℃;離子噴霧電壓(IS)5 500 V(正離子模式)/-4 500 V(負離子模式);離子源氣體I(GSI),氣體II(GSII)和簾氣(Curtain gas,CUR)分別設置為50、60 和25 psi,碰撞誘導電離參數設置為高。在三重四級桿(Triple quadrupole,QQQ)和線性離子阱(Linear ion trap,LIT) 模式下分別用10 μmol·L-1和100 μmol·L-1聚丙二醇溶液進行儀器調諧和質量校準。 QQQ掃描使用三重四級桿質譜的多反應監測模式(Multiple reaction monitoring,MRM), 并將碰撞氣體(氮氣)設置為中等。 通過進一步對去簇電壓(Declustering potential,DP) 和碰撞能(Collision energy,CE) 優化, 完成了各個MRM 離子對的DP 和CE。 根據每個時期內洗脫的代謝物,在每個時期監測一組特定的MRM 離子對。
1.3 質控樣本
質控樣本(Quality control samples,QC)由3組不同棉花材料的花瓣樣本提取物等量混合制備而成,設3 個重復。在質譜檢測的過程中,每10個樣本間插入1 個質控樣本,以監測分析過程的重復性。
1.4 數據分析
使用邁維代謝 (武漢) 生物技術有限公司UPLC-MS/MS 檢測平臺[7],利用軟件Analyst 1.6.3[23]進行質譜定性定量分析,包括基線過濾、峰識別、積分、保留時間校正、峰對齊和質譜碎片歸屬分析等。 采用無監督模式識別的主成分分析(Principal component analysis,PCA)、有監督模式識別的偏最小二乘判別分析(Partial least squaresdiscriminant analysis,PLS-DA)和正交偏最小二乘判別分析(Orthogonal partial least squaresdiscriminant analysis,OPLS-DA)等方法,對各組樣本之間的總體代謝物和組內樣本代謝物進行多元統計分析[24],研究3 個棉花材料花瓣之間的類黃酮類代謝產物的差異, 再利用KEGG 網站(http://www.genome.jp/kegg/pathway.html)[25]和MB Role 網站(http://csbg.cnb.csic.es/mbrole/)[26]進行通路富集分析。 差異代謝物的篩選標準:(1)變量權重值(Variable importance in projection,VIP),VIP>1;(2)顯著性閾值,P<0.05;(3)差異倍數(Fold change,FC),經log2轉化,log2FC≥1 或log2FC≤-1。
2 結果與分析
2.1 樣品質量控制及統計分析
海島棉海7124、陸地棉TM-1 和亞洲棉石系亞1 號3 個材料的花瓣如圖1 所示,將3 個樣品及混合樣品的類黃酮類代謝物進行主成分分析(PCA),初步了解各組樣本之間的總體代謝物差異和組內樣本之間的變異度大小。PCA 結果顯示4 組樣本之間類黃酮類代謝物呈分離趨勢, 組間呈聚集趨勢。 由圖2 可以看出, 主要成分PC1、PC2、PC3 對差異的貢獻率分別是54.51%、36.34%、4.98%。這表明不同顏色花瓣樣品的類黃酮類代謝物存在明顯差異。 對花瓣樣品中檢測到的類黃酮類代謝物數據進行歸納總結分析, 對3個樣本進行分組(黃色/ 乳白色、乳白色/ 白色和黃色/ 白色)比較,建立PLS-DA、OPLS-DA 模型進行分析(表1)。 PLS-DA 及OPLS-DA 模型的R2和Q2越接近于1 時表示模型越穩定可靠。 對黃色/乳白色、乳白色/白色和黃色/白色3 組樣品的PLS-DA 和OPLS-DA 模型進行200 次排列驗證, 結果顯示R2、Q2接近1,P值均小于0.05,表明3 個棉花花瓣樣本含有的類黃酮類代謝物的種類與含量存在明顯差異。
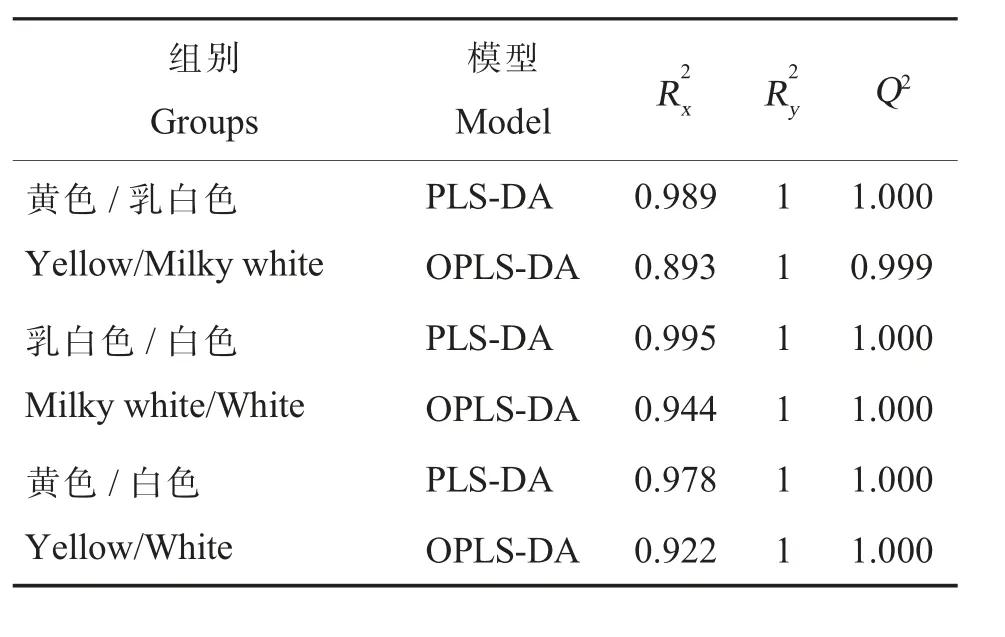
表1 樣本分組比較的R2 和Q2Table 1 The calculated R2 and Q2 values of different groups

圖1 3 個棉花材料表型性狀圖Fig. 1 The phenotypic traits of flower of three cotton materials
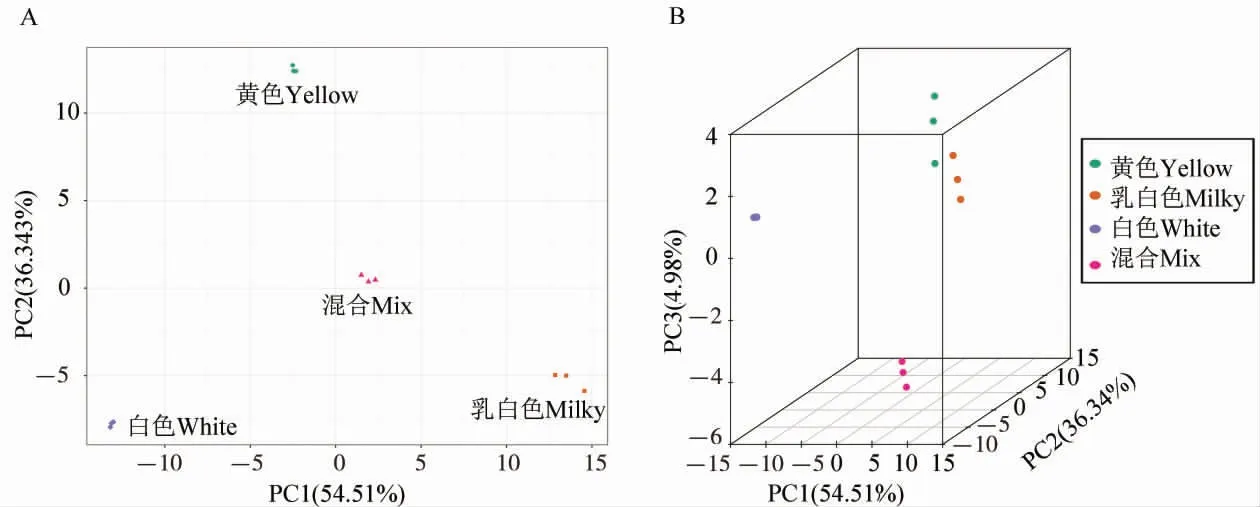
圖2 3 組樣本與質控樣本質譜數據的PCA 結果Fig. 2 PCA results of three groups of samples and quality control
2.2 代謝物分析
基于邁維代謝(武漢)自建代謝物數據庫及相關質譜數據庫,對黃色、乳白色和白色花瓣的類黃酮類代謝物進行質譜定性定量分析。 3 組樣本中共鑒定到10 類184 種類黃酮類代謝物,其中76 種屬于黃酮醇類(41.30%),51 種屬于黃酮類(27.72%),12 種花青素類代謝物,11 種二氫黃酮類代謝物,11 種黃烷醇類代謝物,10 種二氫黃酮醇類代謝物,4 種查耳酮類代謝物,4 種黃酮碳糖苷類代謝物,4 種異黃酮類代謝物,1 種二氫異黃酮類代謝物。 對所檢測花瓣樣品及代謝物進行聚類分析發現,3 種材料花瓣中的類黃酮積累模式存在顯著差異(圖3)。
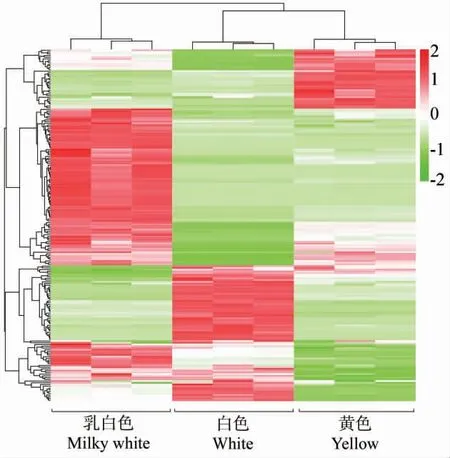
圖3 全部樣品含有的類黃酮類代謝物聚類熱圖Fig. 3 Heatmap of flavonoid metabolites content in all samples
2.3 差異代謝物篩選分析
為了解3 個顏色花瓣中類黃酮類代謝物的組成差異情況,利用單維分析t檢驗(P<0.05)和多維分析OPLS-DA 的VIP 值(VIP>1)篩選各組間的差異代謝物。 如差異代謝物火山圖(圖4)所示,3 個顏色的花瓣之間共存在171 種差異代謝物。 黃色與乳白色花瓣相比存在的差異代謝物有121 種, 其中黃色花瓣中相對含量增加的類黃酮類代謝物共有32 種, 相對含量減少的代謝物89種; 乳白色與白色花瓣比較發現差異代謝物140種,其中乳白色花瓣中相對含量增加的代謝物98種,相對含量減少的有42 種;黃色/ 白色比較組存在有128 種差異代謝物, 黃色花瓣中72 種相對含量增加,56 種相對含量減少。 我們將3 組間差異代謝物的差異倍數進行log2處理,繪制了差異倍數圖,并列出差異倍數排在前20(相對含量增加和減少各10 個)的代謝物(附表1~3)。 其中,黃色/乳白色比較組中差異倍數前20 的代謝物包括黃酮醇類7 種, 黃酮類6 種, 黃烷醇類2種, 查耳酮類2 種, 花青素類1 種, 異黃酮類1種,二氫異黃酮類1 種。乳白色/白色比較組中差異倍數前20 的代謝物有12 種為黃酮醇類,3 種為黃酮類,2 種為黃烷酮類,異黃酮類1 種,二氫異黃酮類1 種,花青素類1 種。黃色/白色比較組中差異倍數前20 的代謝物分別是: 黃酮醇類9種, 黃酮類5 種, 二氫黃酮類2 種, 花青素類1種,黃烷醇類1 種,二氫黃酮醇類1 種,查耳酮類1 種。
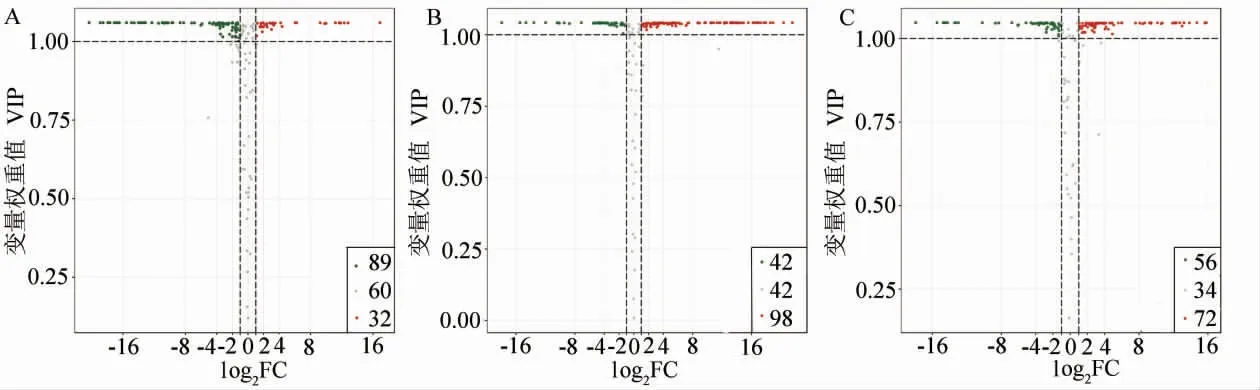
圖4 差異代謝物火山圖Fig. 4 Volcano plot of differentially expressed metabolites
為了研究在不同分組中相對含量變化呈升高和降低趨勢的類黃酮類代謝物,將每組中差異代謝物相對含量的平均值進行z-score 標準化,然后進行K均值(K-means)聚類分析(圖5),在花瓣由黃色至乳白色至白色變化中(表2),15 種呈升高趨勢的代謝物有黃酮醇類(7 種)、黃酮類(4 種),黃烷醇類(1 種),二氫黃酮(1 種)和二氫黃酮醇(1 種);15 種呈降低趨勢的代謝物有黃酮醇(9 種),黃酮類(3 種),查耳酮類(1 種),二氫黃酮醇類(1 種)和花青素類(1 種)。 在花瓣顏色由黃至白的變化中,黃酮醇和黃酮類物質含量有的升高有的降低,只有查耳酮類的異杞柳苷含量呈下降趨勢,推測異杞柳苷可能與棉花黃色花瓣的顏色形成相關。
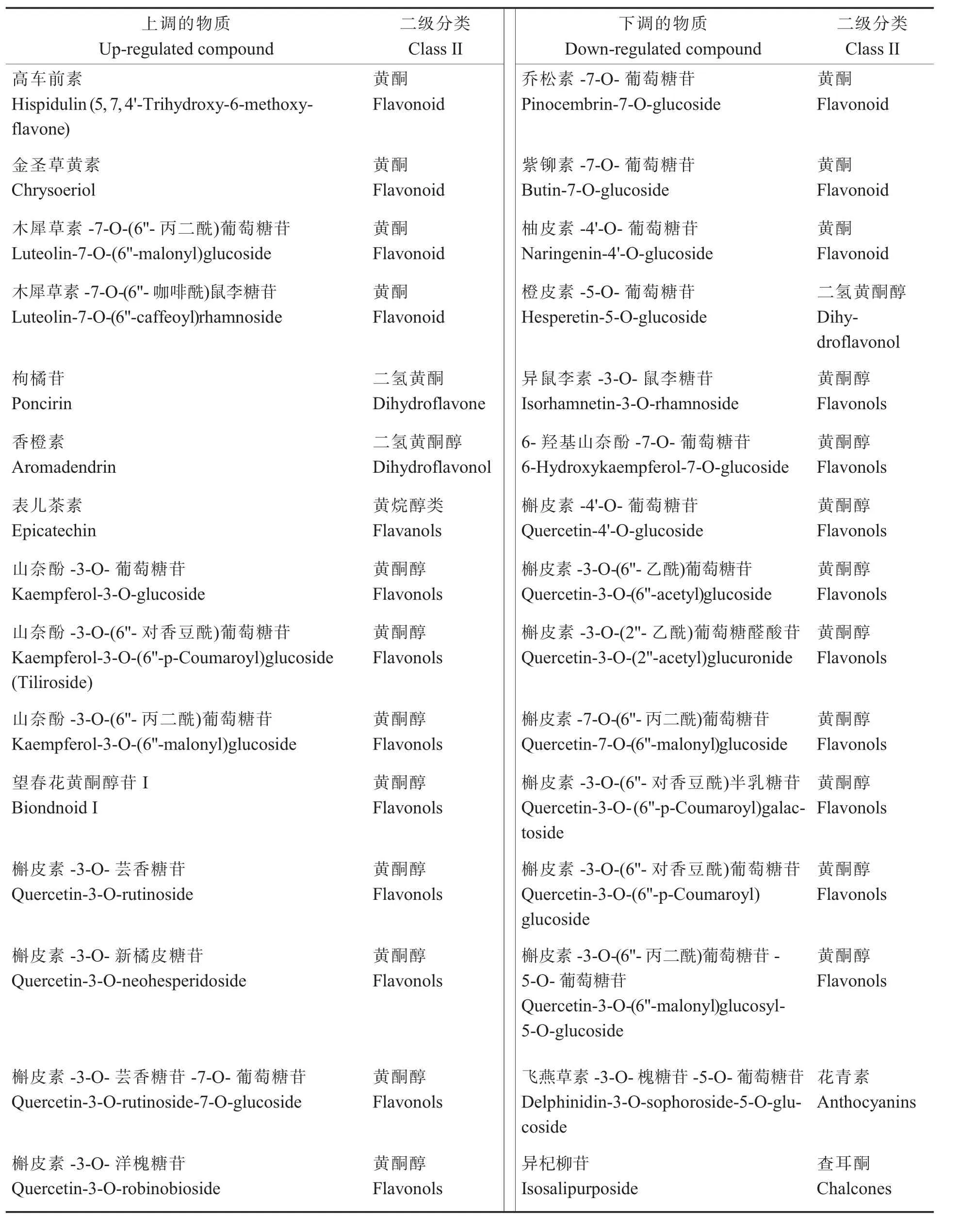
表2 黃色至乳白色至白色花瓣中升高或降低的差異代謝物Table 2 The list of metabolites that increases or decreases from yellow to milky white to white petal
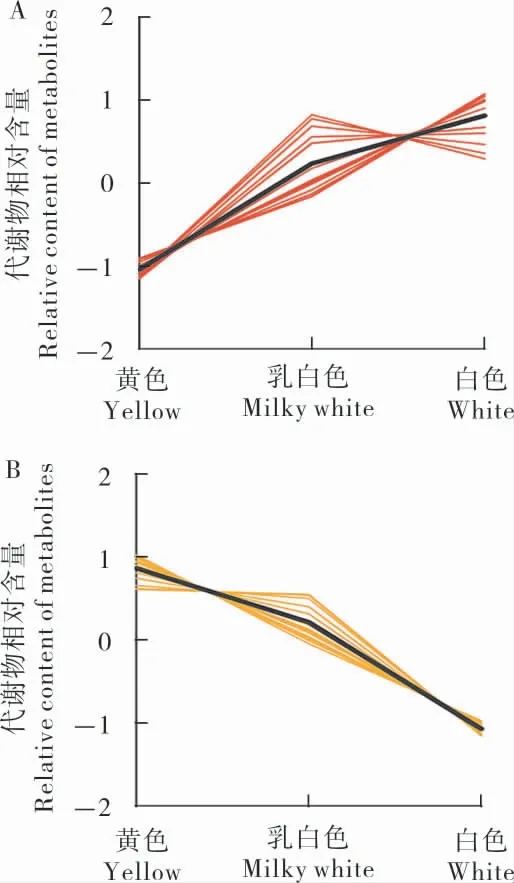
圖5 差異代謝物K-means 圖Fig. 5 K-means diagram of different metabolites
2.4 差異代謝物KEGG 功能注釋及富集分析
我們利用KEGG 和MB Role 網站對差異代謝物涉及的代謝途徑進行通路富集分析,發現有114 種差異代謝物能被注釋到數據庫現有的通路,且主要富集在6 個通路上,分別是代謝途徑、類黃酮的生物合成、異黃酮的生物合成、黃酮和黃酮醇的生物合成、花青素的生物合成和次級代謝產物的生物合成(圖6)。 這些差異代謝物參與1 個或多個代謝通路。 如:表阿夫兒茶精、表沒食子兒茶素、兒茶素、二氫楊梅素、根皮苷、根皮素和沒食子兒茶素均參與了類黃酮生物合成和次級代謝產物的生物合成; 山奈酚-3-O- 葡萄糖苷(紫云英苷)和山奈酚-3-O- 蕓香糖苷均參與了黃酮和黃酮醇的生物合成和次級代謝產物的生物合成;表兒茶素、二氫槲皮素、圣草酚、香橙素均參與了類黃酮的生物合成、代謝和次級代謝產物的生物合成;槲皮素-3-O-葡萄糖苷、槲皮素-3-O-蕓香糖苷(蘆丁)均參與了黃酮和黃酮醇的生物合成、 代謝途徑和次級代謝產物的生物合成;飛燕草素參與類黃酮的生物合成、花青素的生物合成和次級代謝產物的生物合成;楊梅素參與了類黃酮的生物合成、黃酮和黃酮醇的生物合成和次級代謝產物的生物合成;槲皮素、木犀草素和山奈酚均參與了類黃酮的生物合成、黃酮和黃酮醇的生物合成、代謝途徑和次級代謝產物的生物合成;柚皮素參與類黃酮的生物合成、異黃酮的生物合成、 代謝途徑和次級代謝產物的生物合成。黃色/乳白色比較組間的差異代謝物在黃酮和黃酮醇的生物合成途徑上顯著富集,包括14 種代謝物。 乳白色/ 白色比較組間的差異代謝物顯著富集的代謝通路是類黃酮的生物合成。 黃色/ 白色組的差異代謝物在花青素合成途徑富集最顯著,在類黃酮生物合成中富集數量最多,有20 種。 這些差異代謝物參與的代謝途徑可能參與黃色、乳白色和白色花瓣顏色的形成。
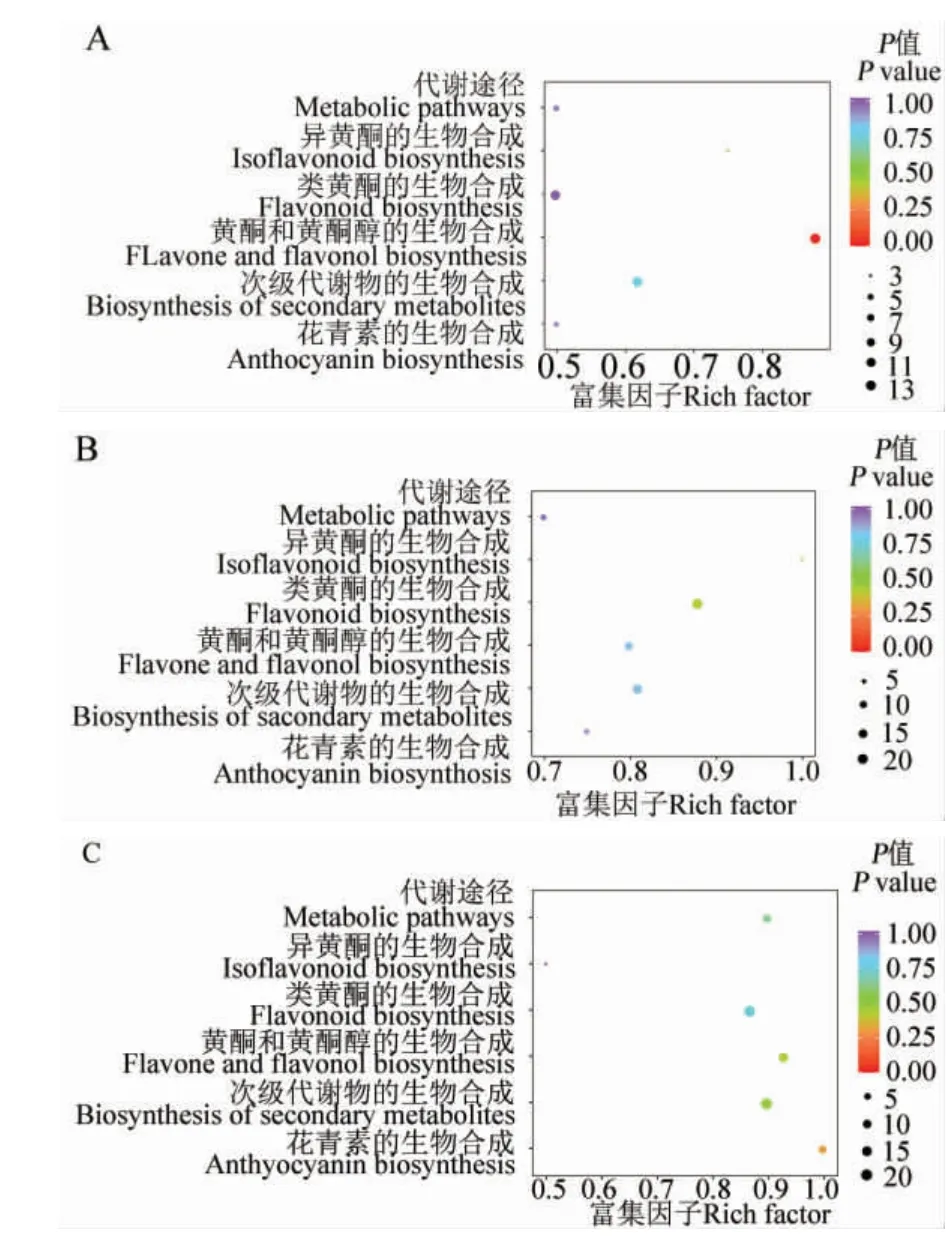
圖6 3 組差異代謝物KEGG 富集通路Fig. 6 Enriched KEGG pathways of differentially expressed metabolites in three groups
我們對在黃色到乳白色到白色花瓣中相對含量變化呈上升趨勢和下降趨勢的類黃酮類代謝物也進行了富集分析,結果顯示,隨著花瓣顏色變化(從黃色到白色),3 種材料中相對含量呈上升趨勢的15 種代謝物中, 有5 種被注釋到代謝途徑上(圖7),分別是香橙素、表兒茶素、金圣草黃素、 山奈酚-3-O- 葡萄糖苷和槲皮素-3-O-蕓香糖苷。 其中后3 種代謝物均參與黃酮和黃酮醇的生物合成途徑,前2 種代謝物均參與類黃酮的生物合成途徑。 有研究表明查耳酮可調控花瓣深黃色的形成[8-9],在黃色、乳白色、白色棉花花瓣中, 異杞柳苷含量逐步下降, 推測異杞柳苷與3種材料花瓣的顏色差異相關, 異杞柳苷參與的代謝途徑可能與棉花花瓣的黃色形成機制密切相關。
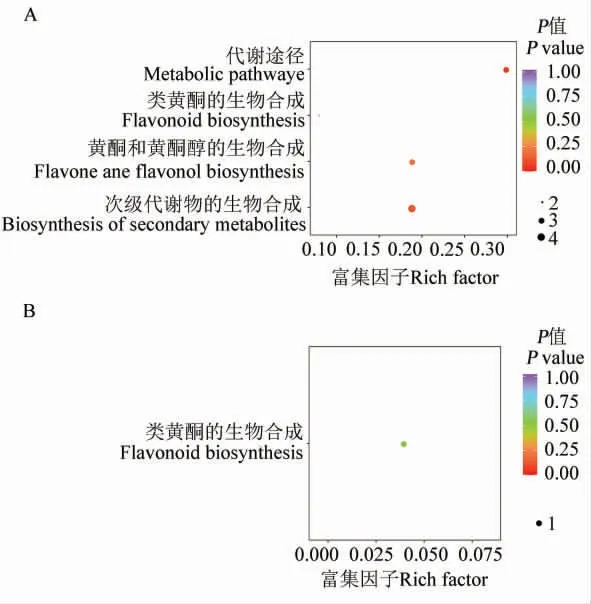
圖7 差異代謝物KEGG 富集通路Fig. 7 Enriched KEGG pathways of differentially expressed metabolite
3 討論
類黃酮化合物是植物體中的一類較大的次級代謝物類群,其生物合成途徑的調控也是人們研究的重點[27]。植物的類黃酮合成途徑受許多轉錄因子的調控,如MYB[28]、bHLH[29]、WD40[30]和NAC[31]以及其他轉錄因子。 擬南芥AtMYBL2編碼R3-MYB 相關蛋白, 參與類黃酮生物合成的調控[32];MYB21 直接與FLS1啟動子中的GARE順式元件結合來調節黃酮醇的生物合成[33]。鈍鱗紫背苔的bHLH 家族蛋白PabHHL1 在擬南芥中異源表達時,能激活黃酮類化合物和花青素的合成,并參與上調黃酮類化合物合成上游和下游的結構基因的表達[34]。 研究發現花瓣的黃色一般與橙酮和查耳酮有關,橙酮在波斯菊、金雞菊和金魚草等的觀賞花卉上呈現亮黃色[35];查耳酮是菊科大麗屬和石竹科石竹屬的黃色色素[36];香石竹花瓣的黃色與查耳酮2′- 葡萄糖苷的合成和積累有關[37]。 我們對差異代謝物的K-means 分析中發現查耳酮類物質在黃色至白色花瓣中呈下降趨勢,推測可能是查耳酮類物質對花瓣黃色的形成具有重要作用。 本研究雖然明確了黃色、乳白色和白色棉花花瓣材料中的主要類黃酮類色素成分,但因花瓣顏色調控的復雜性,未來可以結合轉錄組數據進行類黃酮生物合成途徑上相關基因的分析,深入研究棉花花瓣顏色的形成機制。
類黃酮類化合物結構復雜、種類多樣,對人體健康有許多益處,具有鎮痛、護肝、抗心律失常、抗自由基、抗腦缺血損傷、抗病毒和抗腫瘤等多種生物學活性和藥理作用[38-41]。 以往研究發現在棉花花瓣中提取出的總黃酮物質能有效改善小鼠的記憶障礙[42]。蘆丁、橙皮素和槲皮素等具有抗菌、抗病毒、抗氧化、抗腫瘤、保護心血管和心臟等功能[43-48]。 本研究中棉花黃色、乳白色、白色花瓣中均積累了較多的類黃酮物質,表明花瓣中的類黃酮類次生代謝物具有可利用的價值。
4 結論
本研究采用廣泛靶向代謝組學技術,以3 種棉花材料(海島棉H7124、陸地棉TM-1 和亞洲棉石系亞1 號)的花瓣為研究對象,對花瓣中檢測到的類黃酮類代謝物進行對比分析,共鑒定得到10 類184 種類黃酮類代謝物, 其中差異代謝物171 種,占所有代謝物的92.94%。 通過功能注釋和差異代謝物富集分析,發現這些差異代謝物主要參與黃酮和黃酮醇的生物合成,以及類黃酮的生物合成途徑,這2 條途徑可能是黃色、乳白色和白色棉花花瓣之間差異代謝物形成的主要途徑。 其中,查耳酮類物質異杞柳苷在黃色、乳白色、白色花瓣中的含量逐步減少,推測該物質與棉花花瓣黃色的形成相關。 本研究不僅為棉花不同顏色花瓣中類黃酮類代謝物的利用奠定基礎,并且為棉花花瓣的顏色形成機制及相關代謝途徑研究提供重要理論依據。
附表:
詳見本刊網站(http://journal.cricaas.com.cn)本文網頁版。
附表1 黃色/ 乳白色比較組中差異倍數在前20 的代謝物
Table S1 Top 20 differentially expressed metabolites in the comparison group of yellow/milky white petal
附表2 乳白色/ 白色比較組中差異倍數在前20 的代謝物
Table S2 Top 20 differentially expressed metabolites in the comparison group of milky white/white petal
附表3 黃色/白色比較組中差異倍數前20 的代謝物
Table S3 Top 20 differentially expressed metabolites in the comparison group of yellow/white petal

