化學工藝流程題中常考考點及解題策略
劉凌燕


化學工藝流程題是全國各地高考試題中不可或缺的重要題型,常以現代工業生產為信息背景,命題角度涉及元素化合物性質及轉化、化學實驗中的分離和提純、化學反應原理、化學計算等重要知識,該類題考查知識面廣、考查能力多、實用性和綜合性強。所以對這類題型進行系統分析,提出應對化學工藝流程題的解題策略和復習策略非常必要。
一、解題方法及常考考點
(1)熟悉化學工藝流程題的結構,掌握解題方法和步驟。
化學工藝流程題的結構主要包含四個過程:對原料的預處理、發生核心化學反應、粗產品的分離和提純、最后得到目標產物。總的指導思想就是:原料易得、利用率高;所得產品更純、產率更高;更經濟、更環保。
解題時首先要抓住一個關鍵點:一切反應或操作都是為獲得產品而服務。解答時先從題干中獲取有用信息,了解原料及需要生產的產品。
其次最關鍵的步驟是分析流程圖,基本方法如下:①整體瀏覽一下流程,基本辨別出預處理、反應、提純、分離等階段。②分析流程中的每一步驟及操作目的,根據箭頭的指入和條件確定發生的核心化學反應。分析該反應對最終的目標產品的作用和影響。以及在后續的操作中應該如何處理前面步驟產生的影響?同時注意分析外界條件的影響,主要從以個幾個方面考慮:對反應速率有何影響?對平衡轉化率有何影響?對綜合生產效益有何影響?③了解流程中各步驟的目的和反應后著手答題。要善于從問題中獲取信息,幫助解題。解答時緊緊圍繞總的指導思想去分析和突破。
對于比較陌生且復雜的流程圖,需要宏觀把握整個流程,可針對每一小問的問題,只分析涉及的步驟或聯系該步驟前后操作作出分析即可,不必把每個環節的原理都弄清楚。
流程題中的設問一般相對獨立,無連帶效應,一個問題解決不了不會影響下一個問題的解決。題中基本上都有與流程無關的問題,可直接作答;與流程有關的問題,回到流程圖中找答案;對于超綱知識,題目中要么有信息提示,要么與解答題目無關。掌握流程題的解題方法及設問中的答題特點,可以有效提高得分率。
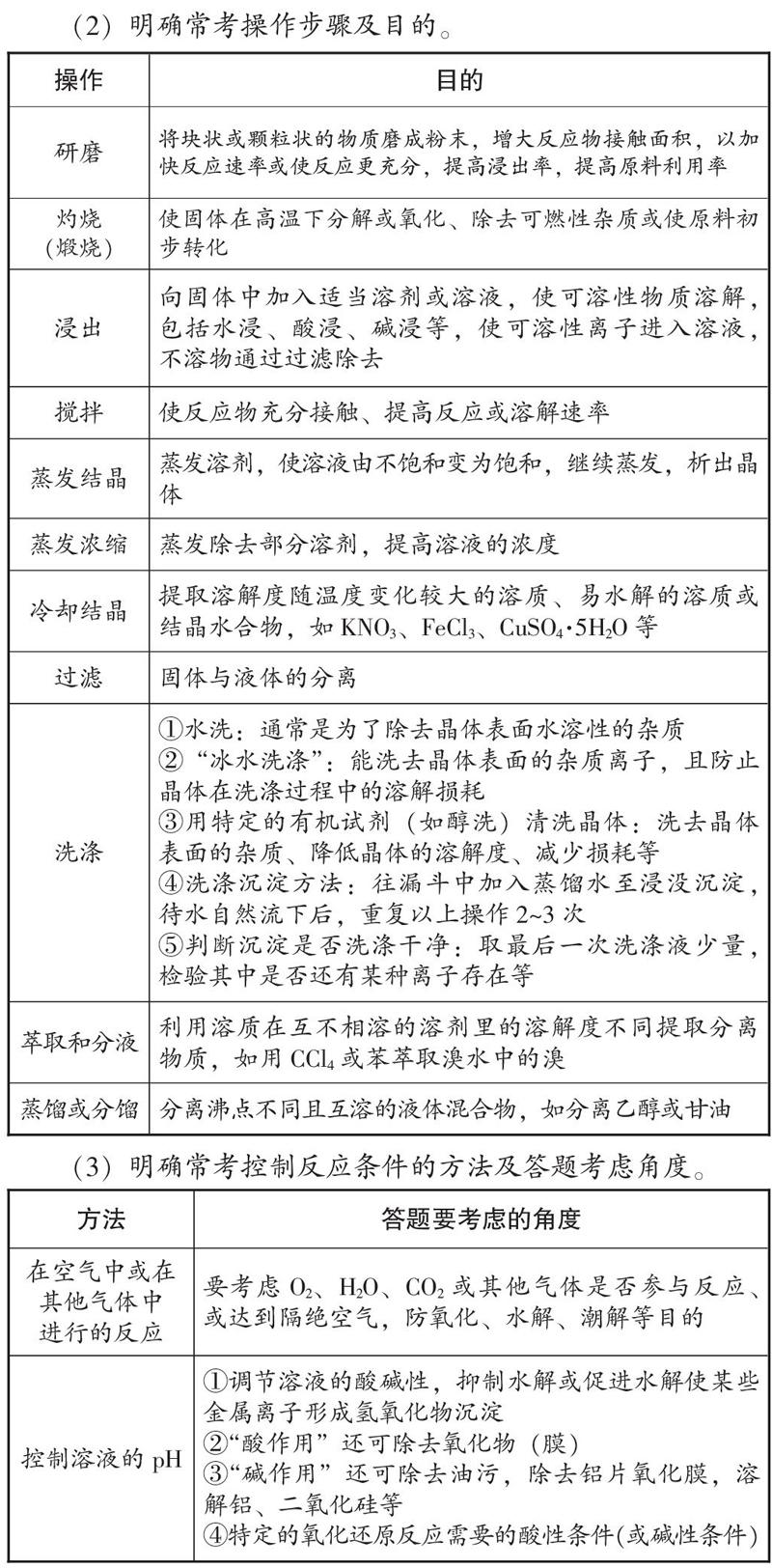
(2)明確常考操作步驟及目的。
(3)明確常考控制反應條件的方法及答題考慮角度。
(4)明確常考物質的成分及判斷方法。
①循環物質的判斷:指后面反應步驟中的生成物,同時又是前面反應步驟中的反應物。注意可逆反應的反應物也可以循環利用。如果有箭頭指向,也可以看箭頭的方向,一般是后面步驟中的箭頭往回指對應的物質。
②副產品的判斷:首先是生成物,不是反應物。不是主產品,是支線的副產品,且是對人類生產和生活有用的、無毒、不污染環境的物質。
③濾渣和濾液成分的判斷:要考慮樣品中原料和雜質的成分在每一步驟中與每一種試劑反應的情況:哪些物質或離子發生了反應,產生了哪些新物質或離子?同時注意所加試劑是否過量,分析過量和不過量對應下的反應。以及在每一步驟中反應物和產物的溶解性,分析存在濾渣中還是濾液中。還需要注意過量試劑和產生的新物質和離子在后緒步驟中的影響。最重要的是在判斷成分時緊緊圍繞得到目標產品而分析。
二、工業流程題中幾個重要考點的解題策略和備考建議
(1)晶體的制備及方法。
首先能根據物質的溶解度判斷結晶的方法:溶解度受溫度影響較小的一般采取蒸發結晶的方法;溶解度受溫度影響較大或帶有結晶水的鹽一般采取蒸發濃縮、冷卻結晶的方法。明確常考點有:判斷結晶方法、得到晶體的一系列操作、根據溶解度曲線分析問題。下面通過實例分析。
【例1】利用水鈷礦(主要成分為Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多種化工試劑,以下為草酸鈷晶體和氯化鈷晶體的制備流程,回答下列問題:
已知:①浸出液中含有的陽離子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有兩種沉淀。回答下列問題:
(4)操作Ⅰ包括:將水層加入濃鹽酸調整pH為2~3,_____、_____、_____、洗滌、減壓烘干等過程。
解題思路:得到純凈的晶體一般包括過濾、洗滌、干燥等基本步驟,但這小問中有三個空要填,所以要仔細審題分析后再做答。通過審題可知是經過操作Ⅰ由溶液得到帶結晶水合物的鹽,故除題中已知過程外,操作Ⅰ還包括蒸發濃縮、冷卻結晶、過濾。
備考建議:學生首先要熟記結晶的一般規律和方法等必備知識,還要提高審題能力,解題時緊扣信息、抓住關鍵、規范和準確答題,同時用正確的化學術語及文字等表述。在高考中沒有千遍一律的答案,即使是考查同一個知識點,也可以是從不同的角度去命題。
【例2】三鹽基硫酸鉛(3PbO·PbSO4·H2O,不溶于水)主要適用于不透明的聚氯乙烯硬質管、注射成型制品,也可用于人造革等軟質制品。以鉛泥(主要成分為PbO、Pb及PbSO4等)為原料制備三鹽的工藝流程如圖2所示。
已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13回答下列問題:
(2)根據圖溶解度曲線(g/100g水),由濾液I得到Na2SO4固體的操作為將“濾液1”____、____、用乙醇洗滌后于燥。
解題思路:由題可知濾液1中含有Na2CO3和Na2SO4等成分,結合圖像分析可知,溫度較高時析出硫酸鈉,溫度較低時析出硫酸鈉結晶水合物,且硫酸鈉晶體析出時溫度越高,溶解度越小;因此由濾液I得到Na2SO4固體的操作為將“濾液1”蒸發(升溫)結晶、趁熱過濾。趁熱過濾是為了防止溫度降低時析出其他晶體,洗滌晶體時用乙醇洗滌避免形成結晶水合物。
備考建議:在復習溶解度時不但要求學生能掌握一般的溶解度曲線,還要能分析一些不常見或變化復雜的曲線、提升圖像分析能力。在化學學科的核心素養證據推理和模型認知中指出:能對復雜的化學問題情境中的關鍵要素進行分析以建構相應的模型,能選擇不同模型綜合解釋和解決復雜的化學問題。學生要掌握晶體制備的一般步驟和方法的答題模型,且能在復雜溶解度圖像中能判斷和選擇相應的模型來解答問題。
(2)有關pH調節。
在《化學反應原理》教材中學過用調pH的方法除去硫酸銅中的鐵離子,具體方法是加入CuO、Cu(OH)2、Cu2(OH)2CO3等物質與H+反應,使溶液pH增大;促使鐵離子完全轉化為氫氧化鐵沉淀達到去除的目的。這就是調pH的原型,在化工流程題中也常考查用調pH的方法除某些金屬陽離子。但是解題時要明確調pH的目的有很多,要結合題目綜合分析去判斷目的所在。下面通過實例分析。
【例3】(2017·全國卷Ⅲ,27節選)重鉻酸鉀是一種重要的化工原料,一般由鉻鐵礦制備,鉻鐵礦的主要成分為FeO·Cr2O3,還含有硅、鋁等雜質。制備流程如圖4所示:
回答下列問題:
(1)步驟①的主要反應為FeO·Cr2O3+Na2CO3+NaNO3 ■ Na2CrO4+Fe2O3+CO2+NaNO2
上述反應配平后FeO·Cr2O3與NaNO3的系數比為_____。
(2)濾渣1中含量最多的金屬元素是______,濾渣2的主要成分是______及含硅雜質。
(3)步驟④調濾液2的pH使之變_____(填“大”或“小”),原因是_____(用離子方程式表示)。
解題思路:根據題目意圖要除去Fe、Si、Al元素等雜質得到目標產品。在熔融氧化過程中已知主要反應為FeO·Cr2O3+Na2CO3+NaNO3 ■ Na2CrO4+Fe2O3+CO2+NaNO2,卻難以判斷Si、Al元素等雜質是否發生了反應,生成了什么產物。在第(2)中出現了濾渣1的成分判斷,根據已知反應可知濾渣1為Fe2O3,則含量最多的金屬元素是鐵元素;同時在第(2)中還出現濾渣2的成分的判斷,結合濾液1調節pH=7后,Al3+會變為Al(OH)3沉淀而除去,故濾渣2的主要成分是Al(OH)3和含硅雜質。濾液2中主要成分是Na2CrO4,濾液3中的主要成分應為Na2Cr2O7,則第④步調節pH的作用是使Na2CrO4轉化為Na2Cr2O7,離子方程式為2Cr■+2H+?葑Cr2■+H2O,故應調節pH使之變小酸性越強越利于Na2CrO4轉化為Na2Cr2O7。
備考建議:學生在解題中習慣定性思維,用固有的模式答題,容易認為是將溶液pH調大,而可能進入答題誤區。解題時首先要打破固有思維,提高獨立思考和分析能力,具備科學探究和創新能力。當然,學生仍需熟悉調pH常見考查形式:調pH的目的、調pH需要加入的物質等。掌握調pH常用于使某些金屬離子形成氫氧化物沉淀。調節pH所需的物質一般應滿足兩點:能與H+反應,使溶液pH增大;不引入新雜質。
【例4】鎵是制作高性能半導體的重要原料。工業上常從鋅礦冶煉的廢渣中回收鎵。已知某鋅礦渣主要含Zn、Si、Pb、Fe、Ga的氧化物,利用該礦渣制鎵的工藝流程如下:
已知:①鎵在元素周期表中位于第四周期第ⅢA,化學性質與鋁相似。②lg2=0.3,lg3=0.48。③部分物質的Ksp如下表所示。回答下列問題
(3)調pH的目的是____;室溫條件下,若浸出液中各陽離子的濃度均為0.01mo/L,當溶液中某種離子濃度小于1×10-5mol/L時即認為該離子已完全除去,則pH應調節的范圍_______。
解題思路:Ga的性質與Al相似,鋅礦渣中加入H2SO4,充分反應,其中Zn、Fe、Ga轉化為可溶于水的ZnSO4、FeSO4、Ga2(SO4)3,Pb轉化成難溶于水的PbSO4,SiO2與H2SO4不反應。向浸出液中加入H2O2,H2O2將Fe2+氧化成Fe3+,然后調節溶液的pH使Fe3+、Ga3+轉化為氫氧化物沉淀與Zn2+分離。Fe(OH)3和Ga(OH)3屬于同種類型,Ksp[Ga(OH)3]>Ksp[Fe(OH)3],Ga3+完全沉淀時Fe3+已經完全沉淀,濃度小于1×10-5mol/L,c(OH)=■=■=3×10-9mol/L,c(OH+)=■×10-5mol/L,pH=lg■×10-5=5.48,Zn2+開始沉淀時c(OH-)=■=■=4×10-8mol/L, c(OH+)=■×10-6mol/L,則pH=-lg■×10-6=6.6,則pH應調節的范圍為5.48 備考建議:溶度積的應用和計算是沉淀溶解平衡中一個非常重要的知識點,在考綱中不僅要理解溶度積的含義,也要能進行相關的計算。學生還要能判斷混合溶液中多種離子沉淀的先后順序以及pH的相關計算,同時要求學生能掌握計算的一般規律和步驟,提高數學運算能力,才能準確地計算出結果。 (3)關于物質成份的判斷。 【例5】某地煤矸石經預處理后主要含SiO2(61%)、Al2O3(30%)和少量的Fe2O3、FeO及鈣鎂化合物等。某實驗小組利用其提取Al(OH)3。 (1)濾渣Ⅱ的主要成分是CaCO3、Mg(OH)2和________。 (2)上述流程中可循環利用的物質的化學式是________。 解題思路:(1)稀鹽酸酸浸時發生的反應有Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O、FeO+2H+=Fe2++H2O,過濾后得到的濾渣Ⅰ為SiO2。向濾液中通入氯氣,Fe2+被氧化為Fe3+。水解時加入碳酸鈉,CO3 2-可以促進Al3+、Fe3+、Mg2+的水解,生成氫氧化物沉淀和CO2,同時還能和Ca2+生成CaCO3沉淀。加入NaOH溶液,Al(OH)3溶解,過濾后得到的濾渣Ⅱ為CaCO3、Mg(OH)2和Fe(OH)3。濾液中含有NaAlO2,通入二氧化碳轉化時發生的反應為AlO-2+CO2+2H2O=Al(OH)3↓+HCO-3或2AlO-2+CO2+3H2O=2Al(OH)3↓+CO3 2-,過濾得到Al(OH)3,母液Ⅱ中含有NaHCO3或Na2CO3。(2)水解時生成二氧化碳氣體、轉化時需要二氧化碳,水解時需要碳酸鈉、轉化時得到碳酸氫鈉或碳酸鈉,所以能循環利用的是CO2、Na2CO3。 備考建議:本題考查了常見金屬氧化物和二氧化硅與酸的反應、氯氣氧化亞鐵的反應、典型的雙水解反應、氫氫化鋁與強堿的反應、二氧化碳與偏鋁酸鈉的反應等。這些反應基本上都是教材中學過的反應,所以備考復習時一定要將元素及其化合物的性質、轉化這部分內容做重點復習。重視知識的應用,善于從基本概念和反應原理的角度分析流程中的元素化合物知識。還需要關注元素化合物知識與生產和生活的聯系。總之,扎實學好元素化合物的知識是做好化學工藝流程題的根基。另外在判斷成分時要前后聯系,注意各步反應之間的關聯和操作目的,關注流程中的箭頭指向,準確作出判斷。 三、工業流程題分類突破 題型一:提純類化工流程題 【例6】(2018·全國卷Ⅱ,26)我國是世界上最早制得和使用金屬鋅的國家。一種以閃鋅礦(ZnS,含有SiO2和少量FeS、CdS、PbS雜質)為原料制備金屬鋅的流程如圖7所示: 相關金屬離子[c0(Mn+)=0.1 mol·L-1]形成氫氧化物沉淀的pH范圍如下: 回答下列問題: (1)焙燒過程中主要反應的化學方程式為________。 (2)濾渣1的主要成分除SiO2外還有________;氧化除雜工序中ZnO的作用是_______,若不通入氧氣,其后果是_________。 (3)溶液中的Cd2+可用鋅粉除去,還原除雜工序中反應的離子方程式為______________。 (4)電解硫酸鋅溶液制備單質鋅時,陰極的電極反應式為______;沉積鋅后的電解液可返回_____工序繼續使用。 解題思路:焙燒過程中主要為ZnS和O2反應得到ZnO和SO2,加入稀H2SO4酸浸后發生一系列化學反應:ZnO+H2SO4=ZnSO4+H2O、Fe2O3+3H2SO4= Fe2(SO4)3+3H2O、CdO+H2SO4= CdSO4+H2O、PbO+H2SO4=PbSO4+H2O。其中SiO2和PbSO4不溶于水,所得濾渣中含有SiO2和PbSO4。氧化除雜工序中O2能將Fe2+轉化為Fe3+,有利于除雜,加入ZnO能消耗H+,調節溶液的pH,促進Fe3+水解,所得濾渣2為Fe(OH)3。加入Zn粉,發生反應Zn+Cd2+= Zn2++Cd。過濾后的濾液中主要含ZnSO4,ZnSO4經電解后生成單質Zn。陰極放電的是Zn2+和H+。因為溶液中的Zn2+濃度較大,所以陰極電極反應式應該是Zn2++2e- = Zn,陽極放電的是OH-,電極反應式是4OH--4e-=2H2O+O2↑。沉積鋅后的溶液應該是ZnSO4和稀H2SO4,可返回到溶浸工序循環使用。 答案:(1)2ZnS+3O2■2ZnO+2SO2? (2)PbSO4 調節溶液的pH 無法除去雜質Fe2+ (3)Cd2++Zn= Cd+Zn2+ (4)Zn2++2e-=Zn 溶浸 題型二:制備類化工流程題 【例7】[2018·全國卷Ⅰ,27(1)(2)]焦亞硫酸鈉(Na2S2O5)在醫藥、橡膠、印染、食品等方面應用廣泛。回答下列問題: (1)生產Na2S2O5,通常是由NaHSO3過飽和溶液經結晶脫水制得。寫出該過程的化學方程式:______________。 (2)利用煙道氣中的SO2生產Na2S2O5的工藝為: ①pH=4.1時,Ⅰ中為_____溶液(寫化學式)。 ②工藝中加入Na2CO3固體、并再次充入SO2的目的是______。 解題思路:(1)根據題給信息,將NaHSO3過飽和溶液結晶脫水可得到Na2S2O5,則化學方程式為2NaHSO3=Na2S2O5+H2O。(2)①SO2與Na2CO3溶液反應可能生成Na2SO3也可能生成NaHSO3,因Na2SO3溶液顯堿性,I中溶液顯弱酸性,所以生成的是NaHSO3。②審題時抓住“生產Na2S2O5,通常是由NaHSO3過飽和溶液經結晶脫水制得”,則工藝中加入Na2CO3固體、并再次充入SO2的目的是得到NaHSO3過飽和溶液。 答案:(1)2NaHSO3=Na2S2O5+H2O(2)①NaHSO3 ②得到NaHSO3過飽和溶液 責任編輯 李平安

