西瓜CGMMV脅迫下MIR319家族成員及靶基因的鑒定分析
孫玉燕 張慧青 范 敏 何艷軍 郭平安
(1浙江省農業科學院蔬菜研究所,浙江 杭州 310021;2山西師范大學生命科學學院,山西 臨汾 041000)
西瓜(Citrullus lanatusL.)是葫蘆科一年生蔓性草本植物,在全世界各地均有種植。目前西瓜生產受到黃瓜綠斑駁花葉病毒(Cucumber green mottle mosaic virus,CGMMV)的嚴重威脅。CGMMV 屬于蕪菁花葉病毒科煙草花葉病毒屬,為正單鏈線狀RNA 病毒,病毒粒體為桿狀,大小為300 nm×18 nm[1]。CGMMV 主要侵染西瓜、甜瓜、黃瓜等葫蘆科作物[2],可通過種子、花粉、土壤、介體、機械接觸和水源等多種途徑進行傳播[3-4]。自1935年至今,已報道CGMMV 在全世界30 多個國家和地區均有分布[5-7]。近年,CGMMV 傳播速度迅速加快,影響了葫蘆科作物尤其是西瓜產業的發展,給商業育種、育苗培育、種子貿易、產品生產和零售等行業帶來全球性危害[7]。因此,加強CGMMV的防治,提高西瓜對CGMMV 的抗性是我國乃至全球西瓜生產亟需解決的重要問題。
MiroRNAs(miRNAs)是長度為19~25 nt 調控基因表達的內源小RNA,2002年首次在植物中被報道[8]。MiRNAs 可與靶mRNA 的3′-UTR 特異性配對,引起靶mRNA 的降解或抑制其翻譯,進而實現對靶基因的轉錄后調控。miRNAs 在植物生長發育及抗逆應答中發揮重要的作用[9]。逆境條件下,植物通過調控miRNAs 的表達進一步作用于相應的靶基因以提高植物對脅迫的抗性[10]。MIR319 是植物中一類保守的miRNA 家族,主要調節靶基因TCP和MYB轉錄因子的表達[11]。MIR319 及靶基因可調節植物葉片發育[12]、花器官發育[13]、次生細胞壁生物合成[14]、細胞增殖[15]及根結發育[16]等生物學過程。
此外,MIR319 及靶基因調控植物對生物脅迫的應答過程。在根結線蟲(root knot nematode,RKN)的脅迫下,番茄miR319/TCP4 調節葉片茉莉酸(jasmonic acid,JA)合成基因的表達和內源激素JA 的水平,進而調控對RKN 的抗性[17]。棉花miR159-MYB、miR319-TCP4 和miR167-ARF8 在RKN 脅迫下的表達水平表現為負調控,說明miRNAs 介導的基因調控參與棉花對RKN 的脅迫應答[18]。水稻齒葉矮縮病毒(Rice ragged stunt virus,RRSV)侵染水稻可誘導miR319 的表達,抑制靶基因TCP2 的表達,使內源激素JA 水平降低,促進病毒侵染和癥狀發展[19]。此外,miR319a可靶向與馬鈴薯Y 病毒(Potato virus Y,PVY)相互作用的下游赤霉素(gibberellin,GA)信號轉導,參與GA的信號轉導過程[20]。但目前關于miR319 及靶基因在西瓜CGMMV 脅迫應答中的作用尚不明確。
本研究前期通過對CGMMV 侵染前后的西瓜材料JJZ-M 進行miRNAs 高通量測序,鑒定獲得了MIR319家族的3 個成員,miR319、miR319a 及miR319a-3p;其中miR319 在CGMMV 侵染后呈現抑制表達,而miR319a 在CGMMV 侵染后呈現誘導表達[21]。為進一步明確MIR319 在CGMMV 脅迫應答中的作用,本研究從西瓜材料JJZ-M 中分離并克隆MIR319 家族成員的前體基因并對其進行系統進化分析,分析其啟動子區的順式作用元件;對MIR319 的靶基因及剪切位點進行鑒定,對靶基因所編碼蛋白進行生物信息學分析;利用轉錄組測序(RNA-Seq)及實時熒光定量PCR(quantitative real-time PCR,qRT-PCR)對靶基因在CGMMV 不同侵染時間的表達進行分析,旨在為進一步了解MIR319 家族成員及靶基因對CGMMV 脅迫應答的作用機制奠定基礎。
1 材料與方法
1.1 植物材料
試驗材料為西瓜的高代自交系材料JJZ-M,來源于浙江省農業科學院蔬菜研究所。55℃溫湯浸種30 min 后,28℃恒溫箱催芽24 h,待種子露白后播種,在植株兩片真葉期進行CGMMV 人工摩擦接種。取保存的發病葉片和磷酸鹽緩沖液,用研缽研磨成糊狀病毒汁液用于接種。分別于接種0 h(CK)、48 h、25 d 取樣,各取3 株混成一個樣品重復進行RNA-Seq,RNASeq 為1 個生物學重復。
1.2 MIR319 家族前體基因預測及分子克隆
利用Blastn(E-value =1e-2)將MIR319 家族3 個成員(miR319、miR319a 及miR319a-3p)的成熟序列與西瓜基因組數據庫(http:/ /cucurbitgenomics.org/organism/1)進行比對,獲得與MIR319 家族成員成熟序列完全匹配的基因組序列。截取MIR319 兩端150 nt 的核苷酸序列,采用mfold 在線軟件進行二級結構分析[22]。若其存在完整的莖環結構且成熟序列完全位于3′或5′端,則預測該莖環結構對應的核苷酸序列為MIR319 的前體基因Pre-MIR319。
根據Pre-MIR319 莖環結構的基因序列,設計特異性引物(F: 5′-AGAGCTTTCTTCAGTCCAC-3′;R: 5′-G GAGCTCCCTTCAGTCCAA-3′)進行PCR 擴增。PCR 反應體系為20 μL,包含2 μL DNA (50 ng·μL-1)、10 μL 2 × TSINGKE Master Mix、 上游和下游引物(10 μmol·L-1) 各0.5 μL、7 μL ddH2O。PCR 反應程序為:94℃預變性4 min;94℃變性30 s,55℃退火30 s,72℃延伸45 s,33 個循環;72℃延伸8 min。PCR 產物經1.0%瓊脂糖凝膠電泳檢測后,送杭州擎科梓熙生物技術有限公司測序。
1.3 MIR319 前體基因序列及成熟序列比對及系統進化分析
提取miRbase 22.0 數據庫[23]中35 個物種的116條miR319 的前體序列,利用MEGA5.1 軟件采用Neighbor-Joining 法構建西瓜Pre-MIR319 與其他物種miR319 前體基因的系統進化樹。此外,選取來自不同物種的成熟miR319 序列,與西瓜MIR319 成熟序列進行序列比對和系統進化分析。
1.4 MIR319 前體基因啟動子區順式作用元件分析
提取西瓜Pre-MIR319 上游1 500 bp 的序列,利用PlantCARE 軟件[24]對其所包含的順式作用元件進行預測和分析。
1.5 MIR319 靶基因預測及相關生物學分析
根據前期降解組測序的結果(CGMMV 處理前后的葉片混樣,1 個生物學重復),對MIR319 的靶基因及其靶切割位點進行分析。利用ScanProsite 對靶基因編碼蛋白質的結構域進行分析;ProtParam 對靶基因編碼蛋白的氨基酸數目、相對分子量、理論等電點進行分析;TMHMM 預測靶基因編碼的蛋白質是否含有跨膜結構域;WolfPSORT 在線軟件對靶基因的亞細胞定位進行預測。
1.6 轉錄組測序(RNA-Seq)及qRT-PCR 分析靶基因在CGMMV 不同侵染階段的表達
根據本研究前期RNA-Seq 的結果,獲得MIR319的靶基因在CGMMV 不同侵染階段(0 h、48 h 和25 d)的表達,明確MIR319 與靶基因的靶調控關系。此外,進一步利用qRT-PCR 分析MIR319 靶基因在CGMMV不同侵染階段(0 h、48 h 和25 d) 的表達。利用FastKing RT Kit [天根生化科技(北京)有限公司]將約2 μg 總RNA 反轉錄成cDNA,以TUA作為內參基因。qRT-PCR使用TransStart Top Green qPCR Supermix 試劑盒(北京全式金生物技術有限公司),在StepOne Plus Real-Time PCR System ( Applied Biosystems,美國)中完成。反應程序:95℃預變性30 s,95℃變性5 s,55℃退火15 s,72℃延伸10 s,40 次循環,3 次生物學重復。采用2-ΔΔCT法[25]計算基因相對表達量。所用引物及序列見表1。

表1 引物及序列Table 1 Primers and sequences
2 結果與分析
2.1 MIR319 家族成員鑒定及表達分析
根據前期對CGMMV 侵染前后的西瓜葉片的miRNAs 高通量測序結果[21]。在兩個文庫中共獲得3個MIR319 家族成員,miR319、miR319a 及miR319a-3p。其中,在CGMMV 侵染25 d 后miR319 呈現抑制表達,而miR319a 呈現誘導表達,miR319a-3p 呈現下調表達(表2),說明MIR319 家族成員對CGMMV 的脅迫呈現不同的響應模式。
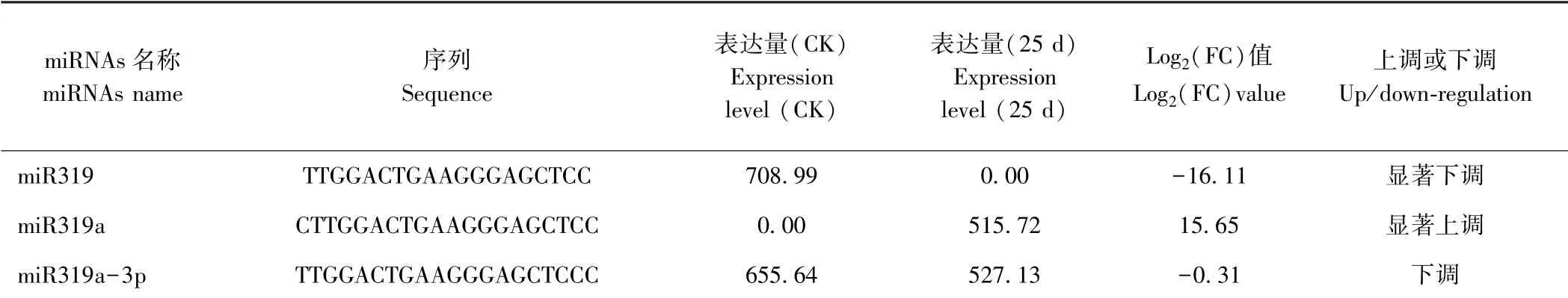
表2 CGMMV 脅迫下MIR319 家族成員鑒定及表達分析Table 2 Identification of MIR319 family member and their expression under the CGMMV stress
2.2 MIR319 家族前體基因預測及克隆
分別將MIR319 家族的3 個成員,miR319(TTGGA CTGAAGGGAGCTCC)、miR319a(CTTGGACTGAAGGG AGCTCC)及miR319a-3p(TTGGACTGAAGGGAGCTC CC)的成熟序列與西瓜基因組數據庫(http:/ /cucurbitgenomics.org/organism/1)進行Blast 序列比對。獲得與miR319 成熟序列完全匹配的4 條基因組序列,包 括 Chr1: 1904345..1904363、 Chr1: 6347848..6347866、Chr5:29773551..29773569 和Chr7:6929678..6929696;獲得與miR319a 成熟序列完全匹配的3 條基因組序列,包括 Chr1: 1904344..1904363、 Chr5:29773551..29773570 及Chr7:6929678..6929697;獲得與miR319a-3p 成熟序列完全匹配的2 條基因組序列,包括Chr1:1904345..1904364 及Chr5:29773550..29773569。其 中 僅Chr1:1904345..1904363 (Chr1:1904344..1904363;Chr1:1904345..1904364)及其上、下游序列(各150 bp)能夠形成完整的莖環結構,說明miR319、miR319a 及miR319a-3p 的成熟miRNA 序列來源于同一個前體基因Pre-MIR319。以西瓜基因組DNA 為模板對Pre-MIR319 進行PCR 擴增(圖1)。通過測序分析,Pre-MIR319 的前體基因長度為170 bp,可形成穩定的莖環結構(圖2)。

圖1 Pre-MIR319 PCR 擴增Fig.1 PCR amplification of Pre-MIR319
2.3 MIR319 家族成熟序列的比對及前體基因系統進化分析
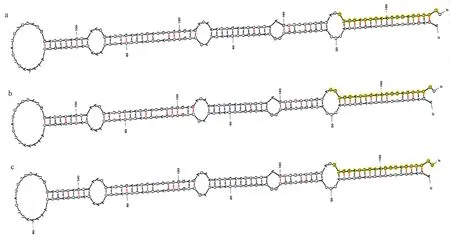
圖2 Pre-MIR319 形成的莖環結構及MIR319 家族成員的成熟序列Fig.2 Stem-loop structures of Pre-MIR319 and mature sequences of MIR319 family member
選取miRbase 22.0 數據庫中10 個物種的10 條成熟miR319 序列,與西瓜MIR319 成熟序列進行序列比對和系統進化分析。序列比對顯示,MIR319 成熟體序列在5′端第2 ~第14 位以及16 ~20 位堿基具有較高的保守性,而在5′端第1、第15、第21、第22 位堿基存在差異(圖3)。這些堿基差異可能使不同物種的MIR319 成員作用于不同的靶基因,進而產生不同的功能。選取miRbase 22.0 數據庫中35 個物種的116 條MIR319 前體序列,與西瓜Pre-MIR319 一起通過MEGA5.1 進行系統進化分析,可將這些MIR319 前體序列分為四大分支。第一分支含有36 個成員,第二分支含有32 個成員,第三分支含有18 個成員,第四分支含有30 個成員,表明MIR319 在不同物種間的進化關系上存在差異性。其中西瓜Pre-MIR319 位于第一分支,親緣關系與馬鈴薯 miR319a 的前體基因(MI0025952)最近(圖4)。
2.4 Pre-MIR319 啟動子區順式作用元件分析
對Pre-MIR319 上游1 500 bp 啟動子區所含的順式作用元件進行分析,發現其含有多個順式作用元件(圖5)。包括基因啟動子和增強子區的順式作用元件(TATA-box 和CAAT-box)、光響應元件(TCCC-motif、chs-CMA1a、chs-CMA2a、Ⅰ-box、Box 4、GATA-motif 和GT1-motif)、赤霉素響應元件(P-box 和TATC-box)、乙烯響應元件(ERE)、茉莉酸甲酯響應元件(CGTCAmotif 和TGACG-motif)、類黃酮生物合成基因調控元件(MBSI)、分生組織表達響應元件(CAT-box)以及MYB和MYC 等順式作用元件。

圖3 MIR319 成熟序列比對Fig.3 Alignment of the MIR319 mature sequence
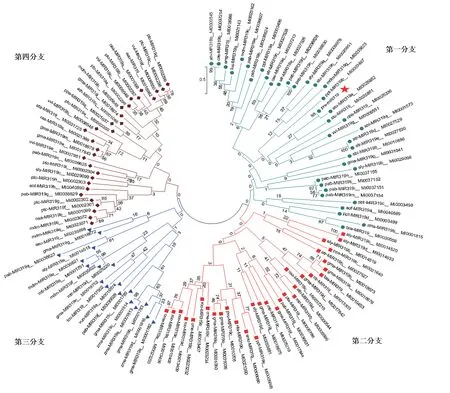
圖4 不同物種MIR319 前體基因系統進化分析Fig.4 Phylogenetic relationship of MIR319 precursor gene sequences for diverse species
2.5 降解組測序鑒定MIR319 家族成員的靶基因
由表3 可知,降解組測序對MIR319 家族成員的靶基因進行鑒定,獲得miR319 及miR319-3p 的4 個靶基因,分別為Cla002428、Cla013523、Cla019567 和Cla023342,均注釋為TCP轉錄因子;獲得miR319a 的2 個靶基因,Cla013523 及Cla013668,其中Cla013523注釋為TCP轉錄因子,Cla013668 注釋為MYB轉錄因子。進一步分析MIR319 對靶基因的剪切位點,發現miR319、miR319a 及miR319-3p 剪切靶基因的位點均位于其成熟序列5′端的第10 位堿基。此外,miR319及miR319a - 3p 剪切靶基因的位點分別位于Cla002428、Cla013523、Cla019567 和Cla023342 的第1 067、 731、1 196 和1 085 位堿基;miR319a 剪切靶基因的位點分別位于Cla013523 及Cla013668 的第732及952 位堿基(表3、圖6)。
2.6 靶基因生物信息學分析
利用ScanProsite 對靶基因編碼蛋白的結構域進行分析,其中 Cla002428、 Cl013523、 Cla019567 和Cla023342 均含有TCP 結構域,其位置分別位于39 ~97、52 ~110、95 ~153 和44 ~102 位氨基酸,而Cla013668 在33 ~85 位及86 ~140 位氨基酸均含有HTH_MYB 結構域(圖7)。ProtParam 對靶基因編碼蛋白的氨基酸數目、相對分子量、理論等電點進行分析,靶基因編碼氨基酸數目為319 ~554 aa、相對分子量為34.94 ~61.21 kDa、理論等電點為5.29 ~7.80。利用WolfPSORT 在線軟件對靶基因進行亞細胞定位預測,其中Cla013523、Cla019567 和Cla013668 定位于細胞核內,Cla002428 和Cla023342 定位于細胞核和細胞質中,TMHMM 預測顯示靶基因編碼的蛋白質均不含有跨膜結構域(表4)。

表3 降解組測序獲得MIR319 家族成員靶基因Table 3 Target gene of MIR319 family member obtained by degradome sequencing
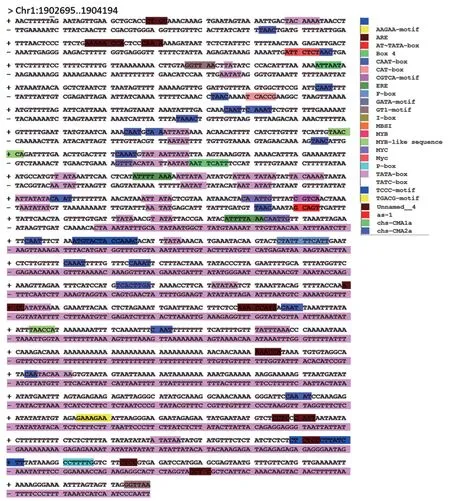
圖5 Pre-MIR319 啟動子區順式作用元件分析Fig.5 Analysis of Pre-MIR319 promoter and its cis-acting regulatory elements

表4 MIR319 靶基因生物信息學分析Table 4 Bioinformatic analysis of MIR319 target genes
2.7 MIR319 靶基因的表達分析
根據CGMMV 侵染前后西瓜葉片的轉錄組測序結果,對MIR319 靶基因的表達進行分析。在CGMMV侵染48 h 后Cla002428(TCP)、Cla023342(TCP)及Cla013668(MYB)呈現上調表達;Cla013523(TCP)及Cla019567(TCP)呈現下調表達。此外,MIR319 所有靶基因在CGMMV 侵染25 d 后均呈現下調表達,其中Cla013523(TCP)及Cla019567(TCP)呈現顯著下調(表5)。根據前期miRNA 高通量測序,MIR319 家族成員(miR319、miR319a 及miR319a-3p)在CGMMV 侵染前后的表達結果(表2),即miR319 及miR319a-3p在CGMMV 侵染25 d 后分別呈現顯著下調及下調表達,而miR319 及miR319a-3p 的靶基因Cla002428(TCP)、 Cla013523 (TCP)、 Cla019567 (TCP) 及Cla023342(TCP)在CGMMV 侵染25 d 后呈現下調表達;miR319a 在CGMMV 侵染25 d 后呈現顯著上調表達,其靶基因Cla013523(TCP)在CGMMV 侵染25 d表現為顯著下調表達,另一個靶基因Cla013668(MYB)在CGMMV 侵染25 d 后表達量無差異。
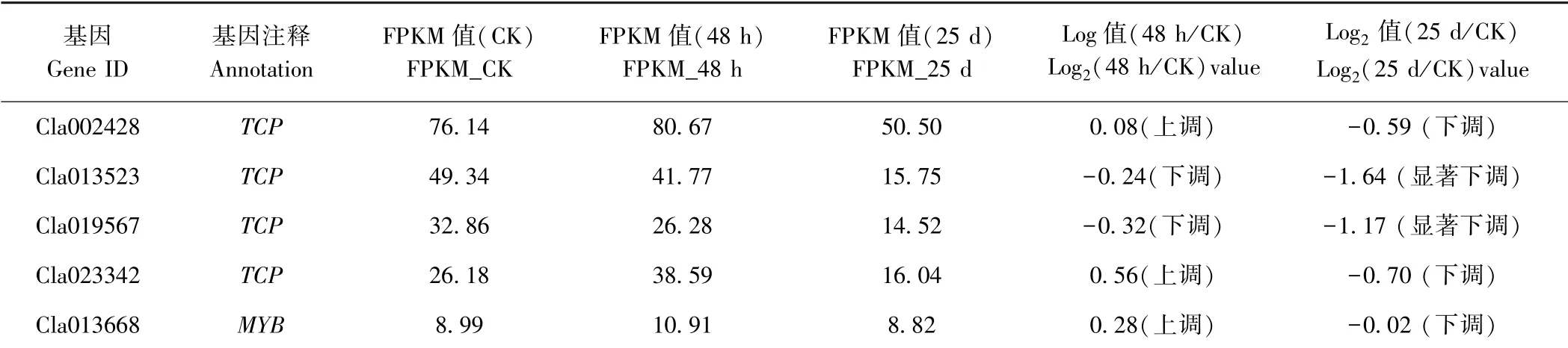
表5 RNA-Seq 分析MIR319 靶基因在CGMMV 不同侵染階段的表達Table 5 Expression of MIR319 target genes during the process of CGMMV infection by RNA-Seq
此外,利用qRT-PCR 對MIR319 靶基因在CGMMV 不同侵染階段的表達進行分析,其中Cla013523(TCP)和Cla019567(TCP)在CGMMV 不同侵染階段的表達模式一致,即與CK 相比,Cla013523(TCP)和Cla019567(TCP)在CGMMV 侵染48 h 和25 d 后呈現持續下調表達;Cla002428(TCP)和Cla023342(TCP)在CGMMV 不同侵染階段的表達模式一致,即與CK 相比,Cla002428(TCP) 和Cla023342(TCP)CGMMV 侵染48 h 后呈現上調表達,在CGMMV 侵染25 d 后呈現下調表達;與CK 相比,Cla013668(MYB)在CGMMV 侵染48 h 和25 d 后呈現上調表達(圖8)。qRT-PCR 結果表明,絕大部分靶基因在CGMMV 不同侵染階段的表達與轉錄組測序一致。上述轉錄組測序結果及qRT-PCR 結果均表明,miR319a 對靶基因Cla013523(TCP)的表達表現為負調控。

圖6 降解組測序鑒定MIR319 剪切靶基因的位點Fig.6 Cleavage sites of target gene predicted by degradome sequencing
3 討論

圖7 ScanProsite 預測MIR319 靶基因編碼蛋白結構域Fig.7 Domain prediction of MIR319 target gene using ScanProsite
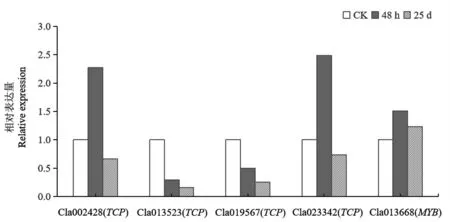
圖8 qRT-PCR 分析MiR319 的靶基因在CGMMV 不同侵染階段的表達Fig.8 Expression analysis of MIR319 target genes during the process of CGMMV infection by qRT-PCR
目前,參與植物對CGMMV 脅迫應答的miRNAs越來越多地被挖掘出來。對接種CGMMV 前后的黃瓜進行miRNAs 高通量測序,獲得多個參與CGMMV 脅迫應答的新的保守的miRNAs 成員[26]。本研究前期通過對CGMMV 侵染前后的西瓜葉片進行miRNAs 高通量測序,獲得一些參與CGMMV 脅迫應答的miRNAs,如miR164b 及miR319[21]。miR164b 通過靶向NAC轉錄因子參與西瓜對CGMMV 的脅迫應答[27]。研究表明,miR319 在植物對生物脅迫應答中發揮重要的作用[17-20]。水稻齒葉矮縮病毒(RRSV)侵染可誘導miR319 的表達,抑制靶基因TCP21 的表達,JA 水平降低,表明RRSV 侵染可誘導miR319 介導的防御機制[19]。因此,進一步對miR319 及靶基因進行相關生物學分析可為揭示miR319 對CGMMV 脅迫應答的分子機制奠定基礎。本研究對鑒定到的西瓜MIR319 前體基因Pre-MIR319 進行序列分析,顯示Pre-MIR319長度為170 bp,可形成穩定的二級發夾結構。西瓜MIR319 成熟序列在5′端第2 ~第14 位堿基具有較高的保守型,可保證MIR319 對靶基因的精確切割。對MIR319 前體序列進行系統進化分析,顯示Pre-MIR319 進化關系與馬鈴薯miR319a 的前體基因(MI0025952)最近。
研究表明miR319 與其他miRNAs 存在相互作用。植物miR159 主要靶向MYB轉錄因子,miR319 主要作用于TCP轉錄因子。研究發現miR319 家族與miR159 家族關系密切,它們的靶基因在21 個核苷酸中有17 個具有共享序列,miR159 和miR319 的功能特化是通過表達差異和序列差異實現的[28]。本研究中西瓜miR319 的2 個靶基因Cla013523 和Cla019567,同時也作為miR159 的靶基因,受到miR159 和miR319的共同調控。除此之外,miR319 與miR172 也存在相互作用,miR319 前體異常的長折疊結構與miR172 的加工有關[29]。
MIR319 和TCP的mRNA 幾乎互補的核苷酸序列構成了基因調控的分子機制[30]。MIR319 單核苷酸突變可降低其靶向5 個TCP基因的能力[13]。本研究中,西瓜MIR319 家族的3 個成員靶向4 個TCP轉錄因子基因,1 個MYB轉錄因子基因,剪切位點在MIR319 家族成員成熟序列5′端第10 位堿基。根據轉錄組測序的結果,僅miR319a 與靶基因Cla013523(TCP)的表達表現為負相關。分析其原因主要是同一個靶基因受不同miRNAs 的調控,如Cla019567(TCP)除受miR319和miR319a-3p 的調控,還受miR159 的調控,調控機制較雜,需進一步研究。
研究發現miR319 的靶基因TCP調控JA 的生物合成及信號轉導過程。RRSV 侵染一方面誘導miR319 的表達,抑制TCP21 的表達,另一方面水稻內源JA 水平降低,表明RRSV 可誘導JA 介導的防御機制,調控水稻對RRSV 的抗性[19]。本研究通過對Pre-MIR319 啟動子區的順式作用元件進行分析,發現其啟動子區含有茉莉酸甲酯響應元件CGTCA-motif 和TGACG-motif,說明西瓜MIR319 也可能通過參與JA介導的防御反應調控西瓜對CGMMV 的脅迫應答。
4 結論
本研究獲得西瓜MIR319 家族3 個成員的前體基因序列,系統進化分析將多個物種的miR319 前體基因分為四個分支。Pre-MIR319 啟動子區含有多個參與植物生長發育及脅迫應答的順式作用元件,降解組測序獲得MIR319 家族3 個成員的5 個靶基因,其中4個為TCP轉錄因子,1 個為MYB轉錄因子。轉錄組測序及qRT-PCR 對MIR319 的靶基因在CGMMV 脅迫下的表達進行分析,miR319a 對靶基因Cla013523(TCP)的表達表現為負調控。本研究明確了MIR319 家族成員及其靶基因對CGMMV 的應答模式,為西瓜CGMMV 抗性基因(因子)獲得及分子機理研究奠定了基礎。

