干細胞在肝損傷治療中的應用與機制
華天楨 馬雨詩 房賀
海軍軍醫大學基礎醫學院1學員四大隊十隊,2學員三大隊七隊(上海200433);3海軍軍醫大學第一附屬醫院燒傷科(上海200433)
肝臟是哺乳動物中最大的具有多種合成和分泌功能的器官,承擔著物質存儲、能量代謝、氨基酸利用、膽汁酸合成與排泄、生物氧化、生物轉化、解毒、免疫應答等重要生理功能。肝臟由肝細胞、肝星狀細胞、竇內皮細胞、庫普弗細胞、免疫細胞等組成。各種致病因素包括病毒感染、毒素、藥物使用、自身免疫缺陷、遺傳疾病和繼發器官功能障礙[1],可損害肝功能,導致慢性肝病或急性肝衰竭。對于嚴重肝損傷或者肝衰竭患者,采取原位肝移植治療仍是目前最有效的方法。據報道,接受原位肝移植的患者5年生存率可達70%以上。然而,由于供體缺乏、手術風險、長期并發癥以及倫理問題,原位肝移植在臨床中的應用受到諸多限制。作為原位肝移植的潛在替代療法,肝細胞移植方法簡單,創傷小且相對安全,近年來在臨床中得到越來越多的應用。然而,肝細胞增殖擴散能力有限、功能相對單一,臨床應用依然存在瓶頸。干細胞具有來源廣泛、自我更新和多向分化潛能的特性,干細胞移植可以幫助嚴重肝損傷或者肝衰竭患者度過危險期,等待肝移植肝源;又可以作為細胞療法直接修復肝臟損傷,應用于臨床治療肝損傷、肝衰竭及各種終末期肝病。本文旨在介紹干細胞的基本類別,闡明干細胞治療多種肝損傷的具體機制,歸納干細胞治療肝損傷的臨床研究與應用,分析干細胞在肝損傷治療中存在的問題。筆者擬通過綜述干細胞在肝損傷治療中的應用與機制研究,結合干細胞在肝損傷治療領域的新應用、新進展,對臨床治療提供新的思路。
1 肝源性干細胞與非肝源性干細胞
干細胞來源廣泛,根據研究需要,目前一般將應用于肝損傷修復的干細胞分為肝源性肝干細胞和非肝源性肝干細胞兩類。肝源性肝干細胞又稱為內源性肝干細胞,主要包括小肝細胞樣前體細胞、肝卵圓細胞等[2]。非肝源性肝干細胞是肝外來源的所有干細胞的總稱,包括胚胎干細胞(embryonic stem cells,ESCs)、間充質干細胞(mesenchymal stem cells,MSCs)、誘導性多能干細胞(induced pluripotent stem cells,iPSCs)、骨髓干細胞等不同種類的干細胞。
肝卵圓細胞是一類細胞核呈卵圓形、比肝細胞體積小、核質比較高的肝前體細胞,可向肝細胞和膽管上皮細胞分化。進行細胞移植時,不易阻塞血管引起肝門靜脈高壓。然而其干細胞特性維持時間短,且易大量增殖破壞肝實質組織,甚至引發肝硬化[3]。
小肝細胞樣前體細胞形態結構與成熟肝細胞相似,但體積較小,只具有向肝細胞的分化的單一潛能。也有研究發現,經過誘導,其同樣具備向卵圓細胞和膽管上皮細胞分化的潛能。然而小肝細胞樣前體細胞作用于肝損傷的機制尚不明了,其治療應用仍需探索[4]。
ESCs 來源于囊胚內細胞團,是具有自我更新和分化全能性的原始細胞,能分化為人體所有組織功能特異性細胞。ESCs 自我復制能力極強,體外培養可維持未分化狀態。ESCs 具有較好的遺傳可操作性,對其進行遺傳改造,可將其誘導為特定肝組織細胞。然而,ESCs在臨床研究中被證明有發生癌變導致畸胎瘤的可能,且其臨床應用存在著倫理問題,因此其相關研究及應用受到了限制[5]。
MSCs 是一類起源于中胚層間充質的干細胞。骨髓MSCs 經肝向誘導后可分化為肝樣細胞,緩解肝臟纖維化。其還可分泌白介素-10 等炎性介質,改善急性肝衰竭的炎癥狀態,是當前被廣泛應用的一類干細胞。除了骨髓來源外,MSCs 還可來源于胎盤、牙髓、臍帶和脂肪等多種組織器官。由于MSCs 細胞膜表面的人類白細胞抗原Ⅰ類分子表達較少,且不表達CD40、B7 受體等T 細胞激活必需的共刺激分子,使得T 細胞不對MSCs 產生免疫反應。同時,MSCs 可在移植后迅速遷移到肝臟,通過旁分泌激活肝祖細胞,促進肝祖細胞分化為肝細胞[6]。MSCs 的安全性高,作用機制研究成熟,是目前肝損傷治療中最常用的干細胞。
iPSCs 是將分化的成體細胞重編程得到的具有胚胎干細胞特性的細胞。iPSCs 有與ESCs 相似的增殖和發育潛能,同時規避了免疫排斥性和ESCs潛在的倫理學爭議。iPSCs可定向分化為肝細胞樣細胞治療肝損傷,具有多元遺傳背景的iPSCs也為疾病模擬和藥物測試提供了平臺[7]。盡管iPSCs 尚且存在肝細胞轉化效率低、功能不成熟等問題,但隨著相關研究的進展,iPSCs 必將在肝損傷修復領域發揮更加關鍵的作用。
除此之外,骨髓中的造血干細胞可分化為肝細胞,也可遷移到肝臟內分泌粒細胞集落刺激因子等生長因子促進肝細胞的生長修復。但其分化產生的肝細胞十分有限,數量僅相當于肝細胞總量的10-4~10-5,難以實現受移植者肝臟的正常更新,故在臨床上的應用較為局限[8]。
綜上所述,肝卵圓細胞和小肝細胞樣前體細胞是應用于肝損傷治療的兩類傳統干細胞,但二者功能單一、副作用大,臨床應用較為局限。ESCs和造血干細胞則具有較為明顯的缺陷,故臨床上一般不用于治療肝臟損傷。iPSCs 和MSCs 是兩類機制明確、治療效果好、副作用小的干細胞,二者勢必將在肝損傷治療中扮演更重要的角色。肝損傷修復的廣泛干細胞來源提示了肝損傷干細胞療法的巨大潛力,但各類干細胞作用均存在一定的局限。探索干細胞的聯合應用方法可能是拓展其治療范圍、增強其治療效力的有效手段。
2 干細胞在各類肝損傷中的應用及潛在機制
2.1 肝臟缺血再灌注損傷肝臟缺血再灌注損傷是引起術后早期肝功能不全或肝衰竭的主要原因,是肝臟外科手術、休克、創傷和器官移植或急性大量失血常見的并發癥。缺血再灌注損傷的發生可能與氧化應激反應、細胞凋亡、鈣通道超載等因素有關。但也有學者認為炎癥反應是引起肝缺血再灌注損傷的關鍵因素[9]。骨髓、臍帶、脂肪等多種不同來源的MSCs 對于肝臟缺血再灌注損傷均具有明顯的治療效果。MSCs 通過減少肝臟內的炎癥水平降低肝細胞損傷,調控炎癥反應參與肝缺血再灌注后肝細胞損傷的修復。又有研究表明MSCs 在炎癥環境內對于中性粒細胞的趨化募集具有一定的抑制作用,提示其可通過減少中性粒細胞在肝臟內的募集從而緩解肝臟缺血再灌注損傷[10]。MSCs 通過降低炎癥反應來減少肝細胞損傷,作用模式較為單一,新的作用機制有待進一步探明。
2.2 酒精/非酒精性脂肪性肝炎酒精性脂肪性肝病是由酒精引起大量肝細胞壞死造成的肝功能損傷狀態。非酒精性脂肪性肝病是非酒精引起的,由“遺傳-環境-代謝應激”導致的以脂質在肝內沉積為主要病理特征的肝病。二者病理機制相似,病情可進展為脂肪性肝炎、肝纖維化,最終引發肝衰竭甚至死亡[11]。MSCs可維持脂肪酸合成酶、乙酰輔酶A 氧化酶等脂質代謝相關酶類的正常水平,減少肝中脂肪的沉積。MSCs 還可促進肝臟血紅素加氧酶的表達以降低炎癥介質如白細胞介質-6 和單核細胞趨化因子-1 的表達,緩解肝臟炎癥反應,并抑制Toll 樣受體-4/核轉錄因子-κB 炎癥通路及肝臟氧化應激進而修復肝功能損傷。同時,MSCs可向炎癥部位遷移,通過激活CD4+輔助性T 細胞-2 和CD4+調節性T 細胞來抑制CD8+細胞毒性T細胞的活性,調節免疫反應。MSCs被證實可直接定向歸巢至受損傷的肝臟組織,通過旁分泌效應分泌肝細胞生長因子和血管內皮生長因子等細胞因子抑制肝實質細胞凋亡,為受損組織提供營養支持,誘導局部肝前體細胞的增殖和分化并通過改變微環境來刺激血管生成和肝組織再生[12]。代謝通路調節、炎癥反應調控、微環境再建是干細胞治療肝炎的三種明確作用機制。
2.3 肝纖維化和肝硬化肝炎病毒、酒精、免疫反應等致病因子持續損傷肝臟,導致肝細胞損傷、內皮屏障受損、炎癥細胞和肝星狀細胞活化以及氧化應激和成纖維細胞細胞外基質沉積,最終導致肝纖維化的發生[13]。肝纖維化一旦發展為肝硬化,就無法通過有效的方法治療。因此,應在肝纖維化階段給予積極治療。MSCs 可通過免疫反應調節和分泌外泌體等途徑調節肝纖維化進程。MSCs通過抑制IFN-γ+、CD4+、IL-6+等淋巴細胞的增長,促進M2 型巨噬細胞的活化和基質金屬蛋白酶-13的分泌來限制肝星狀細胞活化,進而減緩肝纖維化進程。iPSCs 衍生的外泌體可用于減輕肝組織壞死程度,減弱氧化應激來保護肝臟。在抗凋亡能力方面,經血干細胞來源外泌體可以表達白細胞介素6、白細胞介素8、血管生成素等細胞因子改善肝功能。研究表明,臍帶間充質干細胞衍生的外泌體在對抗丙型肝炎病毒時表現出有效的抗病毒活性,其所釋放的一系列miRNA 如miR-145、miR-199a 和miR-221 等可以顯著抑制丙型肝炎病毒的RNA 復制。成人肝干細胞的外泌體使肝臟細胞表面的纖維囊減少,肝組織結構軟化,肝臟炎癥及膠原沉積減輕,能有效改善肝臟的纖維化程度[14]。
2.4 氧化應激損傷肝臟代謝極其活躍,耗氧量大,產生的氧自由基較多,在肝內積聚,造成肝臟氧化應激損傷。肝細胞的氧化應激反應導致脂質過氧化產物MDA 和DNA 過氧化產物8-OHdG 等有毒的過氧化物增加和抗氧化劑谷胱甘肽下降,破壞強氧化劑和抗氧化劑之間的平衡,進而激活p38-MAPK 通路,啟動下游凋亡相關通路,導致細胞凋亡。人臍帶間質干細胞來源的外泌體將其包裹的谷胱甘肽過氧化物酶1 等活性成分轉移進入靶細胞,減輕了氧化應激時產生的過氧化產物對細胞的進一步損傷,提高了肝細胞的抗氧化能力。同時人臍帶間質干細胞來源的外泌體能夠抑制P38分子磷酸化從而抑制P38-MAPK 通路的活化,避免了肝損傷的進展[15]。
2.5 藥物性肝損傷藥物性肝損傷是指由各類化學藥物、生物制劑及其代謝產物等所造成的肝損傷,可導致急性肝衰竭的發生。藥物進入肝細胞后與組織蛋白結合轉化為抗原,激活免疫系統造成肝臟損傷。藥物對肝臟的損傷機制包括誘導細胞死亡、代謝介導的反應性代謝物形成、介導免疫反應和造成線粒體功能障礙。MSCs 通過旁分泌生物活性因子作用于鄰近細胞來治療肝損傷。MSCs 來源的外泌體上調肝臟再生過程中啟動期相關基因,并通過增加Bcl-xL 蛋白表達來抑制肝細胞凋亡,抵抗毒物誘導的損傷[16]。本課題組研究發現[17],連接黏附因子A(junction adhesion molecule A,JAM-A)可以促進MSCs 定向歸巢并發揮細胞因子分泌功能,并證實其在促進創面皮膚愈合上的作用。通過前期實驗也已經證明,JAM-A 可促進MSCs 向脂多糖誘導肝損傷部位定向遷移,提示了MSCs 治療藥物性肝損傷的一種潛在機制。同時,MSCs 來源外泌體的非細胞系統避免了肝細胞移植組織不相容的風險,安全有效。
3 干細胞治療肝損傷的臨床研究與應用
目前應用于肝損傷治療的多為自體骨髓干細胞或組織相容性骨髓干細胞。但骨髓干細胞的獲取方式侵入性高,對機體損傷較大,且干細胞數量和分化潛力隨年齡增長下降。MSCs 是目前治療肝損傷機制最為成熟、應用最為廣泛的干細胞。MSCs 具有較低的免疫原性,且易提取,易培養增殖。MSCs 可從外周血、臍帶血、脂肪等多種來源獲取。臍帶血來源的MSCs,容易獲取,可供人終生受用。脂肪來源的MSCs 增殖能力強,組織豐度高,通過抽脂法即可分離[18]。iPSCs 具有很強的全能性,可分化為肝細胞樣細胞,為肝損傷提供了新的細胞療法。然而,iPSCs 分化的肝細胞樣細胞功能活性較低,僅為原代肝細胞的0.3% ~10.0%[19]。盡管動物實驗效果良好,iPSC 的致瘤性等問題仍阻礙了其在臨床上的相關應用。
干細胞分泌的外泌體不僅可以有效治療肝病,也是肝病診斷和預后監測的分子生物標志。來自成人肝干細胞的外泌體可釋放具有抗腫瘤作用的miRNAs,并能誘導肝細胞增殖。脂肪間充質干細胞來源的外泌體可將miR-122 轉移到肝星狀細胞并調控其增殖,從而緩解肝纖維化進程。骨髓間充質干細胞來源的外泌體抑制細胞周期進程并誘導Hep-G2 細胞凋亡,抑制了肝癌的進展。另外,外泌體包含的miRNA 還可以作為疾病發生和發展的分子生物學標志物用于疾病治療的監測。
干細胞來源的肝細胞可應用于模擬人藥物性肝損傷。使用干細胞技術產生人肝細胞可提高藥物誘導肝損傷的可預測性,并用于篩查藥物對人體的不良反應。這是利用干細胞來源的體細胞對不同遺傳背景的人類藥物進行修飾和提高藥物開發效率的重要一步。可再生細胞群如ESCs 和iPSCs 等都被證明可以通過自發或定向分化的方式向肝細胞分化,在預測人類藥物性肝損傷方面表現出很高的準確性,為藥物的毒性模擬評估和臨床試驗提供了細胞學依據[20]。相關臨床研究見表1。
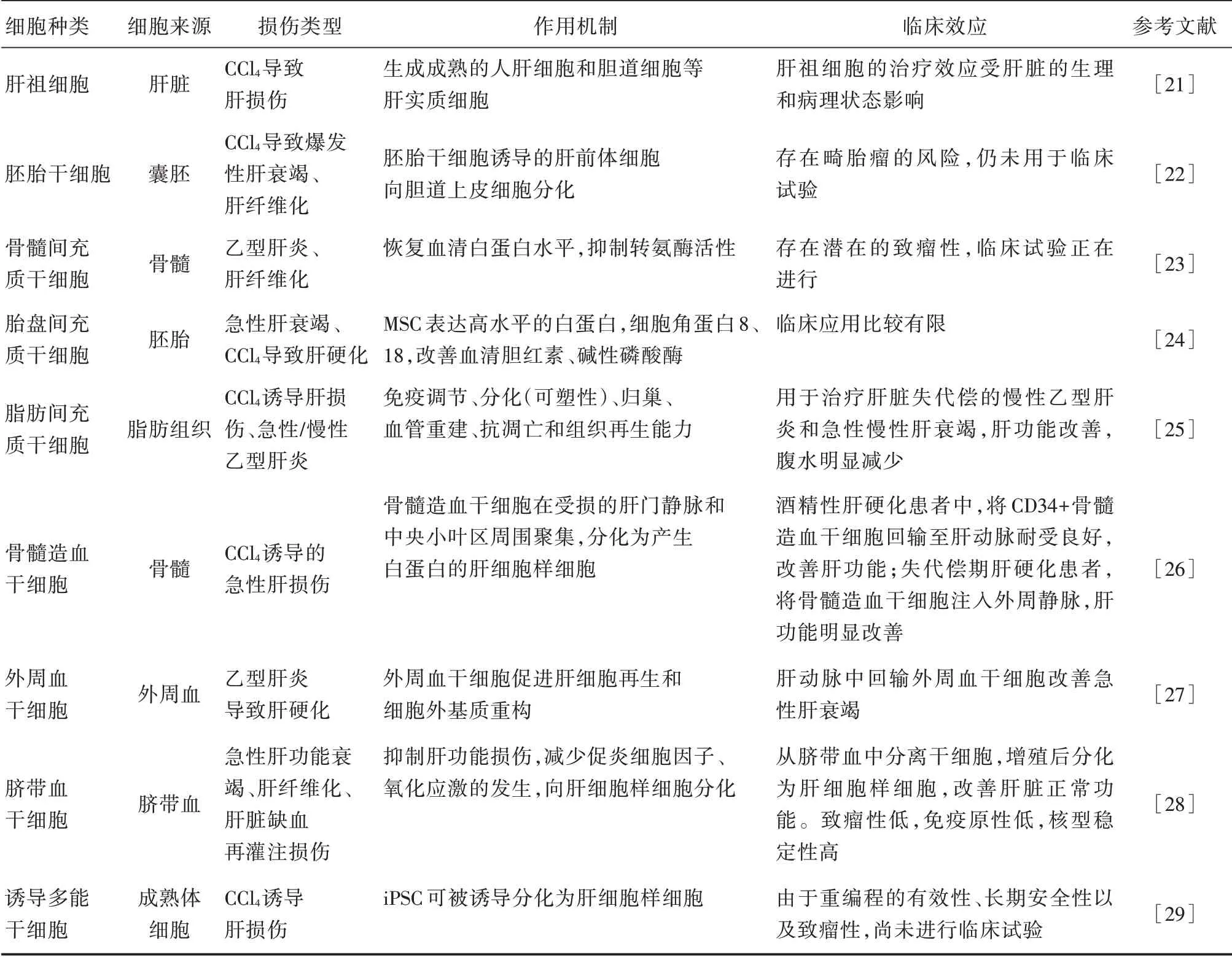
表1 干細胞治療肝損傷的臨床研究Tab.1 Clinical study on stem cell therapy for liver injury
4 存在問題與展望
目前應用于肝損傷治療的多為成體干細胞,且來源大多局限于MSCs 和其來源的外泌體。其他來源的干細胞及其損傷修復的機制與應用有待進一步完善。同時,長期來看,干細胞移植后,若其在體內的生長增殖失控,則會發生成瘤風險。自體干細胞的使用不受倫理學制約,但胚胎干細胞和克隆技術等的應用涉及到一系列社會倫理學問題。同時,臨床上干細胞的應用尚無統一的安全評價機制,其應用的流程規范和應用療效的評估標準也有待完善。
除了干細胞的直接應用,干細胞與基因工程學、細胞工程學及肝再生醫學等的結合為干細胞治療肝損傷提供了新的思路。目前臨床上已經將來自自體的成體干細胞分離富集后直接進行移植,用于代替肝移植治療肝損傷,同時避免倫理爭端。應用基因工程學技術,對移植干細胞的基因進行修飾,賦予干細胞新功能,又避免了免疫排斥問題,從基因層面治療肝損傷。此外,肝組織工程技術有望替代肝移植或肝靶向基因治療,有效治療遺傳性肝病。由人誘導全能干細胞產生的類肝細胞是肝組織工程的細胞來源,可用于肝病的治療和藥物研究。在肝再生醫學中,干細胞構建的生物人工肝支持系統可有效幫助終末期肝病患者,提高其生存率[30]。
綜上所述,不同來源的干細胞廣泛應用于多種肝損傷的治療。干細胞治療肝損傷的作用機制為進一步的基礎研究提供了新思路。在肝病的臨床治療上,干細胞的功能有待進一步發掘與完善。干細胞治療與工程學、再生醫學相關方法的結合,顯示出干細胞在臨床應用上的巨大潛力,是肝損傷的干細胞療法未來的發展方向。

