Na 離子電池正極材料的結構設計與性能分析
劉旭燕 謝繼輝 曾攀 高博涵 黃章 陳文惠
摘要: Na 離子電池由于其低成本和豐富的 Na 資源儲備,已成為電能存儲和低速電動汽車中最有前途的候選設備。正極材料是 Na 離子電池的關鍵,對電化學性能具有顯著影響。系統地總結了現有的 Na 離子電池正極材料,有過渡金屬氧化物類、聚陰離子類、普魯士藍類和有機分子聚合物類等材料。目前,這些正極材料存在兩個缺點: Na 離子的半徑比 Li 離子的大,在離子脫嵌過程中會對材料的結構造成嚴重影響,進而導致體積膨脹和容量衰減;動態過程緩慢,導致充放電倍率表現不佳。總結了用以提高正極材料電化學性能的摻雜/替代和涂覆等改性方法,為以后的 Na 離子電池改性和正極材料的選擇提供了研究方向。
關鍵詞: Na 離子電池;正極材料;電化學性能;改性
中圖分類號: TQ 131;TM 912???? 文獻標志碼: A
Structure Design and Performance Analysis of Cathode Materials for Sodium Ion Batteries
LIU Xuyan, XIE Jihui, ZENG Pan, GAO Bohan, HUANG Zhang, CHEN Wenhui
(School ofMechanical Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China)
Abstract: The sodium ion battery has become the most promising candidate device for electric energy storage and low-speed electric vehicles because of its low cost and abundant Na resource reserve. Cathode materials are the key of sodium ion battery and have a significant impact on the electrochemical performance. The existing cathode materials for sodium ion battery were systematically summarized, including? transition? metal? oxide? materials,? polyanionic? materials,? Prussian? blue? materials,? organic molecular polymers, and so on. At present, these cathode materials have two disadvantages: the radius of sodium ion is larger than that of lithium ion, which seriously affects the structures of materials in the ion deintercalation process, and then causes the volume expansion and capacity attenuation; the dynamic process is slow, resulting in poor performance of charge discharge ratio. The modification methods such as doping/substitution and coating to improve the electrochemical properties of cathode materials were also summarized, which provides a research direction for the modification of sodium ion battery and the selection of cathode materials in the future.
Keywords: sodium ion battery; cathode material ; electrochemical performance ; modification
Na 和 Li 屬于元素周期表里同一族元素,有著類似的屬性和性能,組裝成電池時,充放電原理也基本相同。和 Li 不同, Na 有著豐富的資源,質量分數約占地表元素儲量的2.64%,且價格便宜,分布廣泛。但是, Na 離子的相對分子質量較大,離子半徑(0.106 nm)比 Li 離子的(0.076 nm)大。并且, Na/Na+比 Li/Li+電對的電極電勢高出約0.3 V,這可能會使得 Na 離子電池的能量密度低于 Li離子電池的。綜上所述,尋找適合的電極材料來解決這些缺點,是 Na 離子電池技術的關鍵[1-3]。
1 聚陰離子
聚陰離子化合物通常可以表示為AxBy[(DOm)n]z,其中, A 為 Li 或 Na;B 為補充元素; D 為 P、S、V 和 Si 等元素。由于 D 多面體中存在氧原子的強共價鍵作用,所以,聚陰離子化合物具有良好的結構穩定性和熱穩定性。并且,有著3.3 V 的高工作電勢和相對穩定的化學共價鍵,但由于其電子動力學低,因此,在高電流密度下的電化學性能較差[4]。大量研究表明,摻雜有導電碳涂層或導電填料的聚陰離子材料可以增強其導電性。
1.1 合成方法
1.1.1噴霧干燥法
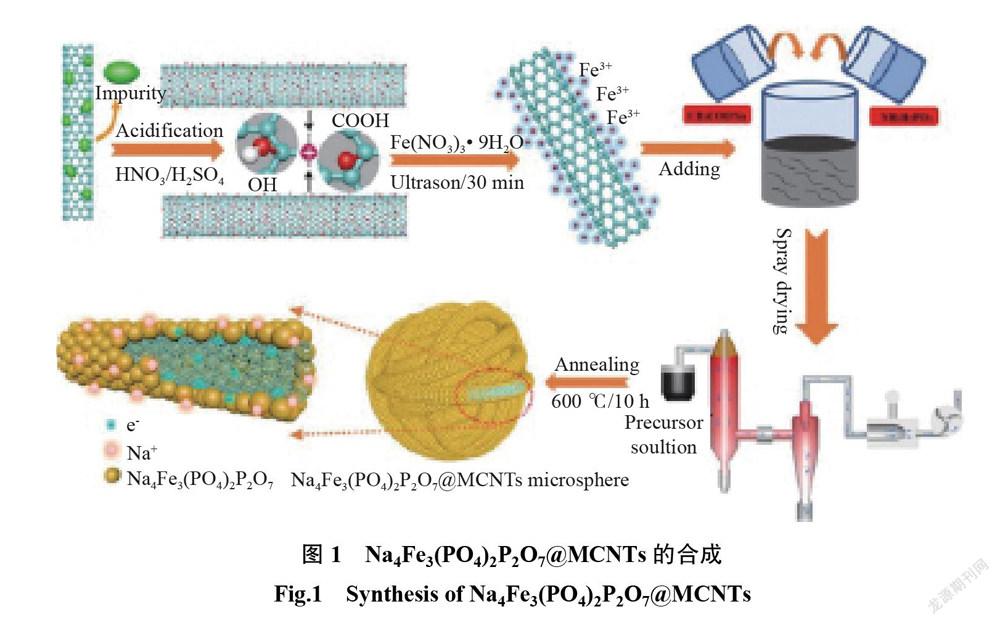
在材料合成中,噴霧干燥法是合成細粉的重要方法。用噴霧干燥法合成的聚陰離子材料具有小的粒徑,并且外形呈現球狀,很少附聚。用噴霧干燥法制備的材料具有比表面積大,粒徑小,純度高等特點。Cao 等[5]首先通過酸化法對多壁碳納米管(multiwalled carbon nanotubes, MCNTs)的表面進行預處理,如圖? 1所示,將簡單的噴霧干燥法與固相反應法相結合,制備了 Na4Fe3(PO4)2P2O7@MCNTs(記為 NFPP@MCNTs)。因為噴霧干燥法可以使材料具有較小的球形顆粒尺寸,使得電極材料均勻地分布在 MCNTs 的周圍。
1.1.2水熱合成法
水熱合成法是合成大多數電極材料的常用方法。將反應原料制備成溶液,封裝在水熱反應器中加熱至一定溫度。水熱反應器確保合成系統的壓力在適當的范圍內。并且在合成系統中,液體之間的反應隨溫度的升高而加劇。 Zhang 等[6] 通過水熱合成法成制備雙摻雜碳包覆納米球 Na3V(PO4)2O2F(記為 NVPOF@P/N/C)材料。由于出色的水熱合成工藝, NVPOF@P/N/C材料可以很好地結合 N/P雙摻雜碳涂層而很少產生雜質。
1.2 結構
聚陰離子主要包括 Na 離子超導體(Nasicon)型Nax(PO4)y、焦磷酸鹽(Na2MP2O7,其中, M 為 Fe、Mn)和硫酸鹽[Na2Mx(SO4)3,其中, M 為 Fe、Mn、Mg],結構主要為隧道型和橄欖石型。
1.2.1橄欖石型
橄欖石型結構的主要代表就是 NaFePO4斜方晶體結構,可以為 Na 離子提供良好的去離子通道。由于離子半徑的差異以及 Na 離子和 Fe 離子之間的電荷不同,兩個晶體學上不同的八面體結構(八面體 FeO6和八面體 NaO6)位于橄欖石型結構的 NaFePO4相中。磷酸鹽離子(PO4的四面體)與每個八面體的 FeO6共享一個側面和4個角,形成橄欖石型 NaFePO4的主要骨架。為了研究橄欖石型結構材料的功率密度,Nakayama 等[7]分別合成了 LiFePO4和 NaFePO4,并通過第一原理密度泛函理論研究了它們的離子和電子傳輸特性。密度泛函理論數據表明,就電子遷移能而言,兩者之間沒有觀察到顯著差異。但是, NaFePO4中 Na 離子的遷移能比 LiFePO4中 Li離子的遷移能高0.05 eV。以上研究表明,橄欖石型結構材料的離子遷移機制可能是影響其功率密度的主要原因。
1.2.2隧道型結構
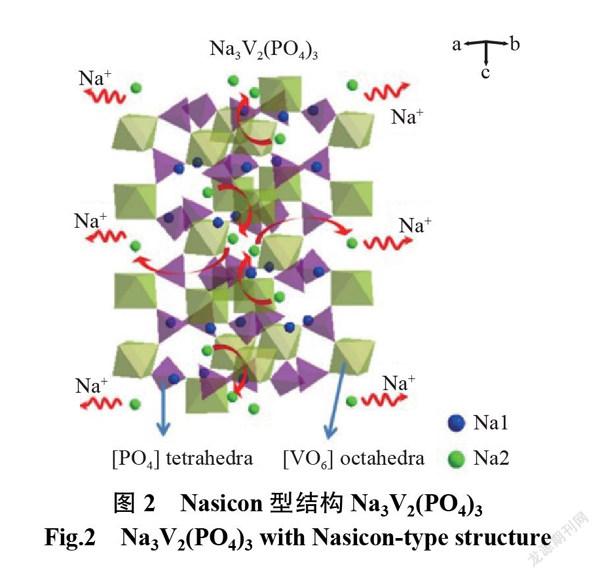
Nasicon是 Na 離子超導體材料,具有三維開放框架結構和相應的快速離子傳輸速率。 Na3V2(PO4)3是一種典型的具有Nasicon結構的化合物。如圖2所示, Na3V2(PO4)3的每個 VO6?八面體和6個 PO4?四面體呈角組合,其中, Na 離子分別占據六面體和八面體的頂點位置[8-9]。
1988年,Delmas 等[10]研究了 Li 離子和 Na 離子在 LiTi2(PO4)3和 NaTi2(PO4)3材料中的插入,發現其具有明顯的結構穩定性和快速的離子傳導性,使隧道型材料被廣泛用作堿性離子的理想插入物。
1.3 摻雜改性
1.3.1氟化
聚陰離子材料的氟化是一種常見的改性方法。帶負電荷的氟離子的添加可以使 Na 基磷酸酯的主要結構和組成發生某些變化,并生成氟代磷酸酯。氟化物可以部分替代其中的氧,形成更穩定的金屬-氟鍵,從而減少充放電過程中材料的體積變化。同時,氟化物的引入可以改變材料的電子分布,提高電極的電導率,增強材料的增殖性能[11]。Barker 等[12]研究了氟磷酸鹽作為 Na 離子電池的電極材料,發現這種結構有著穩定的金屬-氟鍵,還發現氟磷酸鹽具有良好的插入可逆性和較高的放電電勢(約3.7 V)。
1.3.2混合離子摻雜
聚陰離子化合物可以使用混合陰離子進行摻雜。多種離子的摻雜,可以使材料構建新的結構體系,這往往可以獲得更好的電化學性能。Padhi等[13-14]研究了 Li 離子電池材料中的混合聚陰離子體系,它是指由兩種不同的陰離子組成的化合物。 Deng 等[15]嘗試了將混合的聚陰離子材料應用于 Na 離子電池中,例如,將混合的聚陰離子 PO43–和 P2O74–引入 V4+/V3+的氧化還原對中,并通過熔融鹽輔助方法成功制成了具有一維納米結構的 Na7V4(P2O7)4(PO4)材料。由于混合聚陰離子的多相感應作用和獨特的納米棒結構, Na 離子的擴散和電子轉移可以快速進行,這有利于材料的高倍率能力和循環穩定性。
1.3.3碳摻雜
碳基復合材料是許多電極材料的一種改性方法。盡管 Na3V2(PO4)2F3(記為 NVPF)具有良好的電化學性能,但是仍然存在電導率低的問題。Gu 等[16]把瓊脂糖作為碳涂層前驅體成功地制備了先進的 Na3V2(PO4)2F3@C(記為 NVPF@C)陰極材料。碳涂層不僅增強了基于 NVPF 的陰極的電子導電性,而且抑制了缺陷的生長,從而縮短了 Na 離子傳輸路徑。
2 過渡金屬氧化物摻雜
過渡金屬氧化物具有良好的平均工作電勢、高電子容量和易于合成的特性,已成為最受歡迎的正極材料之一。過渡金屬氧化物可以用NaxMeO表示:其中 Me 為過渡金屬,包括 Mn、Fe、Ni、Co、V、 Cu、Cr 和其他元素中的一種或多種; x 為物質的量,范圍為0~1。然而,由于明顯的體積膨脹問題,大多數過渡金屬氧化物的空氣穩定性差。大氣中的水和碳酸根離子不斷插入MeO分層空間中,會破壞其電化學性能。研究表明,材料的層間距和 Na 離子含量是影響空氣穩定性的主要因素。人們還經常使用金屬元素摻雜、結構重新設計、表面涂層來改善此問題。
2.1 合成方法
2.1.1 固相法
固相法是僅固體物質參與反應的合成方法,具有選擇性高、收率高、工藝簡單和反應條件易于控制等優點,因此,固相法非常適合批量生產。高溫固相法通常包括兩步處理過程:(1)通過球磨將不同比例的原料均勻混合,然后在低溫下進行加熱;(2)冷卻樣品后,將其再次球磨,然后在高溫下烘烤。可以根據材料的特性選擇是否添加惰性氣體進行保護[17]。固相法廣泛用于 Li 離子電池和 Na 離子電池的制備。固相法減少了顆粒的擴散,并促進了電解質離子向電極內的運動。 Bao等[18]通過固相法和共沉淀法制備了具有 P2結構的球形 Na2/3Ni1/6Co1/6Mn2/3O2。盡管固相法可以使材料形成穩定的骨架,但也使材料的電導率和空氣穩定性非常差。為了解決該問題,使用濕化學法將納米級 ZrO2涂覆在塊狀材料上以進行改性。
2.1.2共沉淀法
共沉淀法是合成過渡金屬氧化物的常用方法,具有操作簡單、時間短和成本低等優點。通過金屬鹽熔液與沉淀劑的快速反應得到的固體沉淀物體積小、粒徑均勻。 Zhang 等[19]采用一鍋共沉淀法合成了具有分層介孔微球結構的 Li4?x/3Ti5?2x/3CrxO12。Xie等[20]采用共沉淀法結合煅燒工藝合成了 Na1+x(Fey/2Niy/2Mn1?y)1?xO2(x=0.1~0.5)。共沉淀法用于制備具有不同成分的 Fe、Ni、Mn 材料。當 x=0.4時,該材料顯示出99 mA ·h/g 的良好容量(在1.5~4.0 V 下循環),并且在第50個循環中的容量保持率超過87%。
2.2 結構
層狀 Na2O 的晶體結構類似于 Li 離子電池中的 LiMO2的晶體結構,具有共同邊緣的 MO6?規則八面體形成層, Na 離子均勻地分布在各層之間[21]。根據材料的結構,過渡金屬氧化物可分為層狀氧化物和隧道氧化物。
2.2.1層狀結構
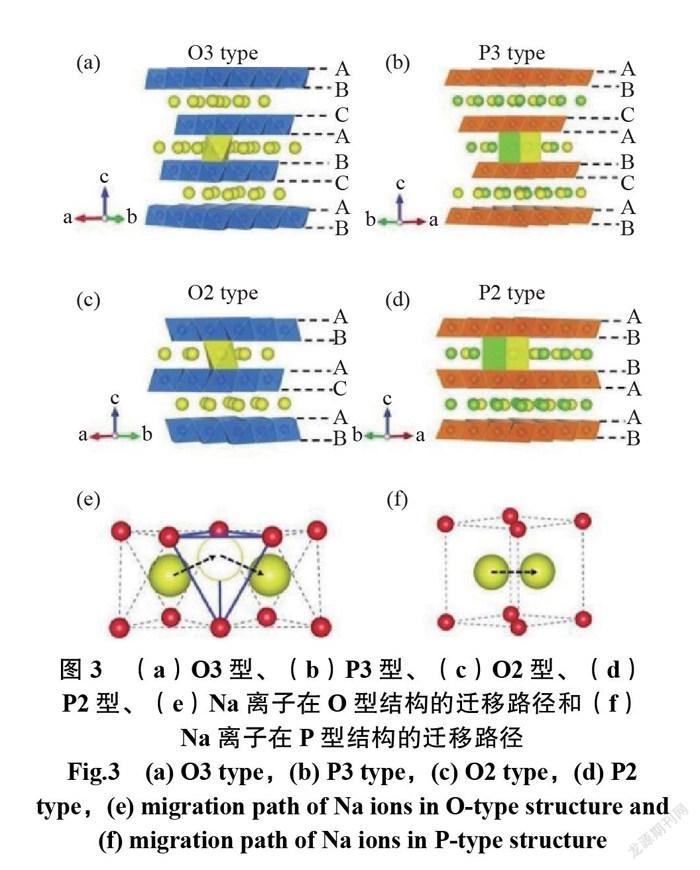
當 Na 離子的物質的量 x>0.5時,通常是層狀結構,主要由 MeO6八面體組成,這些八面體由共邊緣片材堆疊而成,并且 Na 離子位于各層之間,以形成 MeO6層和 Na 層交替的分層結構。如圖3所示,晶體結構中的 Na 離子和 MeO6八面體以 O 型邊緣共享方式連接,以 P 型正面連接。根據 O2層的堆疊順序[P2:ABBA 堆疊; O2:ABAC(或 ABCB)堆疊; P3:ABBCCA 堆疊和 O3:ABCABC],層狀材料可進一步分為 P2、O2、P3和 O3堆疊類型。大寫字母表示 Na 離子所在的配位多面體(O:八面體; P:三棱柱),數字表示 O 的最小重復單元的堆積層[22-23]。
2.2.2隧道結構
當 Na 離子的物質的量 x 在0~0.44時,該材料具有三維隧道結構,例如,基于 Mn 離子的材料 NaxMnO2。在隧道結構中,角共享八面體(MnO6)和側角共享(MnO5)方錐相互連接,以形成具有兩個通道的隧道結構,即大 S 形隧道和小 S 形隧道。如圖4所示,該三維結構包含5個不同的 Mn 離子占據點,其中 Mn1~Mn4位于八面體結構的一個位置,而 Mn5位于金字塔的角點。 Na 離子在結構中還占據3個不同的位置,其中 Na3和 Na2占據大S 形隧道的一半,Na1位于小 S 形隧道(完全充滿)中。
Gao 等[24]采用“堿化和煅燒”法,在泡沫鎳上合成了帶有納米隧道的 NaxMnO2來研究 Na 離子的存儲性能。 Shi 等[25]在研究層隧道雜化結構時,首次向其中引入了氟離子,并研究了氟陰離子摻雜對隧道型 Na0.44MnO2材料電化學性能和結構的影響。
2.3 摻雜改性
2.3.1元素摻雜/替代
Na 離子電池中常見的摻雜元素,例如 Mg、Al、 Fe、Ni、Cu、Ti和 F,通常用于減小層之間的距離,改善相鄰金屬之間的耦合并創建有序的層間結構;也可以抑制有害相變并在很大程度上穩定結構,從而大大提高了電池空氣穩定性和電化學性。
(1)Mn 離子摻雜
Mn 離子摻雜可使 Na 氧化物具有更大的平均氧化態和晶格空間,從而促進 Na 離子的擴散,提高 Na 離子電池的理論容量和循環穩定性,但 Mn 離子會帶來不利的 Jahn-Teller 效應。如何更好地處理Jahn-Teller 效應是 Mn 離子摻雜的研究重點。 Liu 等[26]系統地研究了 Na0.67MxMn1-xO2的電化學性質以及長距離結構與局部環境的相關性,包括 Mn 離子的平均價和結構畸變。深入討論了摻雜對 Mn 離子平均價、結構畸變程度和電化學性能的影響。2018年, Chen 等[27]使用摻雜的 Cu 離子來抑制由 Mn3+離子引起的不良的 Jahn-Teller 效應,而且可以改善充放電過程中的 Na 離子空位序列過渡,并有助于提高可逆容量。
(2)Al 離子摻雜
Al 離子摻雜對 Mn 和 Fe 材料的結構和電化學性能具有重要影響。在 Na0.67Mn0.5Fe0.5O2中添加 Al 離子,不僅增加了離子距離和 Na-O 鍵的長度,而且有利于 Na 離子的傳輸,提高了結構中層狀膜的穩定性。 Al 離子摻雜還可以改善由 Mn3+離子引起的 Jahn-Teller 效應,從而增強層狀結構的穩定性和循環性能。 Pang 等[28]合成了 Al 離子摻雜的 P2型Na2/3Mn8/9Al1/9O2材料。因為它有效地抑制了 Mn3+離子的 Jahn-Teller 效應,所以其電化學性能得到了極大的提高。 Wang 等[29]在上述研究的基礎上,進一步研究了不同 Al 離子摻雜濃度的效果,系統地研究了 Al 離子摻雜對 Mn 和 Fe 氧化物的化學鍵、層狀結構、電化學特性和循環性能的影響。
2.3.2表面涂層
表面涂層用于改善電池正極并增強其空氣穩定性和循環性,表面涂層主要包括聚合物涂層、無機涂層和碳涂層。這些用于物理保護的涂層不僅可以避免潮濕空氣的直接侵蝕,還可以減少電極與有機電解質之間的有害副反應。但是,它不能改善層狀材料的相變,充放電過程中,正極材料的體積變化可能會損壞一部分涂層。 Lu 等[30]用多孔微晶合成了 Na0.91MnO2,然后用聚吡咯(polypyrrole, PPy)包覆。材料中較高的 Na 離子含量會導致結構中的層間距更寬,聚吡咯可有效保護電極不被電解液和空氣侵蝕,還可以增加材料的導電性能。
3 普魯士藍類
普魯士藍因其堿金屬離子存儲機制而被廣泛用作 Na 離子電池的正極材料。它可以分為兩類:可溶的普魯士藍QFeFe(CN)6和不溶的普魯士藍 Fe4[Fe(CN)6]3。化學式為KxMA[MB(CN)6]n ·H2O(堿金屬離子 Q 為 Na、Ni 和 Li 等, MA 和 MB 為過渡金屬離子,如 Cu2+和 Fe2+)。過渡金屬離子在氰化物自由基中與 C 和 N形成六邊形,堿金屬離子在三維通道結構和配位孔中[31]。大型的三維多通道結構可以實現堿金屬離子的插入和剝離,由于其開放的骨架和較大的間隙位,可以輕松地適應氧化還原反應中的陽離子補償。同時,通過選擇不同的過渡金屬離子,如 Ni2+、Cu2+、Fe2+、Mn2+和 Co2+等,可以獲得豐富的結構體系,表現出不同的 Na 離子儲藏特性。由于配位水的缺陷,傳統的普魯士藍材料循環穩定性差,且庫侖效率低;電極的體積膨脹以及與電解質的接觸也會影響這種材料的應用[32]。
3.1 合成方法
3.1.1共沉淀法
共沉淀法包括將沉淀劑添加到金屬鹽熔液中的正向添加法和與之相反的反向添加法,不僅可以制得粒徑小且均勻的產物,而且具有操作簡單、反應溫度低、時間短和成本低等優點。然而,通過共沉淀法合成的傳統普魯士藍材料 Fe4[Fe(CN)6]3由于存在配位水,其電化學性能較差。 Chen 等[33]研究了普魯士藍材料的成核速率對其性能的影響,快速沉淀可能會導致材料中出現大量的空位和配位水。為了降低材料的合成速率,在共沉淀法的基礎上添加了檸檬酸鹽以控制合成的成核速率,并生成了 Na2NixMnyFe(CN)6(S-PBMN)。研究發現,氰化物離子與檸檬酸鹽之間的競爭性反應降低了成核速率,因此,在添加檸檬酸鈉后,材料的結構變得規整。與上述試樣不同的是, Chen 等[34]也研究了普魯士藍的合成速率對材料的影響。如圖 5所示,在沉淀法的基礎上加入了聚乙烯吡咯烷酮作為表面活性劑,來降低材料沉淀速率和晶體成核的配位過程。
3.1.2水熱合成法
普魯士藍材料常見的合成方法是水熱合成法,可以代替高溫固相反應。由于水熱反應材料的成核機制與其他反應不同,該方法可以合成新化合物,這是其他方法無法比擬的。 Wang 等[35]研究了普魯士藍材料水熱反應中的離子交換問題。在水熱過程中,將 Cu2+離子引入普魯士藍前驅體,成功合成了 Na2CuFe(CN)(命名為 EX-PBCF)。Fu 等[36]研究了水熱合成法中不同溫度對普魯士藍材料合成的影響。不同的合成溫度會影響所制備的普魯士藍材料的化學成分以及普魯士藍晶格中沸石水分子的含量。結果發現,含有沸石水分子的樣品表現出更好的速率性能和循環穩定性。
3.1.3原位復合法
在上述制備方法的基礎上,通過原位材料的復合可以進一步提高材料的電化學性能。反應前,向反應溶液中加入一定量的Ketjen Black 材料,并通過超聲處理使其均勻分散,反應得到原位復合普魯士藍正極材料。 Luo 等[37]首先通過原位復合并添加石墨烯輥(graphene roller, GRs)包裹的方法制備出 Fe-HCF 納米球,使 Fe-HCFNSs @GRs 具有良好的一維管狀層狀結構。
3.2 結構
普魯士藍類似物如CuNiHCF具有面心立方結構,其中,八面體過渡金屬六氰化物和6倍氮過渡金屬形成開放骨架。水合的堿性離子或沸石水可能會占據框架中的“A 位置”間隙。因此,該材料可以用AxMy[N(CN)6]z ·nH2O 表示,其中 M 和 N 是過渡金屬離子,例如 Fe 和 Mn;A 是堿金屬離子,例如 Na 和 Li。在電化學循環過程中,堿性離子將被插入或從 A位置移出, M 或 N 離子的化合價將相應地發生變化。
3.3 摻雜改性
3.3.1富 Na
普魯士藍材料中的 Na 離子含量增加,可以減少空位數量和間隙水含量。 Na 離子還可以促進普魯士藍的納米結晶,從而縮短 Na 離子的傳輸路徑。普魯士藍及其類似物是有前途的富 Na 離子正極材料,因為它們在理論上每個配方單位可存儲兩個 Na 離子。然而,由于六氰合鐵酸鹽中的 Na 離子儲存機制尚不清楚,因此,增加普魯士藍正極材料中的 Na 離子含量仍然是主要挑戰。 You 等[38]第一次通過控制合成過程中的還原劑和反應環境,成功地制備了高 Na 離子含量的六氰合鐵酸鐵鈉,每種配方中的 Na 離子的物質的量可高達1.63。通過原位拉曼光譜和 X射線光譜,系統地研究了 Na 離子的嵌入/脫嵌機制。富含 Na 離子的六氰合鐵酸鐵鈉可作為大量的 Na 離子的儲存劑。這種有著高 Na 含量的六氰合鐵酸鈉鐵具有高的比容量(150 mA ·h/g)和良好的循環性能(在200次循環后的容量保持率為90%)。與上述的富 Na 策略不同, Chen 等[39] 以 NaCl 為 Na 源,研究了亞鐵氰化鈉材料[Na4Fe(CN)6]在不同 Na 離子含量下的合成效果。如圖 6所示,根據晶體生長的基本理論可知,溶液的濃度可能會影響晶體的生長和成核, Na 離子濃度越高,越偏離原來的立方體結構,越呈現團聚的形狀。
3.3.2多金屬
在某些條件下,多價離子(例如 Mn、Cu、Mg、 Ca、Al 離子)的摻雜可能會使電極材料獲得意想不到的電化學性能。但是,增加的電荷濃度會減慢離子的擴散動力學,從而降低其可回收性。在這方面, Na2FeFe(CN)6具有大的隧道結構和開放的離子傳輸框架,被優先考慮, Na2FeFe(CN)6可以用作多價離子電池的正極材料,并且近年來已經得到了深入的研究。Xie等[40]從三元 Li 離子電池中獲得靈感,研究了 Mn、Co 和 Ni 離子在普魯士藍材料中的性能。使用檸檬酸鹽輔助結晶法將 Mn、Co 和 Ni離子添加到 Na2FeFe(CN)6中以生產高質量的 Na2Mn0.15? Co0.15Ni0.15Ni0.15Fe0.1Fe0.6Fe(CN)6,實現了FeHS位置處多個過渡金屬晶格取代的調制。Li 等[41]基于 Mn 離子的修飾,在合成過程中首次將不同數量的 Sn4+離子引入普魯士藍材料中,并系統地研究了使用 Sn4+離子的效果。
3.3.3蝕刻法
眾所周知,與直接摻雜金屬離子以改善材料性能不同,酸蝕刻是使材料具有多孔結構的常規方法之一。通過緩慢地抑制晶體的生長和蝕刻過程,例如使用 HCl 作為蝕刻劑,合成了具有不同層次結構的普魯士藍,包括蛋黃殼、殼中殼和卵黃雙殼中空結構。 Wang 等[42]通過酸腐蝕一步水熱法制備普魯士藍材料,研究了 HCl 的腐蝕機制,確定了 HCl對普魯士藍材料的結晶生長和腐蝕過程中電池性能的影響。
4 其他類型正極材料
除上述普通正極材料外,有機化合物和聚合物電極材料具有價格低廉、可回收利用和堅固設計的特點。而且,部分有機材料可以從某些植物中提取或者通過有機方法合成,讓材料在生產、使用和廢棄的整個循環過程都體現綠色可持續發展。Miroshnikov等[43]從花瓣中提取了四聚體衍生物(如,四硅油黃酮),并研究了該有機分子的化學和電化學 Na 離子配位特性。通過密度泛函理論和材料的光譜結構分析,四硅油黃酮有機分子在電解質中表現出可逆的 Na 離子偶聯氧化還原作用。為了解決在循環期間由有機材料制成的電極容易溶解在電解質中的問題, Li 等[44]將活性材料與碳基材料(如還原的氧化石墨烯和碳納米管)結合在一起,并使用了醚基電解質。碳基材料[45]不僅可以提高導電性,還可以為有機材料的生長提供基質,以形成新的結構,同時防止活性電極材料的聚集。
5 結論
理想的 Na 離子電池具備以下幾種特點:高的放電容量和功率密度、長的循環使用周期、良好的空氣穩定性、低成本、合成簡單和安全性高。在用于 Na 離子電池的正極材料中,過渡金屬氧化物雖然理論容量比較高,但有著較低的工作電勢和不穩定的結構,與其他正極材料相比,需要高溫煅燒等處理,意味著這種材料難以制備。通過摻雜金屬陽離子(Mg2+、Fe3+和 Mn2+等),可以適當地提高金屬氧化物的結構穩定性和電極電勢。聚陰離子化合物也是研究熱門的正極材料之一,具有良好的熱穩定性、穩定的結構和通道、較低的體積膨脹問題;但聚陰離子正極材料的理論容量通常較低。另外,由于這種材料的電導率通常較低,需要添加導電碳或碳涂層以改善其電化學性能,這會降低材料的能量密度,因此,可以設計具有微納米結構和薄層碳涂覆結構的聚陰離子正極材料。對于普魯士藍類材料,有著優異的電化學性能,較大的隧道結構,在離子的脫嵌過程中該結構也相對穩定;但理論上的普魯士藍材料,具有比較苛刻的合成條件,難以除去結晶水,存在熱安全隱患等問題。 Na 離子電池的有機正極材料有著豐富的原料資源、多樣化的結構和較高的理論容量而受到人們的關注。但是,怎樣有效解決有機材料所帶來的溶解性和導電性問題將成為人們日后的研究重點。隨著能源的進一步渴求, Na 離子電池的研究也在不斷深入, Na 離子電池的比容量、工作電勢和使用壽命將得到進一步提高,新的結構和新的系統將層出不窮,這勢必極大地促進其應用和 Na離子電池的發展。
參考文獻:
[1] SUN Y, SHI P C, CHEN J J, et al. Development andchallenge? of? advanced? nonaqueous? sodium? ionbatteries[J]. EnergyChem, 2020, 2(2):100031.
[2] ZHANG W L, ZHANG F, MING F W, et al. Sodium-ionbattery anodes: Status and future trends[J]. EnergyChem, 2019, 1(2):100012.
[3] 劉旭燕,孫超,韓艷林.鋰離子電池二氧化錫負極材料研究進展[J].上海理工大學學報 , 2018, 40(4):342–349.
[4] LIU X Y, LI M Y, YANG X, et al. Carbon encapsulationand chlorine doping enable Na3V2(PO4)3 superior sodium ion storage properties as cathode material for sodium ion battery[J]. Powder Technology, 2020, 364:70–77.
[5] CAO Y J, XIA X P, LIU Y, et al. Scalable synthesizingnanospherical Na4Fe3(PO4)2(P2O7) growing on MCNTs as a high-performance cathode material for sodium-ion batteries[J]. Journal? of? Power? Sources, 2020, 461:228130.
[6] ZHANG? LL,? LIU? J,? WEI? C,? et? al. N/P-dual-dopedcarbon-coated Na3V2(PO4)2O2F microspheres as a high- performance?? cathode?? material?? for?? sodium-ion batteries[J]. ACS Applied Materials & Interfaces, 2020, 12(3):3670–3680.
[7] NAKAYAMA? M,? YAMADA? S,? JALEM? R,? et? al.Density functional studies of olivine-type LiFePO4 and NaFePO4 as positive electrode materials for rechargeable lithium and sodium ion batteries[J]. Solid State Ionics, 2016, 286:40–44.
[8] ZAKHARKIN M V, DROZHZHIN O A, RYAZANT-SEV S V, et al. Electrochemical properties and evolution of the phase transformation behavior in the NASICON- type Na3+xMnxV2-x(PO4)3(0≤x≤1) cathodes for Na-ion batteries[J]. Journal? of? Power? Sources, 2020, 470:228231.
[9] LIU T F, WANG B, GU X X, et al. All-climate sodiumion? batteries? based? on? the? NASICON? electrode materials[J]. Nano Energy, 2016, 30:756–761.
[10] DELMAS? C,? NADIRI? A,? SOUBEYROUX? J? L. Thenasicon-type titanium phosphates ATi2(PO4)3(A=Li, Na) as electrode materials[J]. Solid State Ionics, 1988, 28–30:419–423.
[11] YUAN Y,? CHEN Z W, YU H X,? et? al. Heteroatom-doped carbon-based materials for lithium and sodium ion batteries[J]. Energy Storage Materials, 2020, 32:65–90.
[12] BARKER J, SAIDI M Y, SWOYER J L. A sodium-ioncell?? based?? on?? the?? fluorophosphate?? compound NaVPO4F[J]. Electrochemical? and? Solid-State? Letters, 2002, 6(1): A1.
[13] PADHI?? A?? K,?? NANJUNDASWAMY?? K?? S,GOODENOUGH? J? B. Phospho-olivines? as? positive- electrode materials for rechargeable lithium batteries[J]. Journal? of The Electrochemical? Society, 1997, 144(4):1188–1194.
[14] PADHI A K, MANIVANNAN V, GOODENOUGH J B.Tuning the position? of the redox? couples? in materials with? NASICON? structure? by? anionic? substitution[J]. Journal? of The Electrochemical? Society, 1998, 145(5):1518–1520.
[15] DENG?? C,?? ZHANG?? S.? 1D?? nanostructuredNa7V4(P2O7)4(PO4) as? high-potential? and? superior- performance?? cathode?? material?? for?? sodium-ion batteries[J]. ACS Applied Materials & Interfaces, 2014, 6(12):9111–9117.
[16] GU Z Y, GUO J Z, SUN Z H, et al. Carbon-coating-increased working voltage and energy density towards an advanced? Na3V2(PO4)2F3@C? cathode? in? sodium-ion batteries[J]. Science Bulletin, 2020, 65(9):702–710.
[17] WANG L, LI Y, WANG Y K, et al. Effect of vacuumassistance? on? the? morphology? and? electrochemical properties of LiMn0.2Fe0.8PO4/C composites prepared by solid-phase method[J]. Electrochimica Acta, 2021, 369:137675.
[18] BAO S, LUO S H, LU J L. Preparation and optimizationof ZrO2 modified P2-type Na2/3Ni1/6Co1/6Mn2/3O2 with enhanced? electrochemical? performance? as? cathode? for sodium? ion? batteries[J]. Ceramics? International, 2020, 46(10):16080–16087.
[19] ZHANG? P,? HUANG? Y? D,? JIA? W,? et? al. High? ratecapability? of? lithium? chromium? titanium? oxide hierarchical? mesoporous? microspheres? anode? materials synthesized by a one-pot Co-precipitation for lithium ion batteries[J]. Journal? of? The? Electrochemical? Society, 2016, 163(9): A1920–A1926.
[20] XIE M, LUO R, LU J, et al. Synthesis-microstructure-performance? relationship? of? layered? transition? metal oxides? as? cathode? for? rechargeable? sodium? batteries prepared? by? high-temperature? calcination[J].? ACSApplied?? Materials? &?? Interfaces,? 2014,? 6(19):17176–17183.
[21] GAO? R? M,? ZHENG? Z? J,? WANG? P? F,? et? al. Recentadvances and prospects of layered transition metal oxide cathodes? for? sodium-ion? batteries[J]. Energy? Storage Materials, 2020, 30:9–26.
[22] WANG Q, CHU S Y, GUO S H. Progress on multiphaselayered transition metal? oxide? cathodes? of sodium? ion batteries[J]. Chinese? Chemical? Letters, 2020, 31(9):2167–2176.
[23] DELMAS? C,? FOUASSIER? C,? HAGENMULLER? P.Structural? classification? and? properties? of the? layered oxides[J]. Physica B+C, 1980, 99(1/4):81–85.
[24] GAO? L,? CHEN? S,? ZHANG? L? L,? et? al. TailoringNaxMnO2 nanosheet arrays with hierarchical construction for efficient sodium ion storage[J]. Journal of Alloys and Compounds, 2019, 782:81–88.
[25] SHI W J, YAN Y W, CHI C, et al. Fluorine anion dopedNa0.44MnO2? with? layer-tunnel? hybrid? structure? as advanced cathode for sodium ion batteries[J]. Journal of Power Sources, 2019, 427:129–137.
[26] LIU X S, ZHONG G M, XIAO Z M, et al. Al and Fe-containing? Mn-based? layered? cathode? with? controlled vacancies? for? high-rate? sodium? ion? batteries[J]. Nano Energy, 2020, 76:104997.
[27] CHEN T R, SHENG T, WU Z G, et al. Cu2+ dual-dopedlayer-tunnel? hybrid? Na0.6Mn1?xCuxO2 as? a? cathode? of sodium-ion? battery? with? enhanced? structure? stability, electrochemical? property,? and? air? stability[J]. ACS Applied? Materials&? Interfaces,? 2018,? 10(12):10147–10156.
[28] PANG W L, ZHANG X H,? GUO J Z,? et? al. P2-typeNa2/3Mn1?xAlxO2? cathode? material? for? sodium-ion batteries: Al-doped enhanced electrochemical properties and studies on the electrode kinetics[J]. Journal of Power Sources, 2017, 356:80–88.
[29] WANG H B, GAO R, LI Z Y, et al. Different effects ofAl? substitution? for? mn? or? fe? on? the? structure? and electrochemical? properties? of Na0.67Mn0.5Fe0.5O2 as? a sodium? ion? battery? cathode? material[J]. Inorganic Chemistry, 2018, 57(9):5249–5257.
[30] LU D, YAO Z J, LI Y Q, et al. Sodium-rich manganeseoxide porous microcubes with polypyrrole coating as a superior cathode for sodium ion full batteries[J]. Journal of Colloid and Interface Science, 2020, 565:218–226.
[31] CRUMBLISS A L, LUGG P S, MOROSOFF N. Alkalimetal cation effects in a Prussian blue surface modifiedelectrode[J].? Inorganic? Chemistry,? 1984,? 23(26):4701–4708.
[32] WANG B Q, HAN Y, WANG X, et al. Prussian blueanalogs for rechargeable batteries[J]. iScience, 2018, 3:110–133.
[33] CHEN? R? J,? HUANG? Y? X,? XIE? M,? et? al. Chemicalinhibition? method? to? synthesize? highly? crystalline prussian blue analogs for sodium-ion battery cathodes[J].ACS? Applied? Materials &? Interfaces, 2016, 8(46):31669–31676.
[34] CHEN R J, HUANG Y X, XIE M, et al. Preparation ofprussian blue submicron particles with a pore structure by two-step optimization for Na-Ion battery cathodes[J]. ACS? Applied? Materials &? Interfaces, 2016, 8(25):16078–16086.
[35] WANG Z H, HUANG Y X, LUO R, et al. Ion-exchangesynthesis of high-energy-density prussian blue analogues for sodium ion battery cathodes with fast kinetics and long durability[J]. Journal of Power Sources, 2019, 436:226868.
[36] FU? H? Y,? XIA? M? Y,? QI? R? J,? et? al. Improved? rateperformance? of? prussian? blue? cathode? materials? for sodium? ion? batteries? induced? by? ion-conductive? solid- electrolyte interphase layer[J]. Journal of Power Sources, 2018, 399:42–48.
[37] LUO? J? H,? SUN? S? X,? PENG? J,? et? al. Graphene-roll-wrapped? prussian? blue? nanospheres? as? a? high- performance? binder-free? cathode? for? sodium-ion batteries[J]. ACS Applied Materials & Interfaces, 2017, 9(30):25317–25322.
[38] YOU? Y,? YU? X? Q,? YIN? Y? X,? et? al. Sodium? ironhexacyanoferrate? with? high? Na? content? as? a? Na-rich cathode material for Na-ion batteries[J]. Nano Research, 2015, 8(1):117–128.
[39] CHEN Y C, WOO H J, RIZWAN M, et al. Nanoscalemorphology? control? of na-rich? prussian? blue? cathodematerials? for? sodium? ion? batteries? with? good? thermal stability[J]. ACS Applied Energy Materials, 2019, 2(12):8570–8579.
[40] XIE B X, ZUO P J, WANG L G, et al. Achieving long-life Prussian blue analogue cathode for Na-ion batteries via? triple-cation? lattice? substitution? and? coordinated water capture[J]. Nano Energy, 2019, 61:201–210.
[41] LI J K, HE X, OSTENDORP S, et al. Tin modificationof? sodium? manganese? hexacyanoferrate? as? a? superior cathode?? material?? for?? sodium?? ion?? batteries[J]. Electrochimica Acta, 2020, 342:135928.
[42] WANG J, LI L, ZUO? S L, et al. Synchronous crystalgrowth and etching optimization of Prussian blue from a single? iron-source? as high-rate? cathode? for? sodium-ionbatteries[J]. Electrochimica Acta, 2020, 341:136057.
[43] MIROSHNIKOV M, KATO K, BABU G, et al. Nature-derived sodium-ion battery: mechanistic insights into na- ion? coordination? within? sustainable? molecular? cathode materials[J]. ACS? Applied? Energy? Materials, 2019,2(12):8596–8604.
[44] LI? A? H,? FENG? Z? Y,? SUN? Y,? et? al. Porous? organicpolymer/RGO? composite? as? high performance? cathode for half and full sodium ion batteries[J]. Journal of Power Sources, 2017, 343:424–430.
[45]劉旭燕, 費海容, 謝繼輝.石墨烯基電極材料在超級電容器中的應用[J].有色金屬材料與工程, 2021, 42(2):53–60.

