衰老標記蛋白30在不同月齡大鼠晶狀體上皮細胞中的表達及其作用*
李思雨,王 潔,Mahamane Doby Djibril,謝子康,左慧懿,唐承業,唐東永,衷 昕,梁 皓
(廣西醫科大學第一附屬醫院眼科,南寧 530021)
衰老標記蛋白30(SMP30)是一種隨年齡增長而逐漸減少的鈣調節蛋白[1],其含量不受性別因素的影響,是一種新型的抗衰老因子[2]。目前對SMP30 的研究主要集中在肝、腎及心臟等領域,并發現其具有抗細胞凋亡、抗氧化損傷、調控細胞增殖、參與維生素C合成、維持細胞內鈣離子穩態等作用[3-7]。但目前有關SMP30 在晶狀體上皮細胞(LECs)中的表達情況及其作用鮮少報道。本研究通過觀察大鼠自然衰老過程中晶狀體形態變化和LECs 凋亡情況,并檢測不同月齡大鼠LECs 中SMP30 的表達,以明確大鼠LECs 中SMP30 的表達與年齡的關系,為研究SMP30 在LECs 中的作用提供新的方向。
1 材料與方法
1.1 實驗動物 24 只不同月齡(0~1 月齡8 只、8~9月齡16 只)SPF 級Wistar 大鼠購于北京維通利華實驗動物技術有限公司,動物生產許可證號:SCXK(京)2016-0006。所有大鼠均飼養于SPF 級動物房內,給予常規固體飼料,自由飲水。本研究動物實驗已取得廣西醫科大學實驗動物倫理委員會批準,審批號:201909018。
1.2 實驗分組及自然衰老動物模型的建立 將大鼠按照鼠齡分為3組:1~2月齡組、9~10月齡組、18~19月齡組。首先購買8只8~9月齡大鼠,飼養至17~18月齡時,再次購買8只8~9月齡和8只0~1月齡大鼠,均繼續飼養1 個月,即獲得18~19 月齡、9~10 月齡、1~2月齡的3組大鼠。
1.3 晶狀體形態觀察 腹腔注射10%水合氯醛麻醉大鼠,用美麗多復方托吡卡胺滴眼液對大鼠進行散瞳,共滴兩次,每次間隔5 min。通過裂隙燈觀察晶狀體是否渾濁并拍照。
1.4 血清氧化應激指標水平檢測 大鼠深度麻醉后開腹,通過腹主動脈取血,靜置30 min后離心,取上層血清,檢測血清中超氧化物歧化酶(SOD)、谷胱甘肽過氧化物酶(GSH-PX)活性和丙二醛(MDA)含量。試劑盒均購于南京建成生物工程研究所,檢測過程嚴格按照試劑盒說明書進行操作。
1.5 TUNEL 法檢測大鼠LECs 凋亡 麻醉處死大鼠后迅速摘取眼球,置于甲醛溶液中固定24 h,石蠟包埋,5 μm 連續切片。切片經脫蠟、水化、洗滌、蛋白酶K工作液消化、破膜工作液破膜處理,按照TUNEL 試劑盒說明書(Servicebio 公司)配置TUNEL反應液,染色及血清封閉過程嚴格按照試劑盒說明書進行操作,最后DAB顯色、蘇木精復染后,脫水封片。顯微鏡下觀察染色結果,凋亡細胞核被染成棕黃色,正常細胞核呈藍色。選取晶狀體前囊膜區域,Image-Pro Plus 6.0軟件計算細胞凋亡率,細胞凋亡率=LECs凋亡細胞數目/LECs總數×100%。
1.6 間接免疫熒光法檢測大鼠LECs 中SMP30 蛋白表達 切片脫蠟、水化、EDTA 抗原修復、PBS 洗滌,BSA 封閉30 min,棄去BSA,放入濕盒中,加SMP30 鼠單克隆抗體(Santa Cruz Biotechnology 公司),存放于4°C 冰箱中孵育過夜。用PBS 洗后加相應二抗室溫下避光孵育50 min,PBS洗滌,加DAPI,10 min后PBS洗滌,封片。熒光顯微鏡下觀察染色結果,選取晶狀體前囊膜區域拍照,使用Image J軟件計算熒光強度。熒光強度越高,表示SMP30蛋白表達越高。
1.7 統計學方法 采用SPSS 23.0統計軟件進行數據分析。計量資料以均數±標準差()表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗,以P<0.05為差異具有統計學意義。
2 結果
2.1 3組血清中SOD、GSH-PX活性和MDA含量比較 隨著大鼠月齡的增長,其血清中SOD 和GSHPx活性呈降低趨勢,而MDA含量呈升高趨勢。18~19 月齡組SOD 活性低于9~10 月齡組和1~2 月齡組,GSH-PX 活性顯著低于1~2 月齡組,MDA 含量明顯高于9~10 月齡組和1~2 月齡組(均P<0.05);9~10月齡組GSH-PX活性明顯低于1~2月齡組(P<0.05),而SOD活性和MDA含量與1~2月齡組比較,差異無統計學意義(P>0.05),見表1。
表1 3組大鼠血清SOD、GSH-PX活性和MDA含量比較
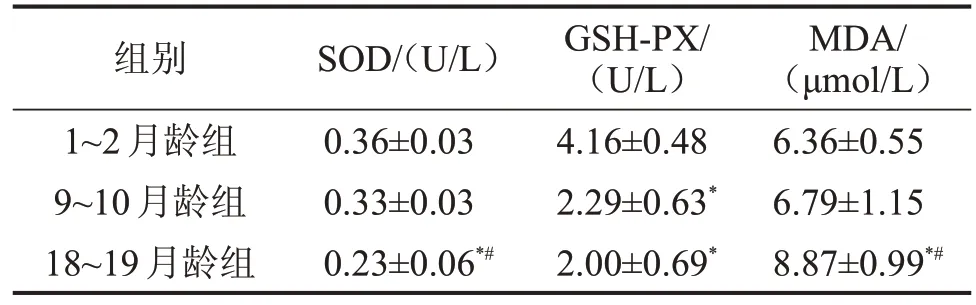
表1 3組大鼠血清SOD、GSH-PX活性和MDA含量比較
與1~2月齡組比較,*P<0.05;與9~10月齡組比較,#P<0.05。
2.2 晶狀體形態學觀察 散瞳后通過裂隙燈觀察顯示3組大鼠晶狀體均透明,見圖1。
2.3 3 組細胞凋亡率比較 1~2 月齡組、9~10 月齡組、18~19 月齡組大鼠LECs 凋亡率分別為(27.51±9.39)%、(32.84±3.76)%、(45.50±9.18)%,18~19 月齡組大鼠LECs 凋亡率顯著高于1~2 月齡組和9~10月齡組(P<0.05),1~2 月齡組與9~10 月齡組比較,差異無統計學意義(P>0.05),見圖2。
2.4 大鼠LECs 中SMP30 蛋白的表達 SMP30 在3組晶狀體囊膜LECs中均呈陽性表達,FITC染色呈綠色熒光。1~2月齡組、9~10月齡組、18~19月齡組大鼠LECs 中SMP30 表達的熒光強度分別為4.36±1.98、2.73±1.14、0.75±0.39,組間兩兩比較,差異均有統計學意義(均P<0.05),其中1~2月齡組熒光強度最高,9~10月齡組次之,18~19月齡組最低,見圖3。
圖1 3組大鼠晶狀體裂隙燈下形態學觀察圖像

圖2 TUNEL染色觀察3組大鼠LECs凋亡情況(×400)
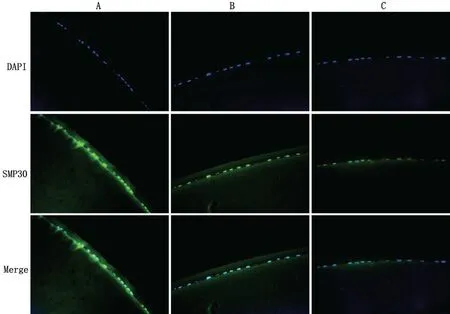
圖3 間接免疫熒光法染色觀察3組大鼠LECs中SMP30蛋白表達(×400)
3 討論
Wistar 大鼠是生物醫學研究中常用的實驗動物,具有飼養簡單、容易繁殖、機體生理病理變化和代謝類型與人類比較接近等特點。大鼠的鼠齡與人的年齡有一定對應關系,即1 月齡左右大鼠相當于人的幼年階段,6 月齡左右大鼠相當于人的青年階段,12 月齡左右大鼠相當于人的成年階段,大于18月齡大鼠相當于人的老年階段[8]。本實驗大鼠長時間飼養過程中可能會受到飼養環境、自身疾病等無法控制因素的影響,與研究目的綜合考慮,選擇把大鼠分為1~2 月齡組、9~10 月齡組和18~19 月齡組3組,模擬人的自然衰老過程,建立大鼠自然衰老模型,研究在大鼠自然衰老過程中,血清和晶狀體衰老指標的改變以及LECs中SMP30的表達變化。
衰老的機制十分復雜,研究者提出機體內自由基代謝紊亂、細胞衰老、基因組不穩定、端粒縮短及表觀遺傳學改變等均為衰老形成的重要因素[9],其中氧自由基學說是發展較早、學界接受度較高的一種衰老理論,此理論指出氧化應激是導致衰老的重要原因。細胞內活性氧(ROS)的生成能力與清除能力處于動態平衡中,若二者失去平衡,將導致氧化應激[10]。SOD 與GSH-PX 是細胞內的抗氧化劑,通過清除細胞內的氧自由基來發揮抗氧化作用[11]。ROS 產生過多會導致細胞脂質過氧化,造成MDA等脂質過氧化物堆積,使細胞受損、生命活力低下,導致器官功能不斷減退,機體逐漸進入衰老階段[12]。因此,在衰老動物體內,SOD、GSH-PX 的活性較低,MDA 的含量較高。目前常用MDA、SOD和GSH-PX 等指標驗證衰老模型的建立是否成功。本研究結果顯示,隨著大鼠月齡的增長,其血清中SOD 和GSH-Px 活性降低,MDA 含量升高(P<0.05)。結果表明,本實驗的自然衰老模型構建成功。
SMP30 是一種隨年齡增長而逐漸減少的鈣調節蛋白[1],其含量不受性別因素的影響,是一種新型的抗衰老因子[2]。近年來研究發現,SMP30 的表達與LECs 的凋亡相關。在臨床研究中,SMP30 在人晶狀體前囊膜LECs 周邊部表達較強,中央部表達較弱,LECs 的凋亡程度與SMP30 的表達呈負相關關系[13-14]。在細胞體外培養研究中,人LECs 系SRA01/04 細胞在正常培養狀態下,下調SMP30 的表達可使細胞凋亡率升高[15];在高鈣及氧化狀態下,SMP30 對SRA01/04 細胞可產生促增殖、抗氧化及抗凋亡的保護作用,且與表達量呈正相關關系[16-19]。本研究探討SMP30 在不同月齡大鼠LECs中的表達變化,發現在大鼠自然衰老模型中,隨著月齡的增加,盡管大鼠晶狀體未出現形態學改變,但其LECs 的凋亡程度加重,SMP30 表達量已經減少,由此推測,在大鼠衰老的過程中,SMP30可能作為一種保護性蛋白,參與了LECs的細胞損傷進程,起到一定程度的抗凋亡作用。本實驗的不足之處在于僅從細胞層面檢測到LECs 的凋亡變化,沒有觀察晶狀體形態學的改變,可能由于大鼠個體差異大、月齡不夠大或者LECs 代謝障礙程度尚未超過SMP30 對LECs 的保護作用等,具體因素還需后續研究。
綜上所述,隨著大鼠月齡的增加,其LECs凋亡增加,SMP30表達降低,提示SMP30可能是LECs的保護因子,在大鼠衰老過程中具有抗LECs 凋亡的保護作用。但是,SMP30 對LECs 發揮保護作用的具體機制仍有待進一步研究。未來,本組擬通過改變大鼠眼內SMP30 的表達量,進一步觀察SMP30抗凋亡、抗氧化和維持細胞內鈣離子穩態等方面的調控作用。

