急性缺血性腦卒中患者炎性因子水平、血壓變異性與病情嚴重程度、預后的相關性研究
周艦,段理成,劉馳
急性缺血性腦卒中(acute ischemic stroke,AIS)占腦卒中的80%,是一種因血液循環障礙而引起腦組織缺氧壞死的心血管疾病[1]。AIS的臨床診斷主要根據癥狀體征、影像學檢查結果等進行綜合判斷,雖然確診率較高,但無法有效顯示患者早期病理改變,以致延誤最佳有效治療時機[2]。基于此,尋找可早期用于診斷及病情評估的實驗室指標對臨床治療方案的制定及患者預后的改善至關重要。多項研究指出,AIS發病與急性炎性反應有關,降鈣素原(procalcitonin,PCT)、白介素6(interleukin-6,IL-6)等常規炎性因子在AIS病情評估中的應用已有報道,但常規炎性因子容易受感染等因素的影響,特異性相對較差[3]。另外,高血壓屬于AIS的危險因素,70%的腦卒中患者發病與高血壓有關,且血壓變異性(blood pressure variability,BPV)異常可直接造成腦血管損傷并促進AIS病情進展,因此采用24 h動態血壓評估患者血壓波動情況有利于判斷其病情,但既往文獻報道BPV指標與AIS患者病情的關系仍未完全明確[4-6]。為此,本研究選取細胞間黏附分子1(intercellular adhesion molecuar-l,ICAM-1)、 單 核細胞趨化蛋白1(monocyte chemotactic protein-1,MCP-1)兩種新型炎癥標志物及BPV指標,探究其與AIS患者病情嚴重程度及預后的相關性,旨在為臨床解釋AIS病理機制及制定治療方案提供依據。
1 對象與方法
1.1 研究對象 選取2017年12月—2019年12月于大冶市人民醫院神經內科接受治療的AIS患者106例為研究對象,其中男58例,女48例;年齡49~86歲,平均年齡(57.6±8.5)歲。納入標準:(1)符合《中國急性缺血性腦卒中診治指南2018》[7]中有關AIS的診斷標準,且經顱腦磁共振成像(magnetic resonance imaging,MRI)、顱腦CT等影像學檢查確診;(2)入院前尚未接受神經內科藥物治療;(3)首次發病且發病至入院時間<24 h;(4)自愿簽署知情同意書。排除標準:(1)發病時間不明確者;(2)入院24 h內經顱腦磁共振擴散加權成像確診為出血性腦卒中或短暫性腦缺血發作者;(3)發病前改良Rankin量表(modified Rankin scale,mRS)評分>2分者;(4)有腦卒中病史,并存在明顯后遺癥者;(5)無法配合頸動脈超聲及24 h動態血壓監測者;(6)病情危重需行急診溶栓治療者;(7)合并急性或慢性感染性疾病者。本研究已獲得大冶市人民醫院倫理委員會批準。
1.2 研究方法
1.2.1 一般資料收集 收集患者一般資料,包括性別、年齡、體質指數(body mass index,BMI)、病變部位、吸煙史、飲酒史、合并癥(高血壓、糖尿病、高脂血癥、肥胖)發生情況。
1.2.2 炎性因子水平檢測 入院當天或次日清晨,采集患者空腹肘靜脈血,常規提取血清保存,采用酶聯免疫吸附試驗測定ICAM-1、MCP-1水平,試劑盒分別購自上海臻科生物科技有限公司與上海慧穎生物科技有限公司,嚴格按照試劑盒說明書進行操作。
1.2.3 BPV指標檢測 采用美國順泰SunTech Oscar2 24 h動態血壓監測儀(上海聚慕醫療器械有限公司生產)對患者進行動態血壓監測,血壓技術為示波震蕩法,測 量 范 圍 為 25~260 mm Hg(1 mm Hg=0.133 kPa)。患者取平臥位,測量左上肢肱動脈血壓。白晝時間為6:00~22:00,時間間隔設置為每30 min測量1次,夜間時間為22:00~次日6:00,時間間隔設置為每1 h測量1次。記錄患者收縮壓(systolic blood pressure,SBP)、舒張壓(diastolic blood pressure,DBP),有效測量值<20%者不予采納,由計算機自動收集有效結果,計算出BPV指標,包括白晝收縮壓標準差(day systolic blood pressure standard deviation,dSSD)、白晝舒張壓標準差(day diastolic blood pressure standard deviation,dDSD)、夜間收縮壓標準差(night systolic blood pressure standard deviation,nSSD)、夜間舒張壓標準差(night diastolic blood pressure standard deviation,nDSD)、24 h收縮壓標準差(24 h systolic blood pressure standard deviation,24 h SSD)、24 h舒張壓標準差(24 h diastolic blood pressure standard deviation,24 h DSD)。
1.2.4 病情嚴重程度評估 采用美國國立衛生研究院卒 中 量 表(National Institutes of Health Stroke Scale,NIHSS)[8]評估患者病情嚴重程度,NIHSS包括意識水平(0~3分)、意識水平提問(0~2分)、意識水平指令(0~2分)、凝視(0~2分)、視野(0~3分)、面癱(0~3分)、上肢運動(左、右側各0~4分)、下肢運動(左、右側各0~4分)、共濟失調(0~2分)、感覺(0~2分)、語言(0~3分)、構音障礙(0~2分)、忽視(0~2分),評分范圍為0~42分。根據NIHSS評分將患者分為輕型組(<4分,37例)、中型組(4~15分,45例)、重型組(>15分,24例)。
1.2.5 預后評估 采用mRS評估患者預后,mRS評分范圍為0~6分,其中0分為無癥狀;1分為有癥狀,但不影響日常活動;2分為存在輕度殘障;3分為存在中度殘障;4分為存在重度殘障;5分為存在嚴重殘障;6分為死亡。根據mRS評分將患者分為預后良好組(0~2分,71例)及預后不良組(>2分,35例)。
1.3 統計學方法 采用SPSS 18.0統計學軟件分析數據。計量資料以(±s)表示,兩組間比較采用成組t檢驗,多組間比較采用單因素方差分析,組間兩兩比較采用SNK-q檢驗;計數資料以相對數表示,組間比較采用χ2檢驗;AIS患者炎性因子水平、BPV指標與病情嚴重程度、預后的相關性分析采用Spearman秩相關分析。以P<0.05為差異有統計學意義。
2 結果
2.1 不同病情嚴重程度組患者一般資料比較 輕型組、中型組、重型組患者性別、年齡、BMI、病變部位、吸煙史、飲酒史、高血壓發生率、糖尿病發生率、高脂血癥發生率、肥胖發生率比較,差異均無統計學意義(P>0.05),見表1。
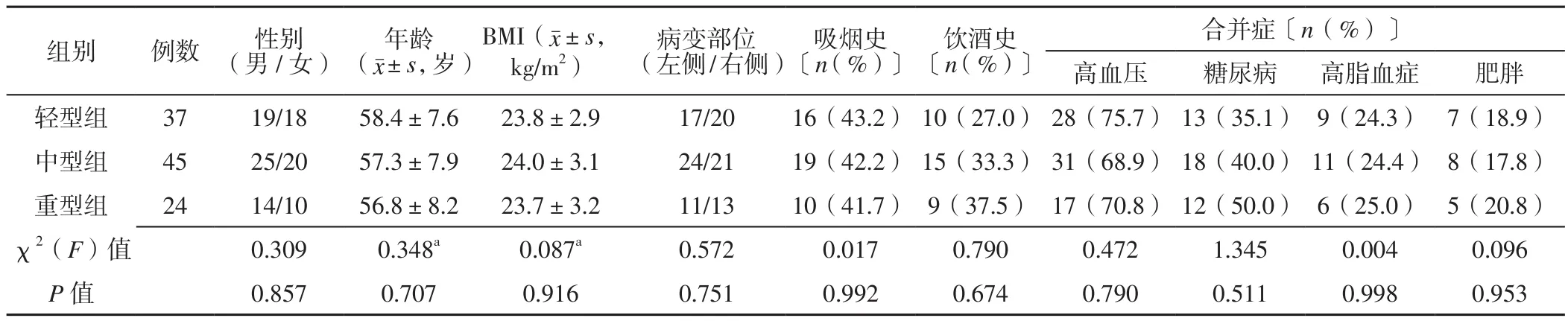
表1 不同病情嚴重程度組患者一般資料比較Table 1 Comparison of general data of patients in different disease severity groups
2.2 不同病情嚴重程度組患者炎性因子水平、BPV指標比較 不同病情嚴重程度組患者ICAM-1、MCP-1水平及dSSD、dDSD、nDSD、24 h SSD、24 h DSD比較,差異有統計學意義(P<0.05);不同病情嚴重程度組患者nSSD比較,差異無統計學意義(P>0.05)。中型組、重型組患者ICAM-1、MCP-1水平及dSSD、dDSD、nDSD、24 h SSD、24 h DSD高于輕型組,差異有統計學意義(P<0.05);重型組患者ICAM-1、MCP-1水平及24 h SSD高于中型組,差異有統計學意義(P<0.05),見表2。
表2 不同病情嚴重程度組患者炎性因子水平、BPV指標比較(±s)Table 2 Comparison of levels of inflammatory factors and BPV indexes of patients in different disease severity groups
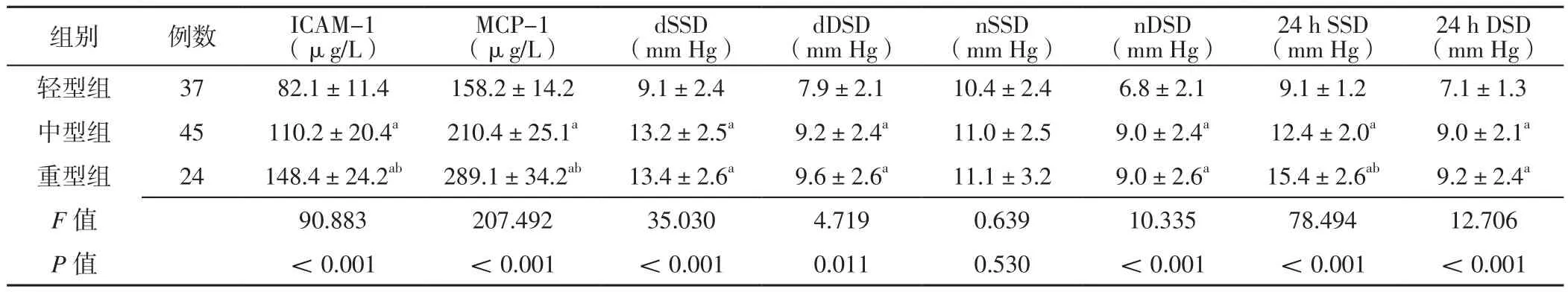
表2 不同病情嚴重程度組患者炎性因子水平、BPV指標比較(±s)Table 2 Comparison of levels of inflammatory factors and BPV indexes of patients in different disease severity groups
注:與輕型組比較,aP<0.05;與中型組比較,bP<0.05;ICAM-1=細胞間黏附分子1,MCP-1=單核細胞趨化蛋白1,dSSD=白晝收縮壓標準差,dDSD=白晝舒張壓標準差,nSSD=夜間收縮壓標準差,nDSD=夜間舒張壓標準差,24 h SSD=24 h收縮壓標準差,24 h DSD=24 h舒張壓標準差
(μg/L)MCP-1(μg/L)dSSD(mm Hg)dDSD(mm Hg)nSSD(mm Hg)nDSD(mm Hg)24 h SSD(mm Hg)24 h DSD(mm Hg)輕型組 37 82.1±11.4 158.2±14.2 9.1±2.4 7.9±2.1 10.4±2.4 6.8±2.1 9.1±1.2 7.1±1.3中型組 45 110.2±20.4a 210.4±25.1a 13.2±2.5a 9.2±2.4a 11.0±2.5 9.0±2.4a 12.4±2.0a 9.0±2.1a重型組 24 148.4±24.2ab 289.1±34.2ab 13.4±2.6a 9.6±2.6a 11.1±3.2 9.0±2.6a 15.4±2.6ab 9.2±2.4a F值 90.883 207.492 35.030 4.719 0.639 10.335 78.494 12.706 P值 <0.001 <0.001 <0.001 0.011 0.530 <0.001 <0.001 <0.001組別 例數 ICAM-1
2.3 AIS患者炎性因子水平、BPV指標與病情嚴重程度的相關性 Spearman秩相關分析結果顯示,AIS患者ICAM-1、MCP-1水平及24 h SSD與病情嚴重程度呈正相關(rs值分別為0.657、0.598、0.527,P值均<0.001);AIS患者dSSD、dDSD、nSSD、nDSD、24 h DSD與病情嚴重程度無直線相關關系(rs值分別為0.314、0.201、0.104、0.345、0.301,P 值分別為 0.097、0.186、0.374、0.062、0.093)。
2.4 不同預后組患者一般資料比較 預后不良組患者年齡、有吸煙史者所占比例、高血壓發生率高于預后良好組,差異有統計學意義(P<0.05);預后不良組與預后良好組患者性別、BMI、病變部位、飲酒史、糖尿病發生率、高脂血癥發生率、肥胖發生率比較,差異無統計學意義(P>0.05),見表3。
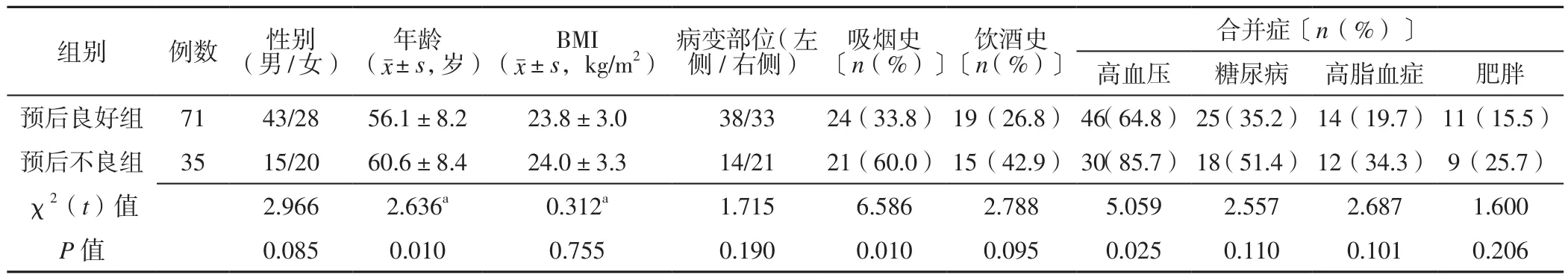
表3 不同預后組患者一般資料比較Table 3 Comparison of general data of patients in different prognosis groups
2.5 不同預后組患者炎性因子水平、BPV指標比較 預后不良組患者ICAM-1、MCP-1水平及dSSD、dDSD、24 h SSD、24 h DSD高于預后良好組,差異有統計學意義(P<0.05);預后不良組與預后良好組患者nSSD、nDSD比較,差異無統計學意義(P>0.05),見表4。
2.6 AIS患者炎性因子水平、BPV指標與預后的相關性 Spearman秩相關分析結果顯示,AIS患者ICAM-1、MCP-1水平及 dSSD、dDSD、24 h SSD、24 h DSD與預后呈正相關(rs值分別為0.601、0.652、0.571、0.458、0.523、0.401,P值均<0.001);AIS患者nSSD、nDSD與預后無直線相關關系(rs值分別為0.120、0.141,P值分別為0.164、0.149)。
3 討論
腦血管疾病中87%為AIS,其具有高致殘率、高發病率、高死亡率等特點[9]。大量臨床研究證實,AIS是一種包括不同臨床癥狀、病因機制及臨床轉歸的綜合征,而非單一疾病,因此其病情進展和預后通常受多種因素影響[10]。本研究結果顯示,預后不良組患者年齡、有吸煙史者所占比例、高血壓發生率高于預后良好組,與既往文獻報道結果相似[11]。此外,有研究表明,AIS患者腦組織缺血可激活局部或全身炎性反應,加重腦組織損傷并對預后造成不利影響[12]。本研究主要分析新型炎性因子ICAM-1、MCP-1水平及BPV指標與AIS患者病情嚴重程度和預后的相關性。
本研究結果顯示,中型組、重型組患者ICAM-1、MCP-1水平高于輕型組,重型組患者ICAM-1、MCP-1水平高于中型組,AIS患者ICAM-1、MCP-1水平與病情嚴重程度呈正相關,提示血清ICAM-1、MCP-1可作為臨床評估AIS患者病情嚴重程度的指標。分析原因,AIS屬于特殊類型的腦損傷疾病,發病后機體產生急性相反應,導致炎性因子大量釋放,引起較強的炎性反應,而炎性反應增強又可促進梗死部位半暗帶的惡化,進而加重病情。ICAM-1為免疫球蛋白超家族的一員,正常生理狀態下其水平極低,而當AIS發病后,腦組織缺血期間,可通過細胞因子的快速誘導促進白細胞向血管周圍聚集,進而引起局部炎性反應,加重病情進展并導致不良預后。劉書芳等[13]報道顯示,急性腦梗死患者血清ICAM-1水平明顯升高且與神經缺損程度和腦梗死容積具有明顯相關性。MCP-1最初在心肌缺血、類風濕性關節炎、動脈粥樣硬化等疾病中的研究較為常見,近十年來越來越多的報道顯示其與神經中樞系統疾病亦具有密切聯系[14]。MCP-1為趨化細胞因子的一種,屬于巨噬細胞、粒細胞等的誘導劑,腦組織損傷后機體大量釋放MCP-1,并可趨化白細胞到炎癥區域,加重病情。此種炎性反應為級聯效應,不僅可引起血管活性物質的大量釋放,破壞其血-腦脊液屏障,還可產生毒性物質,促進細胞凋亡[15]。本研究結果顯示,預后不良組患者ICAM-1、MCP-1水平高于預后良好組,AIS患者ICAM-1、MCP-1水平與預后呈正相關,表明ICAM-1、MCP-1可能通過誘導腦組織發生炎性反應而參與AIS的病情進展,并可在一定程度上反映患者預后情況。此外,考慮ICAM-1與感染類疾病具有聯系[15],本研究排除了急性或慢性感染性疾病患者,以提高結果準確性,而MCP-1不受性別、年齡等因素的影響,對于AIS患者病情嚴重程度和預后具有較高的預測效能[16]。
表4 不同預后組患者炎性因子水平、BPV指標比較(±s)Table 4 Comparison of levels of inflammatory factors and BPV indexes of patients in different prognosis groups
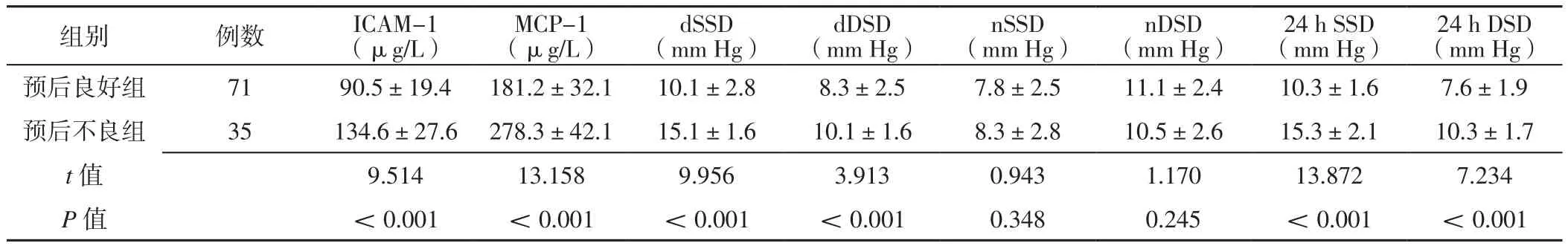
表4 不同預后組患者炎性因子水平、BPV指標比較(±s)Table 4 Comparison of levels of inflammatory factors and BPV indexes of patients in different prognosis groups
組別 例數 ICAM-1(μg/L)MCP-1(μg/L)dSSD(mm Hg)dDSD(mm Hg)nSSD(mm Hg)nDSD(mm Hg)24 h SSD(mm Hg)24 h DSD(mm Hg)預后良好組 71 90.5±19.4 181.2±32.1 10.1±2.8 8.3±2.5 7.8±2.5 11.1±2.4 10.3±1.6 7.6±1.9預后不良組 35 134.6±27.6 278.3±42.1 15.1±1.6 10.1±1.6 8.3±2.8 10.5±2.6 15.3±2.1 10.3±1.7 t值 9.514 13.158 9.956 3.913 0.943 1.170 13.872 7.234 P值 <0.001 <0.001 <0.001 <0.001 0.348 0.245 <0.001 <0.001
BPV又稱血壓波動性,指的是血壓在一段時間內的波動狀態,受神經內分泌系統及其他系統的綜合調節。研究表明,70%的AIS患者發病時會伴有不同程度的血壓升高[17]。本研究結果顯示,中型組、重型組患者dSSD、dDSD、nDSD、24 h SSD、24 h DSD高于輕型組,重型組患者24 h SSD高于中型組,表明隨著病情的加重患者的血壓波動增大,但考慮到AIS病理機制較為復雜,且中型組與重型組患者病情受其他因素影響較多,因而其之間的血壓波動不易產生差距。此外,預后不良組患者dSSD、dDSD、24 h SSD、24 h DSD高于預后良好組,提示部分BPV指標對AIS患者預后的評估可能具有一定意義;而Spearman秩相關分析結果顯示,AIS患者dSSD、dDSD、24 h SSD、24 h DSD與預后呈正相關,分析原因如下:AIS發病后伴隨血壓異常升高,造成BPV增大,而過大的血壓波動可導致血管壁破壞,血流穩定性變差,從而引起內皮功能損傷,促進動脈粥樣斑塊形成,不利于預后。另外,血壓的突然升高還可導致腦血管張力增大,進而破裂出血,需要引起足夠重視[18]。
綜上所述,炎性因子、BPV均參與了AIS的發生發展,其中ICAM-1、MCP-1水平及24 h SSD與患者病情嚴重程度及預后均呈正相關,而dSSD、dDSD、24 h DSD僅與患者預后呈正相關。表明監測AIS患者血清ICAM-1、MCP-1水平和BPV可為判斷病情嚴重程度和預后提供參考依據,且其操作較為簡單、完全無創,具有一定臨床可行性。但本研究樣本量較小,而ICAM-1、MCP-1和BPV均容易受外界因素影響,因此該結果的準確性還有待更多大樣本量的多中心研究進一步證實,同時上述指標對AIS患者預后的實際預測價值也需要進一步深入分析。
作者貢獻:周艦進行文章的構思與設計、研究的實施與可行性分析、結果的分析與解釋,撰寫論文,進行論文、英文的修訂,負責文章的質量控制及審校,并對文章整體負責、監督管理;周艦、段理成、劉馳進行數據收集;周艦、段理成進行數據整理;段理成進行統計學處理。
本文無利益沖突。

